花椒毒酚对大鼠脊髓型颈椎病的治疗作用及机制
2021-11-19王洪流董又坤廖志刚张爱明
王洪流,董又坤,廖志刚,张爱明
(荆州市第二人民医院神经外科,湖北 荆州 434000)
脊髓型颈椎病(cervical spondylitis myelopathy,CSM)约占颈椎病总发病人数的20%,属于临床颈椎病中最常见且预后较差的分型[1-2]。CSM的病理生理机制为颈椎退行性改变致脊髓压迫引起血供不足,继发各类脊髓功能障碍,临床特征以进行加重性四肢瘫痪为主,早期肢体僵硬、精细动作失灵,直至出现四肢瘫痪,患者生活质量显著恶化,预后差。
有研究发现,退行性变的颈椎间盘通过持续释放多种细胞因子在CSM病理生理进程中占据重要作用[1,3]。KIM等[4]研究发现,膝骨关节炎患者的膝关节滑膜及关节液中白细胞介素-1β(interleukin-1β,IL-1β)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)等细胞因子显著过表达,并与膝关节软骨破坏和炎症过程密切关联。黄子达[5]研究发现,炎症相关细胞因子及其细胞信号通路如核因子-κB(nuclear factor kappa-B,NF-κB)信号通路在CSM的病理进程中可能存在调控作用。
花椒毒酚是一种从中草药蛇床子中提取的香豆素化合物。有研究表明,花椒毒酚具有抗炎、抗氧化、镇痛等生物学作用,已在骨关节疾病中得到初步应用[6];但花椒毒酚在颈椎间盘软骨组织中是否有效尚不确定。因此,本研究通过注射骨形态发生蛋白(bone morphogenetic protein,BMP)构建大鼠CSM模型,探讨花椒毒酚在CSM动物模型中的作用及其相关作用机制,为临床应用提供依据。
1 材料与方法
1.1 实验动物50只无特定病原级成年Sprague Dawley大鼠购自武汉大学基础医学院动物实验中心(许可证号:20191029AS),8~10周龄、体质量200~220 g、雌雄不拘,所有操作遵循动物护理和使用委员会批准。将大鼠饲养于12 h明/暗交替环境,自由获取食物和水,造模前适应生存环境至少3 d。
1.2 主要试剂与仪器BMP购自上海齐一生物科技有限公司,花椒毒酚购自南京道斯夫生物科技有限公司,二甲基亚砜(dimethyl sulfoxide,DMSO)溶液购自湖北万业医药有限公司,水合氯醛购自武汉沃轩科技有限公司,苏木精-伊红(hematoxylin-eosin,HE)购自南昌雨露实验器材有限公司,大鼠白细胞介素(interleukin,IL)-6、IL-1β、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)试剂盒购自上海皓元生物医药科技有限公司,二喹啉甲酸(bicinchoninic acid,BCA)法蛋白定量试剂盒购自上海北诺生物科技有限公司,甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)、NOD样受体蛋白3(NOD-like receptor protein 3,NLRP3)、NF-κB p65、磷酸化核因子-κB p65(phosphorylated nuclear factor kappa-B,p-NF-κB p65)一抗和免疫印迹荧光标记山羊抗兔免疫球蛋白G(immunoglobulin G,IgG)二抗购自武汉谷肽生物试剂公司,电化学发光(electrochemiluminescence,ECL)显色液购自美国Bio-Rad公司;凝胶电泳系统购自北京六一仪器厂,凝胶电泳转移系统购自美国Bio-Rad公司,聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜购自美国Millipore公司。
1.3 实验方法
1.3.1 动物模型制备与分组将50只大鼠适应性喂养14 d后按随机数字表法分为假手术组(n=12)、模型组(n=13)、低剂量花椒毒酚组(n=12)和高剂量花椒毒酚组(n=13)。使用300 mg·kg-1水合氯醛行腹腔注射麻醉大鼠,碘伏消毒后于颈前正中偏右做纵向切口,长2~3 cm,钝性分开椎体前肌肉组织,骨膜下剥离,显露椎体前方及椎间隙。在X线下定位确认第4和第5颈椎椎体,将4号空针插入第4和第5颈椎椎间隙距椎体后缘约0.5 mm处,进针深度不得超过3 mm。将0.1 mL 体积分数95% BMP溶于20 mL的氯化钙(10 g·L-1)中制成混悬液。模型组、低剂量花椒毒酚组和高剂量花椒毒酚组大鼠于第4至第5颈椎椎间隙注入0.2 mL BMP混悬液制备脊髓型颈椎病大鼠模型,假手术组大鼠注射0.2 mL生理盐水。造模后第 3天,低剂量花椒毒酚组和高剂量花椒毒酚组大鼠分别给予腹腔注射5、10 mg·kg-1花椒毒酚溶液,假手术组和模型组大鼠给予腹腔注射等量生理盐水,所有大鼠均隔日注射1次,连续注射7次,于造模术后2周内完成所有注射。
1.3.2 颈椎间盘滑膜组织和关节液及血清取材和保存造模后第4周,4组大鼠经尾静脉采血1 mL,1 500 r·min-1离心15 min,收集上层血清保存备用。采用拉颈脱臼法处死所有大鼠,取颈椎间盘滑膜组织,应用40 g·L-1多聚甲醛固定,用于大鼠颈椎间盘滑膜组织病理学观察;其余颈椎间盘滑膜组织置于-80 ℃冰箱保存备用。另外取大鼠颈椎间盘关节液,1 500 r·min-1离心15 min,收集上清液,置于-70 ℃冰箱保存备用。
1.3.3 HE染色观察4组大鼠颈椎间盘滑膜组织病理学情况取多聚甲醛固定的大鼠颈椎间盘组织,剥离大鼠颈椎间盘关节腔,取滑膜,常规乙醇梯度脱水,二甲苯透明,石蜡包埋,切片(片厚5 mm),HE染色,脱水透明后中性树胶封片,在光学显微镜下观察大鼠椎间盘滑膜组织病理学情况。
1.3.4 改良Rivlin斜板实验观察4组大鼠运动功能分别于造模前及造模后第4周,将大鼠置于可调节倾斜角度的橡胶面板,不断增加面板倾斜角度,观测大鼠在面板之上维持位置不变至少5 s的最大倾斜角度,调整头尾方向再测1次。实验重复2次,取平均值。最大倾斜角度越大表示大鼠运动功能越好。
1.3.5 ELISA法检测4组大鼠血清及颈椎间盘关节液中IL-6、IL-1β、TNF-α表达水平取保存的血清和颈椎间盘关节液上清,室温解冻,采用ELISA法检测,严格按照大鼠IL-6、IL-1β、TNF-α ELISA试剂盒说明书进行操作;使用酶标仪检测波长450 nm处的吸光度值,绘制标准曲线,计算大鼠血清及颈椎间盘关节液上清中IL-6、IL-1β、TNF-α表达水平。
1.3.6 Western blot法检测4组大鼠颈椎间盘滑膜组织中NLRP3、p-NF-κB p65、NF-κB p65蛋白相对表达量取4组大鼠-80 ℃冰箱保存的颈椎间盘滑膜组织,于匀浆器中尽量剪碎,加入裂解液于冰上裂解,采用BCA法测定蛋白浓度。使用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离蛋白,湿转法转至聚偏二氟乙烯膜上,加入脱脂牛奶封闭1 h;加入NLRP3(11 000)、p-NF-κB p65(11 000)、NF-κB p65(11 000)一抗,4 ℃孵育过夜。加入免疫印迹荧光标记山羊抗兔IgG二抗(13 000),37 ℃孵育 40 min。滴加ECL显色液,暗室中曝光、显影,应用化学发光成像系统进行图像采集,应用Image J软件分析各条带灰度值,以GAPDH为内参,目的蛋白灰度值与内参蛋白灰度值比值表示目的蛋白相对表达量,并计算p-NF-κB p65和NF-κB p65蛋白相对表达量比值。

2 结果
2.1 各组大鼠造模后一般情况造模后第4周时,共3只大鼠死亡(假手术组1只、低剂量花椒毒酚组2只),其余大鼠的总体生长状态良好,毛发密实、光亮顺滑。模型组大鼠活动量略少,动作不如其他3组敏捷,呼吸幅度略显急促。
2.2 4组大鼠颈椎间盘滑膜组织病理学变化结果见图1。假手术组大鼠的椎间盘滑膜组织结构完整,滑膜细胞排列整齐,未见显著炎症细胞浸润、充血及水肿;模型组大鼠可见滑膜组织结构显著增生、肿胀,表层细胞呈栅栏样排列,广泛存在炎症细胞浸润及脂肪组织填充;低剂量花椒毒酚组大鼠可见滑膜组织内炎症细胞浸润,程度较模型组显著减轻,可见纤维化改变,间质内可见脂肪组织填充;高剂量花椒毒酚组未见明显炎症细胞浸润,增生及肿胀程度较低剂量花椒毒酚组缓解,纤维化不明显,间质内填充脂肪组织减少。
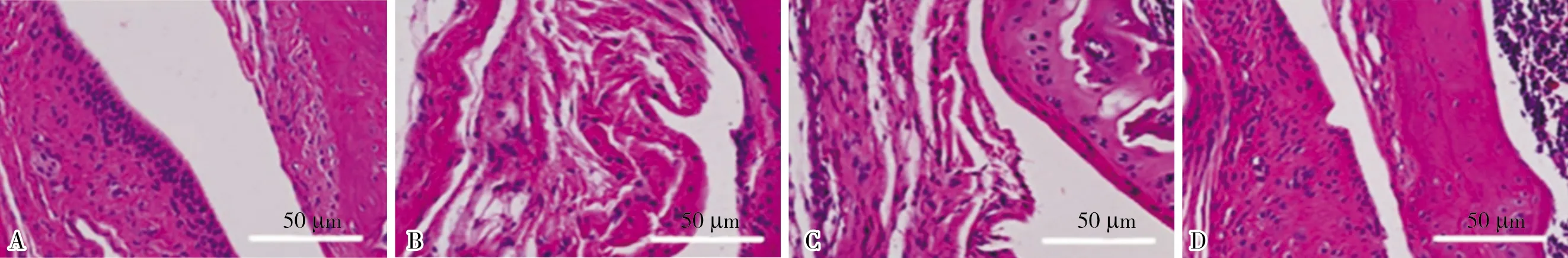
A:假手术组;B:模型组;C:低剂量花椒毒酚组;D:高剂量花椒毒酚组。
2.3 4组大鼠运动功能比较结果见表1。造模前,4组大鼠的改良Rivlin实验最大倾斜角度比较差异无统计学意义(F=2.785,P>0.05)。造模后第4周,假手术组大鼠的改良Rivlin斜板实验最大倾斜角度与造模前比较差异无统计学意义(P>0.05)。造模后第4周,模型组、低剂量花椒毒酚组、高剂量花椒毒酚组大鼠的改良Rivlin斜板实验最大倾斜角度均显著低于造模前,差异有统计学意义(P<0.05)。造模后第4周,4组大鼠的改良Rivlin斜板实验最大倾斜角度比较差异有统计学意义(F=26.055,P<0.05)。造模后第4周,模型组、低剂量花椒毒酚组、高剂量花椒毒酚组大鼠的改良Rivlin斜板实验最大倾斜角度均显著低于假手术组,差异有统计学意义(P<0.05);低剂量花椒毒酚组、高剂量花椒毒酚组大鼠的改良Rivlin斜板实验最大倾斜角度均显著高于模型组,差异有统计学意义(P<0.05);低剂量花椒毒酚组与高剂量花椒毒酚组大鼠的改良Rivlin实验最大倾斜角度比较差异无统计学意义(P>0.05)。

表1 4组大鼠造模前后改良Rivlin斜板实验最大倾斜角度比较
2.4 4组大鼠血清及颈椎间盘关节液中IL-6、IL-1β、TNF-α水平比较结果见表2。模型组、低剂量花椒毒酚组、高剂量花椒毒酚组大鼠血清及颈椎间盘关节液中IL-6水平均显著高于假手术组,差异有统计学意义(P<0.05)。

表2 4组大鼠血清及颈椎间盘关节液中IL-6、IL-1β、TNF-α水平比较
模型组、低剂量花椒毒酚组大鼠血清及颈椎间盘关节液中IL-1β水平均显著高于假手术组,差异有统计学意义(P<0.05)。低剂量花椒毒酚组大鼠血清中IL-1β水平显著低于模型组,差异有统计学意义(P<0.05)。低剂量花椒毒酚组大鼠关节液中IL-1β水平与模型组比较差异无统计学意义(P>0.05)。高剂量花椒毒酚组大鼠血清及颈椎间盘关节液中IL-1β水平均显著低于低剂量花椒毒酚组,差异有统计学意义(P<0.05)。高剂量花椒毒酚组大鼠血清及颈椎间盘关节液中IL-1β水平与假手术组比较差异无统计学意义(P>0.05)。
模型组大鼠血清及颈椎间盘关节液中TNF-α水平均显著高于假手术组,差异有统计学意义(P<0.05)。低剂量花椒毒酚组大鼠颈椎间盘关节液中TNF-α水平显著高于假手术组,差异有统计学意义(P<0.05)。高剂量花椒毒酚组大鼠椎间盘关节液中TNF-α水平显著低于假手术组,差异有统计学意义(P<0.05)。低剂量花椒毒酚组、高剂量花椒毒酚组大鼠血清及颈椎间盘关节液中TNF-α水平均显著低于模型组,差异有统计学意义(P<0.05)。高剂量花椒毒酚组大鼠颈椎间盘关节液中TNF-α水平显著低于低剂量花椒毒酚组,差异有统计学意义(P<0.05)。低剂量花椒毒酚组、高剂量花椒毒酚组大鼠血清中TNF-α水平与假手术组比较差异无统计学意义(P>0.05)。高剂量花椒毒酚组大鼠血清中TNF-α水平与低剂量花椒毒酚组比较差异无统计学意义(P>0.05)。
2.5 4组大鼠颈椎间盘滑膜组织中NLRP3蛋白相对表达量及p-NF-κB p65/NF-κB p65比较结果见图2和表3。与假手术组比较,模型组和低剂量花椒毒酚组大鼠颈椎间盘滑膜组织中NLRP3蛋白相对表达量、p-NF-κB p65/NF-κB p65均显著升高,高剂量花椒毒酚组大鼠颈椎间盘滑膜组织中NLRP3蛋白相对表达量、p-NF-κB p65/NF-κB p65显著降低,差异有统计学意义(P<0.05)。低剂量花椒毒酚组和高剂量花椒毒酚组大鼠颈椎间盘滑膜组织中NLRP3蛋白相对表达量、p-NF-κB p65/NF-κB p65均显著低于模型组,差异有统计学意义(P<0.05)。高剂量花椒毒酚组大鼠颈椎间盘滑膜组织中NLRP3蛋白相对表达量显著低于低剂量花椒毒酚组,差异有统计学意义(P<0.05)。高剂量花椒毒酚组大鼠颈椎间盘滑膜组织中p-NF-κB p65/NF-κB p65与低剂量花椒毒酚组比较差异无统计学意义(P>0.05)。

A:假手术组;B:模型组;C:低剂量花椒量酚组;D:高剂花椒毒酚组。

表3 4组大鼠颈椎间盘滑膜组织中NLRP3蛋白相对表达量及p-NF-κB p65/NF-κB p65比较
3 讨论
脊髓约70%的血液由脊髓前动脉及相应沟动脉供给,脊髓前动脉位于髓体前正中,呈纵行走向,易受椎体骨突及退行性椎间盘压迫,导致脊髓前动脉内皮细胞受损,基底膜外露、血小板黏附,形成微小血栓阻塞管腔,造成脊髓内微循环障碍[5,7]。随着脊髓微血管循环障碍加重,脊髓功能受影响直至出现神经症状,这是CSM的主要发病机制。
BMP及其受体在颈椎间盘组织中呈特异性高表达,BMP可充分调节成骨细胞、成软骨细胞、成纤维细胞等间充质细胞的形成和凋亡,具有强大的异位骨化能力[8-9]。本研究通过在大鼠颈椎间盘后缘注射BMP促进增生骨化,从而模拟CSM的病理进程。造模后第4周,假手术组大鼠改良Rivlin斜板实验最大倾斜角度与造模前比较差异无统计学意义;模型组、低剂量花椒毒酚组、高剂量花椒毒酚组大鼠改良Rivlin斜板实验最大倾斜角度均显著低于造模前;提示注射BMP的模型组、低剂量花椒毒酚组、高剂量花椒毒酚组大鼠运动功能均显著下降,表明该动物模型确实模拟了CSM所致的运动功能障碍。此外,低剂量花椒毒酚组、高剂量花椒毒酚组大鼠改良Rivlin斜板实验最大倾斜角度均显著高于模型组,低剂量花椒毒酚组与高剂量花椒毒酚组大鼠改良Rivlin斜板实验最大倾斜角度比较差异无统计学意义;表明花椒毒酚对于CSM所致运动功能障碍存在一定缓解作用,但并未发现花椒毒酚对运动功能的缓解作用存在剂量效应。
炎症因子活化是关节软骨产生炎症浸润反应的主要原因,例如IL-1β不仅促进关节滑膜炎症细胞浸润,还能参与调节IL-6和TNF-α等炎症因子水平;炎症因子IL-6、IL-1β、TNF-α可参与并激活白细胞附壁、血管通透性增加、渗出等炎症反应,显著影响机体组织破坏、水肿、异常分化等多重病理进程[10],在CSM病理进程中表现为促进炎症细胞聚集并加速颈椎间盘退变[11]。本研究发现,模型组大鼠血液及颈椎间盘关节液中的IL-6、IL-1β、TNF-α水平均显著高于假手术组,再次证实本研究动物模型造模成功。模型组、低剂量花椒毒酚组、高剂量花椒毒酚组大鼠血清及颈椎间盘关节液中IL-6水平比较差异无统计学意义;低剂量花椒毒酚组大鼠血清中IL-1β水平显著低于模型组,高剂量花椒毒酚组大鼠血清及颈椎间盘关节液中IL-1β水平均显著低于模型组和低剂量花椒毒酚组;低剂量花椒毒酚组、高剂量花椒毒酚组大鼠血清及颈椎间盘关节液中TNF-α水平均显著低于模型组,高剂量花椒毒酚组大鼠颈椎间盘关节液中TNF-α水平显著低于低剂量花椒毒酚组;提示予以不同剂量的花椒毒酚干预后,大鼠血液及关节液中的IL-1β和TNF-α水平均呈现不同程度的降低,且呈剂量依赖性,花椒毒酚可能通过抑制颈椎间盘软骨释放炎症因子IL-1β和TNF-α,对大鼠CSM病理进程发挥一定的缓解作用。
炎症反应的典型表现为组织损伤及炎症小体诱导的炎症因子局部浸润。炎症小体是以NLRP3蛋白为主要成分的细胞质多蛋白复合物,NLRP3蛋白不仅可诱导促炎细胞因子的生成,其异常激活可促使大量炎症因子局部浸润,导致组织损伤、软骨破坏及异常分化[4,12]。因此,NLRP3蛋白水平与炎症因子的浸润程度密切相关。本研究发现,模型组大鼠颈椎间盘滑膜组织中NLRP3蛋白相对表达量显著高于假手术组,低剂量花椒毒酚组和高剂量花椒毒酚组大鼠颈椎间盘滑膜组织中NLRP3蛋白相对表达量均显著低于模型组,高剂量花椒毒酚组大鼠颈椎间盘滑膜组织中NLRP3蛋白相对表达量显著低于低剂量花椒毒酚组,提示花椒毒酚可通过抑制NLRP3蛋白水平,对大鼠CSM病理进程发挥一定的缓解作用,且呈剂量依赖性。
NF-κB通路作为调节机体多种生理过程的重要信号通路,不仅调节机体免疫、炎症反应及肿瘤等生理病理进程,还广泛参与细胞周期调控、细胞分化及感染。NF-κB是一种常见的转录因子,由2类亚基形成同源或异源二聚体,最常见的NF-κB亚基组成形式为p65。NF-κB p65蛋白可通过磷酸化上调炎症因子表达,活化炎症进程,继而在下游调节IL相关基因、凋亡抑制因子等表达介导炎症反应[13]。本研究发现,模型组、低剂量花椒毒酚组、高剂量花椒毒酚组大鼠颈椎间盘滑膜组织中p-NF-κB p65/NF-κB p65均显著低于假手术组,低剂量花椒毒酚组和高剂量花椒毒酚组大鼠颈椎间盘滑膜组织中p-NF-κB p65/NF-κB p65均显著低于模型组,高剂量花椒毒酚组大鼠颈椎间盘滑膜组织中p-NF-κB p65/NF-κB p65与低剂量花椒毒酚组比较差异无统计学意义,提示NF-κB信号通路激活可能促进CSM病理进程,花椒毒酚通过抑制NF-κB信号通路发挥其抗炎作用,但并未发现花椒毒酚对于NF-κB p65蛋白磷酸化存在剂量依赖性效应。
有研究显示,NF-κB与丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路关系密切,均具有广泛调节炎症介质的分化作用[14]。NF-κB信号通路位于MAPK信号通路的下游,活化p38 MAPK激酶可促进炎症细胞因子的表达,进而活化NF-κB,是MAPK信号途径下游的重要位点之一。本研究显示,花椒毒酚通过抑制NLRP3蛋白及下调NF-κB信号通路活性,发挥对颈椎间盘的保护作用,提示花椒毒酚发挥对CSM的缓解作用可能与MAPK信号通路有关,后期将进一步研究证实。
综上所述,花椒毒酚可通过抑制大鼠血清及颈椎间盘关节液中的炎症因子IL-1β、TNF-α水平缓解CSM病理进程,其机制可能与抑制大鼠颈椎间盘滑膜组织中NLRP3蛋白水平及下调NF-κB信号通路磷酸化有关。本实验为今后CSM动物模型的深入研究及花椒毒酚的临床应用提供了依据。花椒毒酚对治疗CSM是否存在确切剂量效应仍需下阶段进一步探寻。
