人参皂苷Rg1 对高糖诱导的肾小管上皮细胞损伤保护作用
2021-11-18温玉玮杜美娟
韩 宇,温玉玮,杜美娟,迟 妍
(丹东市中医院 内一科,辽宁 丹东 118000)
糖尿病肾病(Diabetic nephropathy,DN)是一种慢性微血管并发症,不仅是糖尿病患者最严重的并发症之一,也是慢性肾脏疾病的主要原因。DN 最常见特征之一是肾小管间质纤维化,它在糖尿病性肾损伤中早期出现,是一种慢性炎症反应,会加速肾衰竭[1]。先前的研究表明,高血糖、持续性炎症或上皮损伤等均可引起肾小管间质形成纤维化[2]。高糖诱导的肾小管上皮细胞的内皮间充质转变(EMT)是肾小球硬化的关键过程,并且在包括E-钙粘蛋白(E-cadherin)和α- 平滑肌肌动蛋白(α-SMA)在内的多种因素的介导下,上皮细胞可能会失去其上皮特性,并且获得间质细胞特性[3]。目前研究显示,转化生长因子-β1(TGF-β1)不仅是关键的调节分子,而且还是EMT 和肾纤维化的治疗靶点,已经成为广大学者的关注焦点[4]。因此,减少炎症及纤维化药理方法是DN 的潜在治疗策略。人参皂苷Rg1 作为传统名贵中药人参的主要活性成分,对多种疾病具有药理作用,包括糖尿病、神经系统疾病、心血管疾病和癌症[5]。几项研究证明了人参皂苷Rg1 具有抗炎和抗纤维化作用,并且能够有效抑制肾炎[6]。然而,人参皂苷Rg1 是否能够减轻高糖诱导的人肾小管上皮细胞炎症反应和纤维化尚不清楚。因此,本实验旨在探究人参皂苷Rg1 对高糖诱导的人肾小管上皮细胞炎症反应和纤维化的影响及其潜在的分子机制,以期为DN的治疗提供实验依据。
1 材料与方法
1.1 细胞、试剂及仪器
人肾小管上皮细胞HK-2(中国科学院上海细胞库);人参皂苷Rg1(北京百奥莱博科技有限公司,批号:0703-201921);DMEM 低糖培养基、胎牛血清和胰蛋白酶(美国Gibco 公司,批号:C11995500BT、16000-044、25200-056);CCK-8 试剂(美 国Abcam 公 司,批 号:ab1880);IL-1β 和TNF-α ELISA 检测试剂盒(上海酶联生物科技有限公司,批号:0302160408、0302160410);α-SMA、E-cadherin、Fn、TGF-β1、Smad 2 和Smad 3 单抗(美国CST 公司,批号:40995、13677、5274、4896、9260、8688);辣根过氧化物酶标记的二抗(北京中杉金桥生物技术有限公司,批号:A0182);BCA 蛋白浓度检测试剂盒(碧云天生物技术研究所,批号:C1034);RNA 提取试剂盒、逆转录试剂盒、实时荧光定量PCR 检测试剂盒和ECL 化学发光试剂(赛默飞世尔科技有限公司,货号:AM1793、4374966、A25741、34580);引物(上海生工生物工程有限公司)。
HF160W 型二氧化碳培养箱(上海力申科学仪器有限公司);NovoCyte 3008 型流式细胞仪(美国艾森生物有限公司);MK3 型全自动 酶 标 仪 和ABI7500 型 实 时 荧 光 定 量PCR 仪(美国Thermo公司);CKX31 型 倒 置 荧 光 显 微 镜(日本奥林巴斯株式会社);EPS200 型电泳仪(上海天能科技有限公司)。
1.2 细胞培养和药物处理
HK-2 细胞培养在DMEM 低糖培养液(含10%胎牛血清)中,置于5% CO2、37 ℃、饱和湿度的培养箱中进行培养,待细胞贴壁后进行传代,取对数增殖期的HK-2 细胞用于后续实验。
1.3 CCK-8 实验
生长状态良好的HK-2 细胞接种在96 孔板中,接种密度为5×104个/孔,放置在37 ℃培养箱培养24 h,将细胞随机分为四组,每组设6 个复孔,分别采用含0、10、20、40 μg/mL 人参皂苷Rg1 的DMEM 培养液进行培养,其中,0 μg/mL 的细胞作为空白对照组,48 h 时向每组各孔细胞中加入10 μL CCK-8 溶液,随后放置在37 ℃培养箱孵育30 min,使用酶标仪测定每孔细胞的光密度值(OD值),波长为450 nm,计算各组细胞的相对存活率,即相对存活率(%)=实验组OD值/对照组OD值×100%。
1.4 细胞药物处理和分组
对数期的HK-2 细胞随机分为:正常对照组,即采用含5.5 mmol/L 葡萄糖的DMEM 培养液进行培养;高糖组,即采用含30 mmol/L 葡萄糖的DMEM培养液进行培养;低人参皂苷Rg1 组,即采用含30 mmol/L 葡 萄 糖+ 10 μg/mL 人 参 皂 苷Rg1 的DMEM 培养液进行培养;高人参皂苷Rg1 组,即采用含30 mmol/L 葡萄糖+ 40 μg/mL 人参皂苷Rg1 的DMEM 培养液进行培养。
1.5 ELISA 实验
HK-2 细胞药物处理48 h 后,收集各组HK-2 细胞上清液,按照ELISA 检测试剂盒使用说明,使用酶标仪测定450 nm 和570 nm 处吸光度值,分别计算各组细胞上清液中IL-1β 和TNF-α 的含量。
1.6 qPCR 检测
药物处理48 h 的各组HK-2 细胞以胰蛋白酶消化,收集到离心管中,采用RNA 提取试剂盒抽提总RNA,去除基因组DNA 后测定RNA 的浓度,使用逆转录试剂盒合成cDNA,以管家基因GAPDH 为内参,以获得的cDNA 为模板,使用实时荧光定量PCR 检测试剂盒行qPCR 检测,采用2-△△Ct法分析数据。引物信息见表1。

表1 引物序列Tab. 1 Primer sequence
1.7 Western blot 实验
HK-2 细胞药物处理48 h 后,除去细胞上清液,加入适量PBS 洗涤3 次,加入细胞裂解液放置在冰上裂解细胞,收集各组细胞裂解液至离心管中,离心取上清(蛋白样品),BCA 蛋白浓度检测试剂盒测定蛋白样品浓度。SDS-PAGE 缓冲液与蛋白样品等比例混合,沸水浴10 min,致蛋白质变性,取40 μg 蛋白加样,行SDS-PAGE 电泳,随后将蛋白湿转法转膜,于5%脱脂奶粉封阻2 h,洗膜3 次,加入稀释的相应一抗(1 ∶1 000 稀释),放置在4 ℃摇床孵育过夜,洗膜3 次,再加入二抗(1 ∶2 000 稀释),室温孵育2 h,洗膜3 次,滴加ECL 化学发光试剂进行显影,定影后转移至暗室曝光,采集图像后使用Image J 软件分析条带灰度值。
1.8 统计学方法
用SPSS 21.0 软件进行数据分析,计量资料用均数±标准差(x±s)表示,多组间比较采用方差分析。以P< 0.05 为差异具有统计学意义。
2 结果
2.1 人参皂苷Rg1 对HK-2 细胞活性的影响
不同浓度的人参皂苷Rg1 处理HK-2 细胞,48 h时采用CCK-8 实验检测细胞增殖活性,结果显示,与空白对照组相比,不同浓度人参皂苷Rg1 处理组HK-2 细胞活性无明显改变,差异无统计学意义(P>0.05),见表2,提示人参皂苷Rg1 对HK-2 细胞的增殖活性无明显影响。
表2 不同浓度的人参皂苷Rg1 对HK-2 细胞活性的影响(±s,n = 3)Tab. 2 Effects of different concentrations of ginsenoside Rg1 on HK-2 cell viability(±s,n = 3)

表2 不同浓度的人参皂苷Rg1 对HK-2 细胞活性的影响(±s,n = 3)Tab. 2 Effects of different concentrations of ginsenoside Rg1 on HK-2 cell viability(±s,n = 3)
人参皂苷Rg1/ (μg/mL) 相对存活率 / %0 100.00 ± 5.23 10 99.86 ± 6.96 20 98.75 ± 6.87 40 99.93 ± 5.80 F 0.027 P 0.994
2.2 各组炎性因子含量比较
ELIASA 实验检测人参皂苷Rg1 对高糖诱导的HK-2 细胞炎性因子TNF-α 和IL-1β 含量的影响,与正常对照组相比,高糖组HK-2 细胞上清液中TNF-α 和IL-1β 的含量明显增加(P<0.05),与高糖组相比,低人参皂苷Rg1 组和高人参皂苷Rg1 组中TNF-α 和IL-1β 的含量有不同程度的减少(P<0.05),与低人参皂苷Rg1 组相比,高人参皂苷Rg1组中TNF-α和IL-1β的含量减少 (P<0.05),见表3。
表3 各组细胞上清液中炎性因子TNF-α 和IL-1β 含量的比较(±s,n = 3)Tab. 3 Comparison of the contents of inflammatory factors TNF-α and IL-1β in the cell supernatant of each group(±s,n = 3)

表3 各组细胞上清液中炎性因子TNF-α 和IL-1β 含量的比较(±s,n = 3)Tab. 3 Comparison of the contents of inflammatory factors TNF-α and IL-1β in the cell supernatant of each group(±s,n = 3)
注:与正常对照组相比,*P < 0.05;与高糖组相比,&P < 0.05;与低人参皂苷Rg1 组相比,#P < 0.05。
组别 TNF-α /(pg/mL) IL-6/(pg/mL)正常对照组 5.02 ± 0.47 6.47 ± 0.72高糖组 17.33 ± 1.21* 25.02 ± 2.33*低人参皂苷Rg1 组 11.21 ± 1.02& 18.05 ± 1.51&高人参皂苷Rg1 组 7.86 ± 0.89&# 11.68 ± 1.03&#F 95.601 83.165 P 0.000 0.000
2.3 各组HK-2 细胞中α-SMA、 Fn 和E-cadherin 表达水平比较
Western blot 检测人参皂苷Rg1 对高糖诱导的HK-2 细 胞 中α-SMA、 Fn 和E-cadherin 表 达 水 平的影响,与正常对照组相比,高糖组HK-2 细胞中α-SMA 和Fn 的 表 达 水 平 明 显 升 高(P<0.05),E-cadherin 的表达水平明显降低(P<0.05);与高糖组相比,低人参皂苷Rg1 组和高人参皂苷Rg1 组中α-SMA 和Fn 的表达水平明显降低(P<0.05),E-cadherin 的表达水平明显升高(P<0.05);与低人参皂苷Rg1 组相比,高人参皂苷Rg1 组中α-SMA和Fn 的表达水平降低(P<0.05),E-cadherin 的表达水平明显升高(P<0.05),见图1、表4。
表4 各组细胞中α-SMA、 Fn 和E-cadherin 的表达水平的比较(±s,n = 3)Tab. 4 Comparison of the expression levels of α-SMA, Fn and E-cadherin in each group of cells(±s,n = 3)
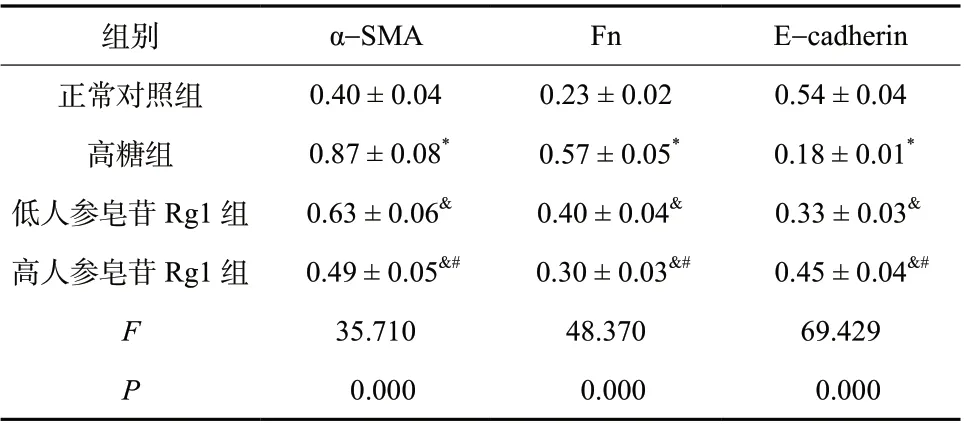
表4 各组细胞中α-SMA、 Fn 和E-cadherin 的表达水平的比较(±s,n = 3)Tab. 4 Comparison of the expression levels of α-SMA, Fn and E-cadherin in each group of cells(±s,n = 3)
注:与正常对照组相比,*P < 0.05;与高糖组相比,&P < 0.05;与低人参皂苷Rg1 组相比,#P < 0.05。
组别 α-SMA Fn E-cadherin正常对照组 0.40 ± 0.04 0.23 ± 0.02 0.54 ± 0.04高糖组 0.87 ± 0.08* 0.57 ± 0.05* 0.18 ± 0.01*低人参皂苷Rg1 组 0.63 ± 0.06& 0.40 ± 0.04& 0.33 ± 0.03&高人参皂苷Rg1 组 0.49 ± 0.05&# 0.30 ± 0.03&# 0.45 ± 0.04&#F 35.710 48.370 69.429 P 0.000 0.000 0.000

图1 Western blot 检测各组HK-2 细胞中α-SMA、 Fn 和E-cadherin 的表达水平Fig. 1 Western blot detection of the expression levels of α-SMA, Fn and E-cadherin in HK-2 cells in each group
2.4 各组HK-2 细胞中TGF-β1、Smad 2 和Smad3 mRNA 相对表达量比较
qPCR 技术检测人参皂苷Rg1 对高糖诱导的HK-2 细胞中TGF-β1、Smad 2 和Smad 3 mRNA 相对表达量的影响,与正常对照组相比,高糖组HK-2细胞中TGF-β1、Smad 2 和Smad 3 mRNA 相对表达量明显升高(P<0.05),与高糖组相比,低人参皂苷Rg1 组和高人参皂苷Rg1 组中TGF-β1、Smad 2和Smad 3 mRNA 相对表达量明显降低(P<0.05),与低人参皂苷Rg1 组相比,高人参皂苷Rg1 组中TGF-β1、Smad 2 和Smad 3 mRNA 相对表达量降低(P<0.05),见表5。
表5 各组细胞中TGF-β1、Smad 2 和Smad 3 mRNA 相对表达量的比较(±s,n = 3)Tab. 5 Comparison of the relative expression of TGF-β1, Smad 2 and Smad 3 mRNA in each group of cells(±s,n = 3)

表5 各组细胞中TGF-β1、Smad 2 和Smad 3 mRNA 相对表达量的比较(±s,n = 3)Tab. 5 Comparison of the relative expression of TGF-β1, Smad 2 and Smad 3 mRNA in each group of cells(±s,n = 3)
注:与正常对照组相比,*P < 0.05;与高糖组相比,&P < 0.05;与低人参皂苷Rg1 组相比,#P < 0.05。
组别 TGF-β1 Smad 2 Smad 3正常对照组 1.00 ± 0.10 1.00 ± 0.09 1.00 ± 0.10高糖组 1.84 ± 0.16* 1.71 ± 0.15* 2.42 ± 0.20*低人参皂苷Rg1 组 1.46 ± 0.12& 1.39 ± 0.11& 1.75 ± 0.14&高人参皂苷Rg1 组 1.21 ± 0.11&# 1.15 ± 0.10&# 1.39 ± 0.11&#F 25.203 21.865 53.493 P 0.000 0.000 0.000
2.5 各组HK-2 细胞中TGF-β1、Smad 2 和Smad 3蛋白表达水平比较
Western blot 检测人参皂苷Rg1 对高糖诱导的HK-2 细胞中TGF-β1、Smad 2 和Smad 3 蛋白表达的影响,与正常对照组相比,高糖组HK-2 细胞中TGF-β1、Smad 2 和Smad 3 蛋白相对表达水平明显升高(P<0.05),与高糖组相比,低人参皂苷Rg1组和高人参皂苷Rg1 组中TGF-β1、Smad 2 和Smad 3 蛋白相对表达水平明显降低(P<0.05),与低人参皂苷Rg1 组相比,高人参皂苷Rg1 组中TGF-β1、Smad 2和Smad 3蛋白相对表达水平降低(P<0.05),如图2 和表6 所示。

图2 Western blot 检测各组HK-2 细胞中TGF-β1、Smad 2 和Smad 3蛋白表达Fig.2 Western blot detection of TGF-β1, Smad 2 and Smad 3 protein expression in HK-2 cells in each group
表6 各组细胞中TGF-β1、Smad 2 和Smad 3 蛋白相对表达水平的比较(±s,n = 3)Tab. 6 Comparison of the relative expression levels of TGF-β1, Smad 2 and Smad 3 proteins in each group of cells (±s,n = 3)
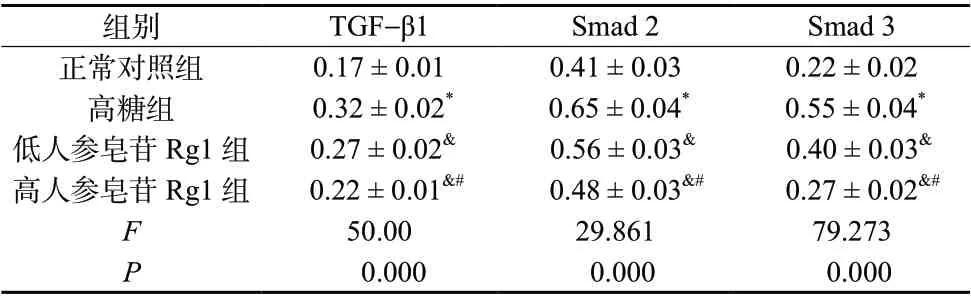
表6 各组细胞中TGF-β1、Smad 2 和Smad 3 蛋白相对表达水平的比较(±s,n = 3)Tab. 6 Comparison of the relative expression levels of TGF-β1, Smad 2 and Smad 3 proteins in each group of cells (±s,n = 3)
注:与正常对照组相比,*P < 0.05;与高糖组相比,&P < 0.05;与低人参皂苷Rg1 组相比,#P < 0.05。
组别 TGF-β1 Smad 2 Smad 3正常对照组 0.17 ± 0.01 0.41 ± 0.03 0.22 ± 0.02高糖组 0.32 ± 0.02* 0.65 ± 0.04* 0.55 ± 0.04*低人参皂苷Rg1 组 0.27 ± 0.02& 0.56 ± 0.03& 0.40 ± 0.03&高人参皂苷Rg1 组 0.22 ± 0.01&# 0.48 ± 0.03&# 0.27 ± 0.02&#F 50.00 29.861 79.273 P 0.000 0.000 0.000
3 讨论
肾纤维化的特征是间质纤维化、慢性炎症和肾小球硬化等众所周知,炎症是DN 发病的主要因素[7]。在糖尿病条件下巨噬细胞会渗入肾脏并形成炎症环境,进而影响几乎所有肾细胞,从而导致ECM 积累、纤维化、细胞功能障碍,最终导致蛋白尿[8]。此外,肾纤维化的发病机制包括细胞外基质蛋白的显著积累。在调节这种病理学进展的系统中,EMT 被认为在进行性肾纤维化和随后的肾功能恶化中起关键作用[9]。先前的研究表明,高血糖会诱导肾小管上皮细胞的细胞外基质蓄积,这是肾小管间质形成的重要步骤[10]。因此,研究抗炎和抗纤维化策略可以为DN的治疗提供新的方法。
人参皂苷Rg1 是中药人参的主要活性成分,据报道具有多种药理和生化作用。已有报道显示人参皂苷Rg1 对各种疾病的影响[11]。然而,人参皂苷Rg1 对肾纤维化的影响仍有待充分阐明。本研究观察了人参皂苷Rg1 对HG 诱 导的人肾小管上皮细胞炎症反应和纤维化的影响,并探究了其潜在机制。研究显示,HG 能够诱导肾小管上皮细胞产生促炎性细胞因子和趋化因子,最终导致间质免疫细胞渗透,肾小管损伤和纤维化[12]。本研究结果显示,高糖组HK-2 细胞分泌的TNF-α 和IL-1β 的含量明显高于正常对照组,本实验结果与以往研究相符,提示高糖可能通过炎症反应诱导肾小管发生纤维化。然而,人参皂苷Rg1 处理能够抑制高糖诱导的炎症因子的分泌,提示人参皂苷Rg1 能够抑制高糖诱导的肾小管上皮细胞的炎症反应来改善肾纤维化。高糖诱导的EMT 是一个重要过程,导致肾小球硬化和肾小管间质纤维化。EMT 是上皮细胞丧失上皮特性,并获得了间充质细胞的典型特性的过程。EMT 在发育过程中促进细胞运动和新型组织类型的产生,并且也促进了疾病的发病机理。先前的研究表明,肾小管上皮可以通过EMT 过程分化为成纤维细胞,这被认为是肾小管间质纤维化发病机制中的重要事件[13]。本研究Western blot 检测结果显示,高糖能够促进α-SMA 和FN 蛋白的上调以及E-cadherin 的下调,这与HK-2 细胞上皮表型向肌成纤维细胞表型的转变有关。而人参皂苷Rg1 能够部分恢复该过程。提示人参皂苷Rg1 通过阻碍EMT 抑制肾纤维化进程。在肾纤维化中,TGF-β1 被认为是EMT 和细胞外基质积累的主要调节剂,因此可能是肾纤维化的潜在关键驱动因素[14]。TGF-β1 信号主要通过TGF-β1 受体介导的Smad 和非Smad 信号转导。在TGF-β1 刺激后,调节性Smads(包括Smad 2 和Smad 3)被募集到TGF-β1 受体,并通过磷酸化激活转移至细胞核,在那里它们共同激活下游的纤维原蛋白表达[15]。本研究表明,人参皂苷Rg1 处理可通过直接下调TGF-β1、Smad 2 和Smad 3 来降低HG 诱导的EMT。
结果表明,人参皂苷Rg1 抑制HG 诱导的肾小管上皮细胞炎症反应和EMT 来阻碍肾纤维化进展,这可能是通过抑制TGF-β1/Smad信号通路来实现的。
4 结论
本研究表明人参皂苷Rg1 对HK-2 细胞无明显毒性作用,高糖诱导HK-2 细胞能够促进TNF-α、IL-1β、α-SMA、Fn、TGF-β1、Smad 2 和Smad 3 的表达,抑制E-cadherin 的表达,而人参皂苷Rg1 能够抑制高糖诱导的HK-2 炎症反应和EMT,并抑制TGF-β1/Smad 信号通路的激活。人参皂苷Rg1 通过抑制TGF-β1/Smad 信号通路缓解高糖诱导的HK-2细胞炎症反应和纤维化,这为人参皂苷Rg1 治疗糖尿病肾病提供新的方向。
