血清25羟基维生素D与2型糖尿病相关性分析
2021-11-18由慧敏曾春平刘海燕林名润
由慧敏,曾春平,刘海燕,龙 涛,周 琳,林名润
(广州医科大学附属第五医院内分泌科,广州市加速康复腹部外科重点实验室,广东 广州 510700)
近年来糖尿病的发病率呈现急剧上升的趋势,严重的危害着人类的健康,据统计全世界的糖尿病患者将于2035年增加至5.9亿[1-2]。近年来大量的研究表明,维生素D(vitamin D,VitD)的缺乏与糖尿病的发生与发展关系密切[3-5]。VitD是一种脂溶性维生素,在肝脏经25-羟化酶作用转化为25-(OH)D3,再在肾脏经1α-羟化酶作用进一步羟化成为1,25-(OH)2D3才具有活性,通过与细胞内的VitD受体(VDR)结合发挥生物学作用[6]。血清中检测出来的95%以上的25-羟基维生素D[25-hydroxy-vitamin D,25-(OH)D]为25-(OH)D3,是反映Vit D营养状态及活性的最适宜指标[7]。以往关于25-(OH)D水平同时在骨质疏松、2型糖尿病(Type 2 diabetes mellitus,T2DM)患者和正常人群进行对比分析的研究很少,本研究通过检测上述三组人群血清25-(OH)D水平并进行分析,进一步探讨血清25-(OH)D水平与T2DM相关性。
1 资料与方法
1.1一般资料:本研究经过本院医学伦理委员会同意,按照1999年世界卫生组织推荐的糖尿病诊断和分型标准进行T2DM的诊断。选取我院 2019年1月~2020年4月收治的122例T2DM非骨质疏松患者作为观察组,男61例,女61例,年龄33~78岁,平均(62±14)岁,中位年龄63岁。选取同期我院收治的66例骨质疏松非糖尿病患者为对照A组和体检中心的40例健康体检者为对照B组。对照A组中男32例,女34例,年龄30~93岁,平均(65±12)岁,中位年龄62岁;对照B组中男20例,女20例,年龄36~77岁,平均(65±10)岁,中位年龄60岁。三组一般资料比较,差异无统计学意义(P>0.05),具有可比性。
1.2排除标准:①排除1型糖尿病及患有自身免疫性疾病的患者;②以往服用过Vit D者;③排除肝肾功能不全的患者;④排除糖尿病酮症或酮症酸中毒者。
1.3研究方法
1.3.1标本采集:所有受试者均禁食8 h以上采集清晨空腹静脉血2 h内送本院实验中心,应用高效液相色谱串联质谱(LC-MS/MS)检测血清25-(OH)D水平;应用糖化血红蛋白检测仪HA-8180检测糖化血红蛋白(HbA1C);应用罗氏检测仪C702测定血清总胆固醇(TC)、三酰甘油(TG)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、空腹葡萄糖(FBG)、肌酐(Crea)、钙(Ca)、磷(P)水平。
1.3.2参考范围:25-(OH)D≥30 ng/ml定义为Vit D充足;20~30 ng/ml定义为维生素D不足;<20 ng/ml为维生素D缺乏;<10 ng/ml为维生素D严重缺乏[8]。

2 结果
2.1三组人群中血清25-(OH)D水平与性别的相关性:观察组和对照B组中男性与女性的血清25-(OH)D水平差异均无统计学意义(P>0.05),对照A组中男性与女性的血清25-(OH)D水平差异有统计学意义(P<0.05)。见表1。
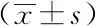
表1 三组人群中血清25-(OH)D水平与性别的相关性
2.2三组人群中各生化指标水平对比:三组人群中血清25-(OH)D、HbA1C、FBG、TG、Ca水平差异均有统计学意义(P<0.05);三组TC、HDL-C、LDL-C、P、Crea水平差异无统计学意义(P>0.05)。见表2。
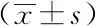
表2 三组人群中各生化指标水平比较
2.3三组人群中血清25-(OH)D水平对比:观察组与对照A组25-(OH)D水平均低于对照B组,差异有统计学意义(P<0.05),但观察组与对照A组25-(OH)D水平差异无统计学意义(P>0.05)。见表3。

表3 三组人群中血清25-(OH)D水平对比
2.4观察组患者血清25-(OH)D水平与生化指标的关系:T2DM非骨质疏松患者血清25-(OH)D水平与HbA1C、FBG呈负相关,差异有统计学意义(P<0.05);与TC、LDL-C、Ca呈正相关(P<0.05),其中与Ca正相关最为显著,差异有统计学意义(P<0.01);与TG、HDL-C、P、Crea无明显相关性,差异无统计学意义(P>0.05)。见表4。

表4 观察组患者血清25-(OH)D水平与生化指标的相关性分析
3 讨论
VitD除其主要通过调节钙、磷代谢参与机体的骨骼发育外,同时与代谢综合征、炎性反应及自身免疫性疾病等也关系密切。在中国老年人缺乏VitD很普遍,而低水平的25-(OH)D会增加代谢综合征和胰岛素抵抗发生的风险[9-10]。T2DM发病的两个关键因素是胰岛素抵抗和胰岛素分泌不足,这两大因素贯穿于整个T2DM发生与发展的进程中,而 VitD在T2DM发病的上述两个机制中都起到了一定的作用。①经过活化的VitD3与胰腺上的VitD受体以及钙结合蛋白结合,可促进钙离子内流增加,启动了胰岛素的信号转导,从而促进了胰岛素的分泌。②被活化的VitD3同时参与细胞免疫抑制,从而保护胰岛β细胞免受这些细胞因子介导的免疫损伤,减少β细胞的凋亡。③被活化的VitD3一方面通过抑制过氧化物酶体增殖物活化受体γ的表达来减少胰岛素抵抗,另一方面可直接激活过氧化物酶体增殖物活化受体δ,调控脂肪酸的代谢,达到改善胰岛素抵抗的作用。
本研究通过对骨质疏松非糖尿病患者、糖尿病非骨质疏松患者及健康人群三组样本间的25-(OH)D和其他生化指标进行比较,从而进一步验证25-(OH)D在预防T2DM中的作用,以在临床工作中更好的防治这种常见疾病。
本研究中观察组T2DM患者男性与女性的血清25-(OH)D水平差异无统计学意义(P>0.05),提示VitD在T2DM患者男性和女性中同等缺乏,不存在性别差异。
本研究中T2DM组除与健康人群对照,同时与骨质疏松人群进行对照。结果显示三组血清学指标比较,观察组的TG水平明显高于其他两组,而HDL-C水平明显低于其他两组,这两项血脂代谢异常与T2DM患者脂代谢紊乱密切相关;同时观察组与对照A组25-(OH)D水平均低于对照B组,差异有统计学意义(P<0.05),但观察组与对照A组25-(OH)D水平差异无统计学意义(P>0.05),提示T2DM患者25-(OH)D水平明显低于非糖尿病人群,其缺乏程度与同期比较的骨质疏松人群相当,这也证实了T2DM患者存在明显的VitD缺乏。现有研究[11-15]显示,Vit D能够促进胰岛β细胞分泌胰岛素、改善胰岛素抵抗,而T2DM患者体内普遍缺乏 VitD,血清25-(OH)D水平与T2DM患者空腹血糖、餐后血糖和糖化血红蛋白等指标关系密切,本研究的结果也同时证实了该结论,血清25-(OH)D水平下降可能会增加T2DM患者的发病率。
观察组中T2DM患者血清25-(OH)D水平与HbA1C、FBG呈负相关(P<0.05),提示T2DM患者血清25-(OH)D水平缺乏程度与HbA1C、FBG水平密切相关。本研究的T2DM人群HbA1C为(8.6±2.5)%,若T2DM患者血糖控制不佳,HbA1C大于本研究人群,其血清25-(OH)D水平的缺乏程度将继续加重,如果T2DM人群血糖控制理想血清25-(OH)D水平的缺乏程度也会随之减轻。Song等[12]在一项Meta分析研究中纳入21项前瞻性队列研究,使用线性回归趋势研究血清25-(OH)D与T2DM的关系,相关结果显示血清25-(OH)D每增加 10 nmol/L,T2DM的发病风险下降约4%,提示血清25-(OH)D水平与T2DM发病率呈反向趋势。Patricia Lemieux等[16]最新一项关于使用VitD补充剂6个月对胰岛素敏感性和分泌影响的随机、安慰剂对照实验研究,研究表明补充VitD能够延缓新诊断为T2DM患者的发展进程,补充VitD能够促进糖代谢减缓糖尿病的发展进程。另外研究中显示的T2DM患者血清25-(OH)D水平与TC、LDL-C呈正相关(P<0.05),这与活性VitD在调控脂肪细胞和骨骼肌中的脂肪酸代谢方面机制有关,这也提示T2DM患者纠正VitD缺乏后脂代谢异常亦会得到很好的改善。目前在最新的一些研究中已发现活性VitD3不仅有助于T2DM的预防和治疗,同时可通过上调VDR水平增强自噬活性实现对糖尿病肾病足细胞损伤的抑制作用,进而减少蛋白尿,延缓糖尿病肾病的发展[17-19]。
综上所述,在糖尿病发生的高风险人群适当补充VitD可能有助于预防和延缓T2DM的发生,同时在T2DM人群给予适当补充VitD除了可有效减少T2DM人群骨质疏松的发生率,还可能会减少或延缓糖尿病慢性并发症的发生。但是VitD对糖尿病的治疗作用与机制仍需进一步明确与完善,以便更好的指导T2DM的预防与治疗。
