1,4-二氮杂二环[2.2.2]辛烷-氰基合钴(Ⅲ)三维框架氢键型晶体的合成、相变及介电性质
2021-11-18徐慧婷秦刘磊齐欢欢刘尊奇
徐慧婷 刘 洋 秦刘磊 齐欢欢 刘尊奇
(新疆农业大学化学工程学院,乌鲁木齐 830052)
小分子金属氰基配合物又称为“类卤素”配合物[1⁃8],在晶体空间内相比于金属卤素化合物更易于变形,与相邻有机配体通过氢键相互作用可获得一维链状、二维层状、三维网状等[9⁃15]框架型MOFs(metal⁃oganic frameworks)材料[16⁃21]。尤其是导入球状氮杂环类有机体后,这类配合物在一定空间内有利于有机体的振动、摆动、转动等[22⁃31],易呈现多种物理性能耦合的现象,使其在热能转换、分子马达能量转换、药物传送、离子识别和分离等方面有着巨大的应用价值[32⁃38]。最近,Gong等合成了一种新氰基双钙钛矿型化合物(HTz)2[KCo(CN)6](HTz=噻吩阳离子),该化合物形成笼状结构,其HTz环作为客体位于笼状结构内部[39]。单晶结构分析表明,由于HTz环相对较小的位移与热振动,该化合物分别在237和210 K经历了2步可逆的结构相变,并伴随着可切换型介电转变。Fu等使用1,4⁃二氮杂二环[2.2.2]辛烷(Dabco)为构建单元成功设计、合成对映体铁电体[R/S⁃2⁃Me⁃H2Dabco][TFSA]2(TFSA=双(三氟甲基磺酰基)铵)[40],2种对映体显示出2个连续的相变,其转变温度(Tc)分别高达405.8和415.8 K,该化合物基于Dabco球型分子形成较好的铁电性能,该类晶体材料在分子开关、传感器和电容器等智能器件中具有广泛的应用前景。
本课题组之前报道了2例氰基金属(Co、Fe)氢键型笼状超分子晶体材料[41⁃42],氰基金属阴离子与超分子阳离子、水分子通过氢键的相互作用形成三维笼状结构。随着温度的变化,笼状结构发生明显变形,引发介电异常和结构相变。在此研究基础上,我们选用易于发生有序-无序转变的Dabco为有机配体、氰基合钴配合物为无机金属离子和小分子MOFs模块,设计、合成一种新型三维框架无机-有机杂化型晶体材料(H3O)(H2Dabco)[Co(CN)6]·H2O(1),并通过红外光谱、元素分析、单晶X射线结构、粉末X射线衍射(XRD)、热重分析(TGA)、差示扫描量热(DSC)、变温-变频介电常数等对其主要成分、单晶结构、热与电性能进行表征和研究。
1 实验部分
1.1 实验材料与仪器
钴氰酸参照文献[41]方法合成。Dabco购自梯希爱(上海)化成工业发展有限公司;钴氰化钾购自上海阿拉丁生化科技股份有限公司;浓盐酸(质量分数36.5%)和甲醇均购自天津市致远化学试剂有限公司。所用试剂均为分析纯,实验用水为超纯水。
所用仪器有Nicolet IS5型FT⁃IR光谱仪(美国Thermo Fisher Scientific公司)、Bruker SMART APEXⅡ型单晶X射线衍射测试仪(德国Bruker公司)、Bruker D2 PHASER型粉末X射线衍射测试仪(德国Bruker公司,辐射源CuKα,λ=0.154 056 nm,工作电压40 kV,电流150 mA,扫描范围10°~50°)、Q50型热重分析仪(TG,美国TA公司)、Q20型差式扫描量热仪(美国TA公司)、TH2828型介电性能测试仪(常州同惠公司)、Vario E1 Cube型元素分析仪(德国Ele⁃mentar公司)。
1.2 化合物的合成
将含有0.05 mL浓盐酸的钴氰酸(0.166 g,0.76 mmol)水溶液(10 mL)缓慢滴加入含有Dabco(0.213 g,0.20 mmol)的10 mL甲醇溶液内,通过磁力搅拌器将水和甲醇的混合溶液持续搅拌30 min,过滤后的透明滤液放置室温环境下,使用溶剂缓慢蒸发的方式于7 d后获得粉色透明化合物1。元素分析按照C12H19CoN8O2的计算值(%):C 39.35,H 5.23,N 30.59;实测值(%):C 39.19,H 5.16,N 30.40。红外光谱(KBr,cm-1):3 384(m),3 010(s),2 807(m),2 621(w),2 162(w),2 129(s),1 701(m),1 468(w),1 409(m),1 321(w),1 196(m),1 052(s),892(w),849(m),622(w),565(m)。
1.3 化合物晶体结构的测定
选择表面无杂质、尺寸合适的透明单晶(0.30 mm×0.28 mm×0.06 mm),置于 Bruker SMART APEXⅡ型单晶X射线衍射仪上,使用石墨单色化的MoKα射线(λ=0.071 073 nm)作为衍射光源,分别在低温(100 K,LT)与室温(296 K,RT)下收集化合物1的衍射数据。通过SHELXL⁃97程序,以直接法解析晶体结构,采用基于F2的全矩阵法进行精修,非氢原子均使用各向异性修正,水分子中的氢原子位置通过电子云密度的方式确认。表1为化合物1的晶体学数据。
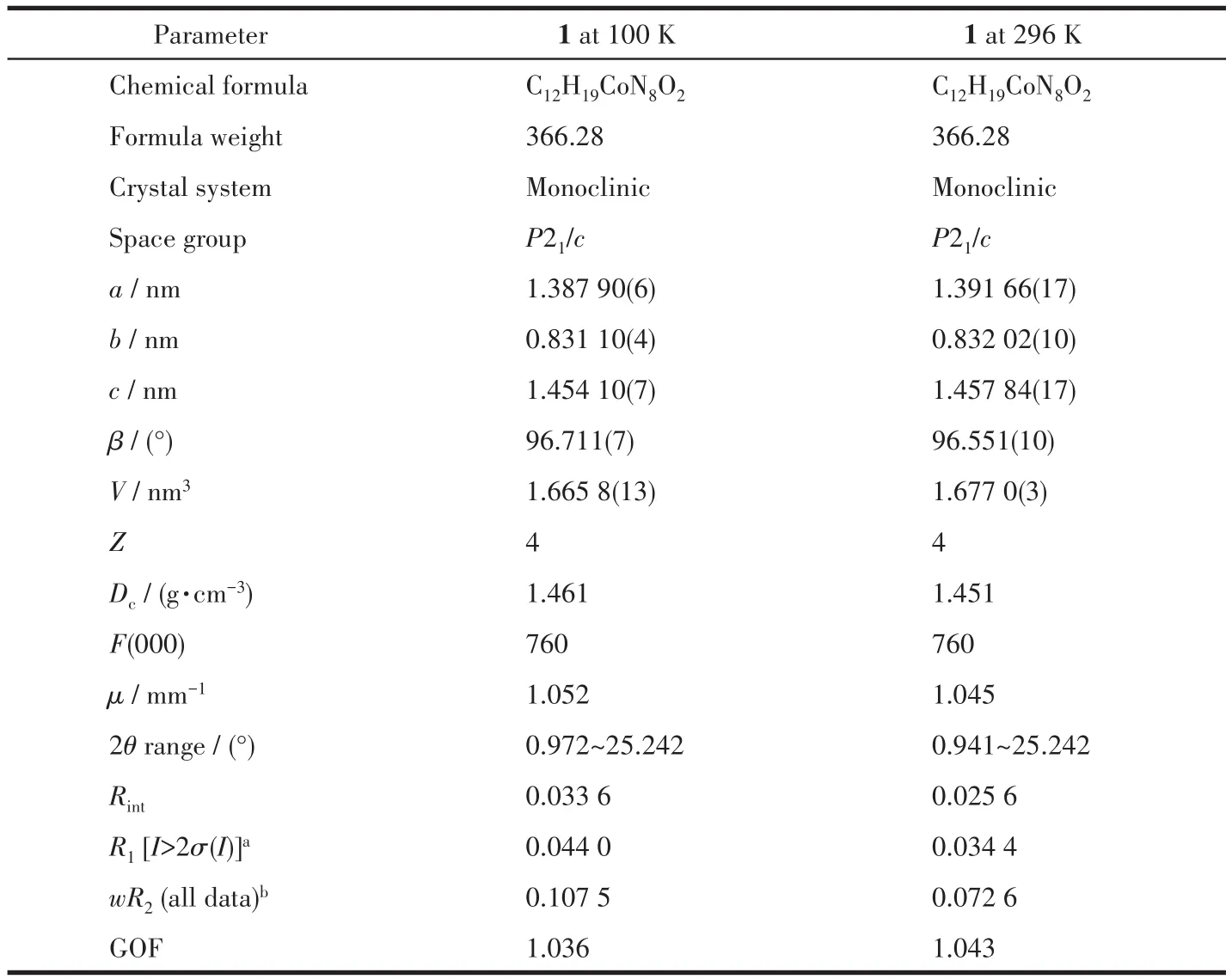
表1 化合物1的晶体学数据Table 1 Crystallographic data of compound 1

图1 化合物1的合成Fig.1 Synthesis of compound 1
CCDC:2053158,1(100 K),2053159,1(296 K)。
2 结果与讨论
2.1 化合物1的单晶结构描述
由单晶X射线衍射测试结果可知,低温与室温时,化合物1均属于单斜晶系,中心对称的P21/c空间群,低温时晶胞参数为a=1.387 9(6)nm、b=0.831 1(4)nm、c=1.454 1(7)nm、β=96.711(7)°、V=1 665.8(13)nm3。室温时,晶胞参数为a=1.391 66(17)nm、b=0.832 02(10)nm、c=1.457 84(17)nm、β=96.551 0(10)°、V=1 677.0(3)nm3(表 1)。由此可知,化合物1随温度的改变,空间群虽未发生变化,但晶胞参数a增加0.27%、b增加0.11%、c增加0.26%、β增加0.17%、体积V增加0.67%,说明化合物1从低温变到室温时存在同结构相变。图2a为化合物1在低温与室温下的最小不对称单元,从图中可以看出不对称单元均由2个半钴氰酸阴离子、1个双边质子化的(H2Dabco)2+阳离子、1分子水和1个水合质子组成,其成分之间以氢键相互作用形成一个整体。对成分之间的氢键分析结果(表2)显示水合质子与水分子之间通过O—H…O氢键作用力相连,其键长(O…O)为 0.255 05 nm(LT)、0.255 60 nm(RT),键角为156.795°(LT)、165.840°(RT)。水合质子和半钴氰酸阴离子之间由氢键O—H…N组成,其键长(O…N)为0.257 55 nm(LT)、0.257 12 nm(RT),键角为 167.769°(LT)、174.607°(RT),在室温下键角增大4.08%。水分子与半钴氰酸阴离子之间也通过氢键O—H…N连接,键长(O…N)为0.271 46 nm(LT)、0.271 83 nm(RT),键角为166.544°(LT)、164.672°(RT),在低温下键角减小1.12%。水分子与(H2Dabco)2+阳离子之间通过N—H…O氢键作用,键长(N…O)为0.276 43 nm(LT)、0.278 09 nm(RT),键 角 为 158.673°(LT)、160.666°(RT),随着温度升高键长增大1.26%。整体上1的氢键随着温度的改变键长、键角均增加,导致构筑模块在一定的温度范围内发生转变。图2b显示化合物1在低温时的对称操作结构,其多种成分通过上述氢键相互作用在ac平面上组成链状结构。

表2 化合物1的氢键参数Table 2 Hydrogen bond parameters of compound 1

续表2
如图3a所示,钴氰酸阴离子呈现八面体结构,其Co—C键长范围为0.188 67~0.190 58 nm(LT)、0.188 59~0.190 69 nm(RT),其相邻键角范围为87.85°~91.33°(LT)、87.97°~91.46°(RT),N—C键长范围为 0.114 90~0.115 50 nm(LT)、0.114 10~0.115 10 nm(RT),N—C—Co键 角 范 围 为 176.08°~179.18°(LT)、176.49°~179.45°(RT)。伴随温度变化,在b轴方向上,钴氰酸阴离子的键长和键角增大,钴氰酸阴离子的八面体结构扭曲程度更为严重。(H2Dabco)2+阳离子的C—N—C的键角范围为109.31°~110.58°(LT)、109.41°~110.54°(RT),与此相比 扭 转 角 N7—C7—C8—N8、N7—C9—C10—N8、N7—C11—C12—N8从低温到室温过程中角度分别减少 3.8°、1.7°、2.6°,其 N7与 N8之间的距离为0.249 43 nm(LT)、0.248 08 nm(RT),从低温到室温过程中减少0.54%。这些结果显示(H2Dabco)2+阳离子随温度的改变发生明显的弹簧式扭动,易引起化合物1整体结构改变,导致晶体电性能转化。
低温与室温情况下,在ab平面内,钴氰酸阴离子均以2个水合质子为连接点通过O—H…N氢键构成无限的一维菱形氢键链状结构(图4a)。其氢键键长(O…N)为 0.255 92~0.257 55 nm(LT)、0.256 17~0.257 12 nm(RT),键 角 为 167.769°~169.731°(LT)、172.299°~174.607°(RT),随温度升高增加 2.70%~2.87%(表2)。氢键的改变导致钴氰酸阴离子的中心金属钴离子之间距离增加,引起链状结构在平面内有一定的伸长(图4a)。另外,通过水合质子与水分子之间由O—H…O氢键和水分子与钴氰酸阴离子之间的O—H…N氢键将一维菱形氢键形链状联结在一起,构成二维氢键层状结构(图4b)。其水分子与钴氰酸阴离子之间的O—H…N氢键键长(O…N)0.274 71 nm(LT)、0.274 89 nm(RT),键 角 169.526°(LT)、164.159°(RT),键角发生明显变化,减小 3.17%(表2)。结果显示二维氢键层状结构随着温度改变而发生内部伸缩振动。
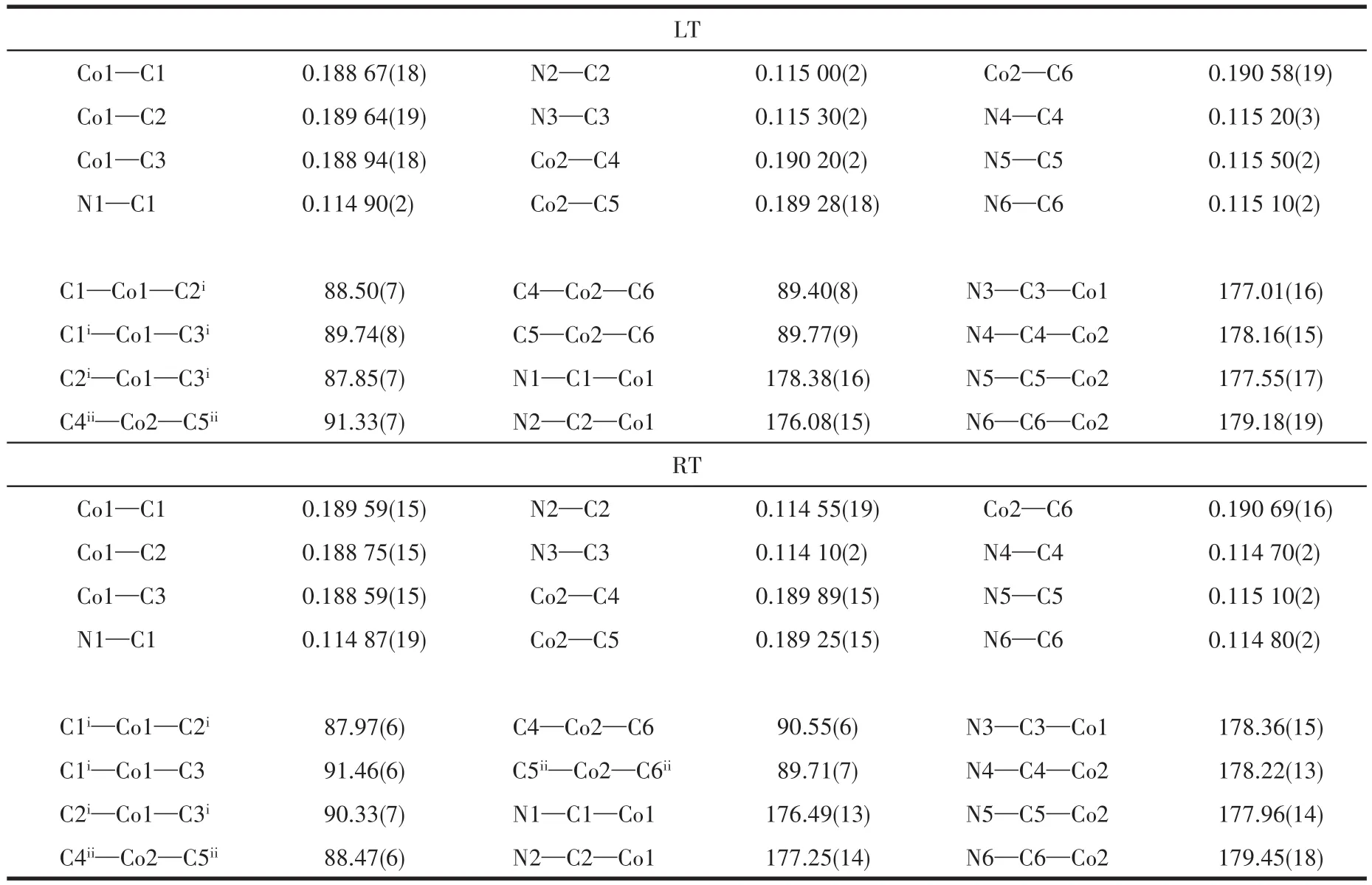
表3 化合物1的主要键长和键角Table 3 Selected bond lengths(nm)and bond angles(°)of compound 1

图4 化合物1的一维菱形氢键链状(a)和100 K时的二维氢键层状结构(b)Fig.4 One⁃dimensional hydrogen⁃bonding chain of compound 1(a)and 2D hydrogen⁃bonding layered structure at 100 K(b)
在b轴方向上,二维层状结构之间通过O—H…N氢键相互作用形成三维框架结构(图5a)。其氢键键长(O…N)为 0.271 46 nm(LT)、0.271 83 nm(RT),键角为166.544°(LT)、164.672°(RT),随温度升高键角减少1.12%(表2)。在三维框架内,以钴离子为顶点可形成六面体结构(图5b),其长、宽、高随着温度升高增长0.11%、0.14%、0.37%,其夹角也发生一定的改变。三维框架结构的伸缩与结构变形易于导致晶体性质发生改变,产生相变、介电异常等物理性能。
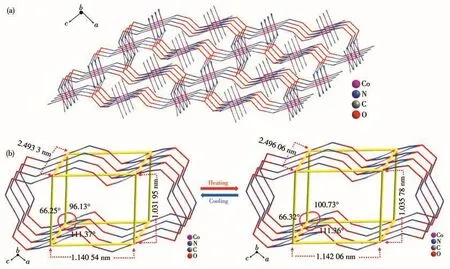
图5 化合物1的三维框架结构(a)和100、296 K时的结构(b)Fig.5 Three⁃dimensional framework structure(a)and the structures at 100,296 K(b)of compound 1
(H2Dabco)2+阳离子以N—H…O与N—H…N氢键相互作用镶嵌于三维框架空腔内,沿着b轴形成圆筒状囊型结构(图6),其相互连接的氢键的键长和键角随着温度上升都发生明显的改变。三维框架结构为(H2Dabco)2+阳离子转动提供了有利的空间,与上文分析(H2Dabco)2+阳离子N—C—C—N的扭转角改变和2个N原子之间距离缩短所呈现的离子转动结果相一致。

图6 三维框架与Dabco阳离子形成的化合物1的囊状结构Fig.6 Sack⁃like structure of compound 1 formed by 3D framework and Dabco cation
2.2 化合物1的红外光谱
以KBr压片的方式通过红外光谱仪对化合物1在4 000~400 cm-1范围内进行FT⁃IR测试,结果如图7所示。通过IR谱图的特征峰分析显示:3 384 cm-1为水分子的O—H伸缩振动峰,3 010、2 807、2 621 cm-1处弥漫的较强吸收谱带为—NH+伸缩振动峰,2 129 cm-1处显示的非常强的谱带为—C≡N伸缩振动峰,1 196 cm-1处为—C—N伸缩振动峰。光谱图结果确认化合物1中存在钴氰酸、Dabco和溶剂水分子等。
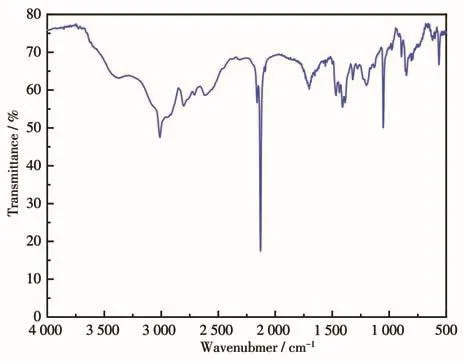
图7 化合物1的IR谱图Fig.7 IR spectrum of compound 1
2.3 化合物1的XRD与TG分析
在室温条件下,使用粉末X射线衍射仪在2θ角度10°~50°范围内,对化合物1粉末样品进行测试,图8a为化合物1在室温(296 K)下的XRD图,图8b为该化合物由室温单晶结构模拟得到的XRD图,通过对比两图显示实验数据与模拟数据峰位吻合度较好,强度略微不同,表明化合物1为单一纯相晶体材料,且粉末单晶X射线测试数据与晶体结构一致。

图8 化合物1的XRD图(a)和模拟XRD图(b)Fig.8 XRD pattern(a)and simulated XRD pattern(b)of compound 1
氮气保护下,在温度为300~850 K范围内,以10 K·min-1的升温速度对化合物1进行TG测试,结果如图9所示。TG曲线显示化合物1的质量损失可分为3个阶段,350~476 K范围内为第一阶段,分解质量比例为10.19%,与1分子水和1个水合质子理论失重值相符。476~567 K范围内为第二阶段,分解质量比例为30.90%,与化合物1中(H2Dabco)2+阳离子理论失重值大致相同。567~827 K范围内为第三阶段,分解质量比例为37.49%,当温度高于827 K时,化合物1不再分解,剩余质量比例为21.42%,第三阶段与剩余阶段的质量之和与钴氰酸的理论失重值相近,推测第三阶段为钴氰酸阴离子分解,并且钴氰酸未完全分解。由此表明化合物1的热分解情况与晶体结构解析结果相符合。
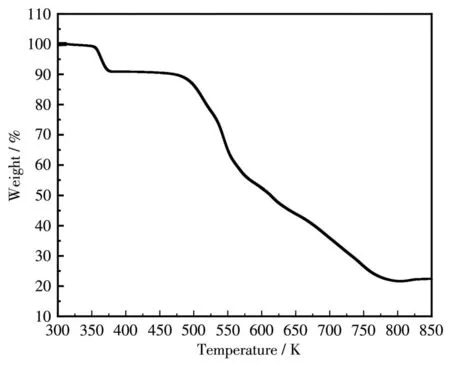
图9 化合物1的TG曲线Fig.9 TG curve for compound 1
2.4 DSC分析
具有微观形变的晶体材料由于在同一相中存在多种稳定状态,受到外界条件刺激(如温度、压力、光、电等)的情况下,易引起微观结构有序程度的改变,导致表观物理性能的突变。上述化合物1的结构分析显示其单晶结构中存在Dabco分子扭动与三维框架伸缩变形。DSC测试作为检测晶体材料在温度变化下是否发生相变和微观状态变换的有效表征手段之一,已被广泛应用在晶体热能性质的分析中。因此,在氮气氛围的保护下,在190~290 K温度范围内,采取10 K·min-1的变温速率对化合物1进行DSC测试,结果如图10所示。化合物1在降温过程中曲线没有变化,但升温过程中在254 K附近出现一个明显的吸热峰,吸热范围在245~265 K之间,由于晶体有序程度没有改变,且未发生化学键的断裂以及重组,只出现键角的微小变化,表明化合物1发生位移型单程相变。
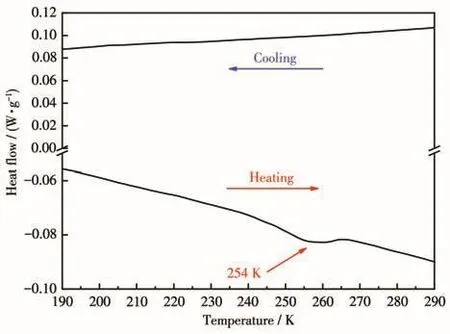
图10 化合物1的DSC曲线Fig.10 DSC curve of compound 1
2.5 介电性质测定
研究显示晶体内出现分子扭动或框架结构位移等现象会产生相变,易于导致晶体介电性能异常。选择尺寸适宜的晶体,通过单晶X射线衍射仪确定晶体的a、b、c三个轴向,由于电介质晶体材料往往拥有较高的电阻率,因而分别将3个轴向的晶体通过导电银胶和铜丝制成电容器,在温度230~260 K、频率500 Hz~100 kHz范围内分别进行变温-变频介电测试。图11a~11c分别为化合物1在a、b、c三个轴向的升温介电常数曲线图。在230~245 K之间,化合物1三个轴向的不同频率下的介电常数没有发生显著改变,当温度超过245 K时,3个轴向的介电常数均开始升高。a轴方向于250 K发生明显的台阶型介电异常现象;b轴方向于252 K突跃产生介电异常峰,255 K时曲线再次骤然增高,出现2处较弱的介电异常峰;在c轴方向可以观察到曲线于247 K迅速上升并在250 K左右呈现2次较弱的台阶型介电异常峰,3个轴向的介电常数产生明显的各向异性。通过介电测试与DSC测试结果可知,升温过程中,产生介电异常和相变的温度相吻合,再次证明化合物1在升温过程中发生相变。根据单晶结构分析推测,(H2Dabco)2+阳离子在晶体内部结构发生的弹簧式扭动、晶体框架的伸缩变形导致介电各向异性及结构相变产生(图11d)。
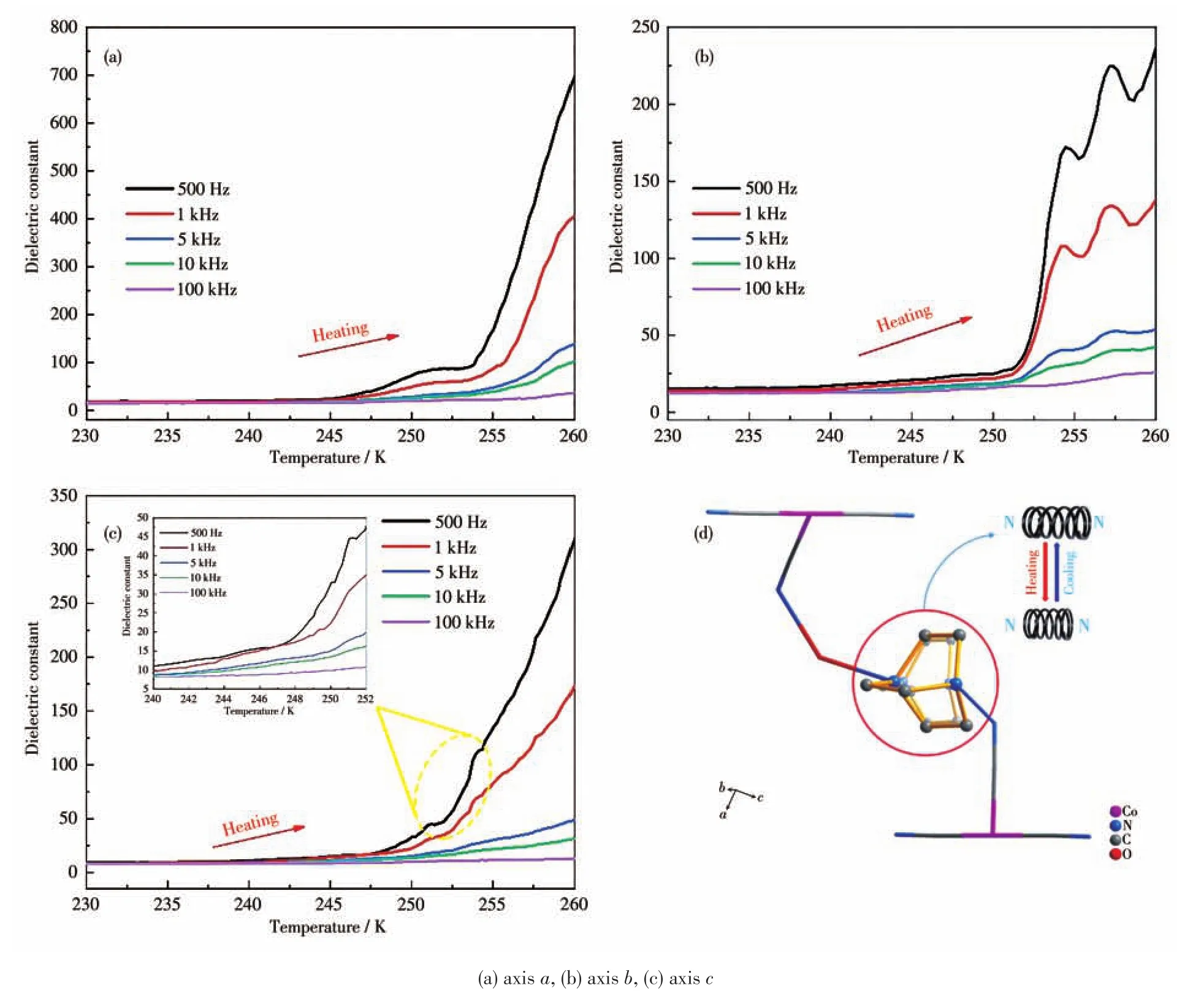
图11 (a~c)化合物1的不同晶轴方向的介电常数随温度的变化;(d)化合物1的介电各向异性及结构相变机理图Fig.11 (a⁃c)Dielectric constant of compound 1 in different crystal axis directions varying with temperature;(d)Dielectric anisotropy and structural phase transition mechanism diagram of compound 1
3 结 论
以Dabco、钴氰酸为原料,在水和甲醇混合溶液内于室温下通过自然蒸发法获得新型晶体材料(H3O)(H2Dabco)[Co(CN)6]·H2O(1),并对其结构和性能进行了测试及分析。化合物1中钴氰酸阴离子、水分子与水合质子之间由O—H…N、O—H…O、N—H…O氢键相互作用形成以钴离子为顶点的三维框架,(H2Dabco)2+阳离子通过N—H…N与O—H…N氢键镶嵌在框架中,形成囊状结构。当温度从低温升至室温时,钴氰酸阴离子形成的八面体发生扭曲,(H2Dabco)2+阳离子在三维框架中发生弹簧式扭动与转动,这2种变化使框架结构出现明显的伸缩变形,导致化合物1在254 K时产生相变。介电测试显示在a、b、c轴于250 K附近发生介电异常,呈现显著的各向异性。结果表明化合物1是一种新颖的介电各向异性相变型材料,可为电子材料的开发提供具有价值的设计参考。
猜你喜欢
杂志排行
无机化学学报的其它文章
- Mn-Based Coordination Polymer:Facile Synthesis,Structure and Application in Glucose Electrochemical Sensing
- Preparation of Dehydrated Ni-Fe Hydrotalcite-like Compounds as an Eco-Friendly Catalyst for Highly Selective Acetalization of Biomass-Derived Furfural
- Synthesis,Structure Regulation and Characterization of Cadmium(Ⅱ)Complexes Based on Imidazole Carboxylic Acid Ligands
- Difunctional Effects of Organo-Modified T-Type Zeolite Membranes for Dewatering from Organic Solution
- Controlling Distribution of Gold Nanoparticles in Au@ZIF-8 Core-Shell Structures for Sensing Fluorescent Molecules with Photoluminescence
- Structures and Luminescence Property of Two Co(Ⅱ) and Cd(Ⅱ)Supramolecular Coordination Networks Created via Synergistic Effect of Coordination Bonds and Secondary Interactions
