湿地松体细胞胚胎发生胚性愈伤组织诱导条件优化
2021-11-18程子珊宋才玲程强强邓诏磊张莹莹
程子珊,易 敏,宋才玲,程强强,黄 若,邓诏磊,张莹莹,张 露
(江西农业大学 林学院/江西省森林培育重点实验室/江西特色林木资源培育与利用2011协同中心,江西 南昌 330045)
【研究意义】湿地松(Pinus elliottiiEngelm)为常绿乔木,适应性强,生长迅速,松脂量高质优,原产美国东南部,现已成为我国南方主要造林树种之一[1-3]。目前我国湿地松良种繁育仍以有性繁殖为主,后代变异大限制良种应用[4-5]。植物体细胞胚胎发生技术具有繁殖系数高,稳定性强,周期短等优点,是无性繁殖技术研究中的热点,已被证明是优良林木大规模繁殖的有利手段[6-8]。建立高效稳定的湿地松体细胞胚胎发生繁殖技术对我国湿地松良种繁育具有重要意义。体细胞胚胎发生技术包括:诱导、增殖、成熟、萌发4 个阶段,其中胚性愈伤组织的诱导阶段获得大量的高质量的胚性愈伤组织是实现湿地松体细胞胚胎发生及植株再生的重要前提条件。【前人研究进展】目前国内外学者初步诱导得到了湿地松的胚性愈伤组织并获得再生植株,但建立高效稳定的湿地松体胚发生技术体系还需要大量的探究。1989 年Jain 等[9]首次诱导出湿地松的胚性愈伤组织并获得早期体胚;吴丽君[4]研究培养基、球果采集及冷藏时间对湿地松胚性愈伤组织诱导率的影响,得到最高诱导率为24%。【本研究切入点】胚性愈伤组织诱导阶段是分化了的体细胞重新恢复全能性的关键阶段,它受多种因素影响,并决定后期体胚发生能否成功,是体胚发生研究中非常重要的环节[10-11]。现有研究表明,湿地松胚性愈伤组织诱导率低且胚性不强,极大地限制了湿地松规模化、产业化快速繁殖能力[7]。【拟解决的关键问题】本研究在课题组前期工作基础上,探究合子胚发育时期、基因型、内源激素、不同生长调节剂、碳源等因子对湿地松胚性愈伤组织诱导的影响,筛选未成熟合子胚诱导胚性愈伤组织的最佳发育时期,优化湿地松胚性愈伤组织诱导技术,为湿地松体细胞胚胎发生及植株再生体系建立提供技术支撑,对推动湿地松苗木产业化具有指导意义。
1 材料与方法
1.1 试验材料
从江西省峡江林木良种场采集湿地松未成熟球果,冷藏运至江西农业大学森林培育重点实验室4 ℃冰箱保存备用。球果采取定点定株分批采集的方法。用无水乙醇消毒球果15 min,无菌水冲洗干净后取出种子;在超净工作台上用体积分数为75%酒精消毒种子5 min,无菌水冲洗后,取出未成熟合子胚作为外植体待用。
1.2 试验方法
1.2.1 植物生长调节剂对湿地松胚性愈伤组织诱导的影响 以7月11日采集的16号基因型未成熟合子胚为实验材料,设置3 种生长调节剂、3 种浓度,采用L9(34)正交设计(表1),得到9 个处理,每处理重复6 次,每皿接种10个未成熟合子胚,以探讨最佳生长调节剂配方。

表1 愈伤组织诱导L9(34)正交试验设计Tab.1 Orthogonal experimental design of callus induction L9(34)
1.2.2 采集日期和基因型对湿地松胚性愈伤组织诱导的影响 2018年6月27日、7月4日、7月11日、7月18 日、7 月25 日和8 月1 日共6 次时间采集16 号基因型球果获得未成熟合子胚,每皿接种10 个未成熟合子胚,重复3 次,探讨采集时间对诱导的影响;以7 月11 日采集的2 号、14 号、16 号、F-A、F-B 和F-C 6 个基因型的未成熟合子胚为材料,每皿接种10 个未成熟合子胚,重复3 次,探讨基因型对诱导的影响。上述培养均在最佳生长调节剂配方培养基上进行。
1.2.3 碳源对湿地松胚性愈伤组织诱导的影响 以7月11日采集的16号基因型的未成熟合子胚为实验材料,设置蔗糖、麦芽糖和松三糖等3 种碳源及4 种浓度,即蔗糖浓度(15,30,60,90 g/L),麦芽糖浓度(15,30,60,90 g/L),松三糖浓度(0.5,1.0,1.5,2.0 g/L)。每皿接种8个未成熟合子胚,重复4次。
上述实验均以本课题组前期筛选出DCR为基本培养基,以不同浓度的2,4-D、6-BA、KT为生长调节剂,添加30 g/L 蔗糖(除碳源实验外)、3 g/L 结冷胶、1 g/L 酸水解酪蛋白、100 mg/L 肌醇,pH 调至5.8,经121 ℃灭菌25 min后,稍冷却加入500 mg/L谷氨酰胺。暗培养,培养温度为(23±1)oC。每周观察记录,培养7周后统计胚性愈伤组织诱导率和愈伤组织诱导率。

1.2.4 湿地松合子胚发育阶段划分及内源激素变化 以2018 年6 月27 日、7 月4 日、7 月11 日、7 月18日、7 月25 日、8 月1 日共6 次时间采集16 号基因型球果的合子胚为材料,在20 倍体视镜(C-LEDS)下观察其发育阶段并拍照,以Pullman 等[12]的火炬松合子胚发育阶段划分标准为参照划分湿地松合子胚的发育阶段。
2019年7月4日、7月11日、7月18日、7月25日共4次时间分别采集1.5代湿地松种子园的F-1和F-2两个基因型球果获得未成熟合子胚材料,3次重复。采用酶联免疫吸附法(ELISA)[13]测定不同发育阶段合子胚的生长素(IAA)、细胞分裂素(ZR)、脱落酸(ABA)和赤霉素(GA3)含量,探讨合子胚发育过程中内源激素变化。
1.2.5 数据处理与分析 数据采用Excel 2007处理,用SPSS 25.0统计软件进行分析,用Origin软件制图。
2 结果与分析
2.1 植物生长调节剂对湿地松胚性愈伤组织诱导的影响
对正交试验的9 种处理进行方差分析表明(表2):不同浓度生长调节剂及浓度组合对湿地松愈伤组织诱导产生具有重要影响。KT 浓度对胚性愈伤组织诱导率具有显著影响,当KT 浓度为2.2 mg/L时,平均诱导率最高,为22.22%;添加不同浓度的2,4-D 和6-BA 胚性愈伤组织诱导率没有显著差异。处理2 未能诱导出胚性愈伤组织,处理4 和处理8 的诱导率较高为20%,处理5 得到的胚性愈伤组织诱导率最高为30%。
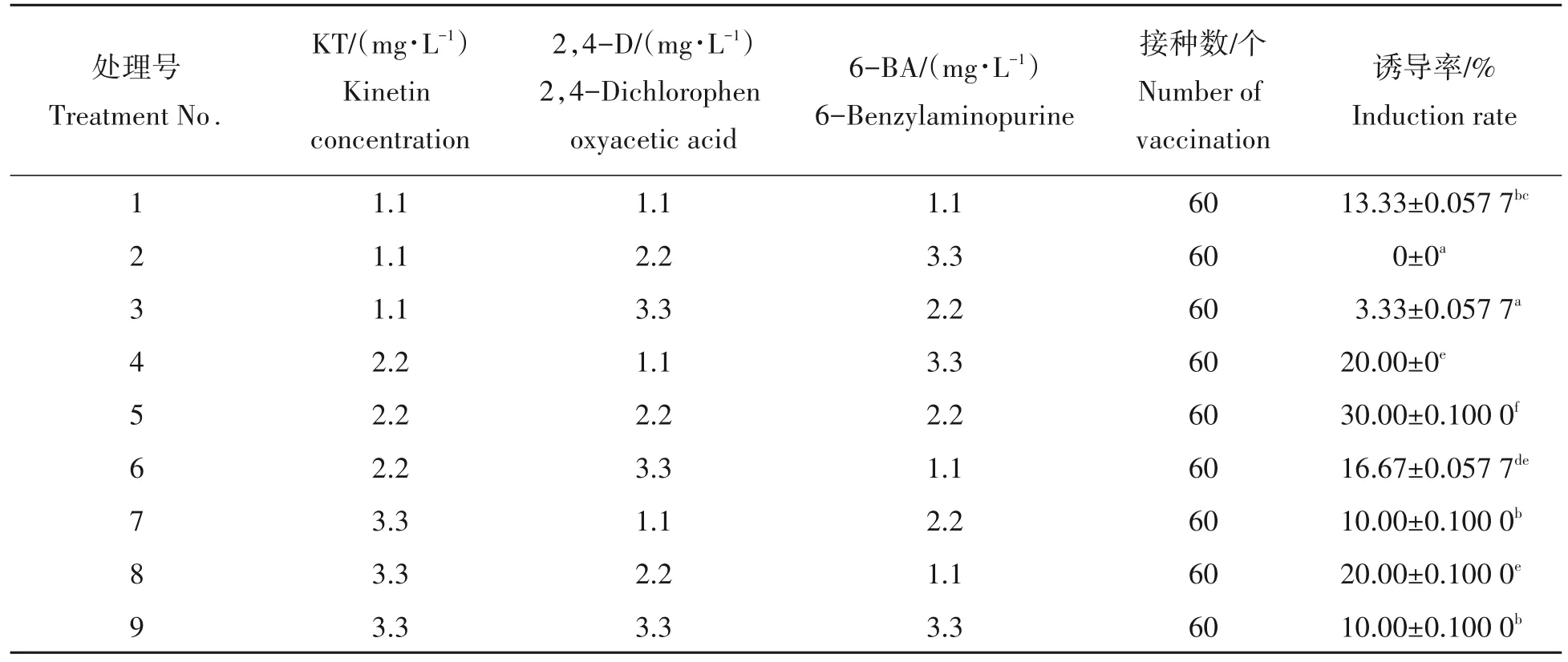
表2 L9(34)正交试验表和胚性愈伤组织诱导率Tab.2 Induction rate of embryogenic callus and orthogonal experimen of L9(34)
对胚性愈伤组织诱导率进行极差分析(表3),结果表明在不考虑交互作用的情况下,3 种激素对胚性愈伤组织诱导率的影响程度依次是KT 浓度>2,4-D 浓度=6-BA 浓度,理想的激素组合为:2.2 mg/L KT+2.2 mg/L 2,4-D+1.1 mg/L 6-BA。

表3 L9(34)正交试验结果极差分析Tab.3 Range analysis of orthogonal test results of L9(34)
2.2 采集日期和基因型对湿地松胚性愈伤组织诱导的影响
由表4可知,6次采集球果获得的未成熟合子胚接种至相同诱导培养基上,暗培养7周后得到的胚性愈伤组织诱导率不同。方差分析表明,不同日期采集的球果的胚性愈伤组织诱导率存在显著差异。随着未成熟合子胚逐渐发育成熟,胚性愈伤组织诱导能力呈现先上升后下降的趋势,7 月4 日和7 月11 日胚性愈伤组织诱导率最高,达到30.00%和33.33%,之后随着合子胚逐渐发育成熟,胚性愈伤组织诱导率逐渐降低,直至合子胚完全发育成熟,胚性愈伤组织诱导率为0%。实验还发现,愈伤组织与胚性愈伤组织诱导能力同步,7月4日和7月11日愈伤组织诱导率也最高。

表4 采集日期和基因型对胚性愈伤组织诱导的影响Tab.4 Effects of different collection dates and the genotype on the induction of embryogenic callus
6 个基因型的胚性愈伤组织诱导率存在显著差异(表3),胚性愈伤组织诱导率最低为0%、最高达30%。16号基因型胚性愈伤组织诱导率最高,且连续两年试验均表现较高胚性愈伤组织诱导率,其次是F-A、F-B基因型(图1)。

图1 胚性愈伤组织的诱导Fig.1 Induction of embryogenic callus
2.3 碳源对湿地松胚性愈伤组织诱导的影响
不同碳源和碳源不同浓度胚性诱导率达显著或极显著差异。如图2所示,随着蔗糖和麦芽糖浓度的增加,湿地松胚性愈伤组织诱导率呈先上升后下降的趋势。蔗糖浓度为30 g/L 时,诱导率达到最高,为20%;当麦芽糖浓度为30 g/L 时,诱导率达到最高,为30%;以松三糖作为碳源时,各处理间呈极显著差异,当浓度为1.5 g/L 时,诱导率最高,为40%。添加松三糖的平均诱导率为20%,麦芽糖为18.75%;蔗糖最低,为8.75%。松三糖和麦芽糖作为碳源更有利于提高湿地松胚性愈伤组织诱导率。

图2 不同碳源对胚性愈伤组织诱导率的影响Fig.2 The induction rate of embryogenic callus in Pinus elliottii with different carbon sources
2.4 湿地松合子胚发育阶段划分及内源激素变化
如图3所示,对2018年6次时间采集的16号基因型的球果合子胚进行显微观察,湿地松合子胚发育时期可划分为8 个阶段,即第1 阶段为合子胚发育早期阶段;第2 阶段为多胚头阶段;第3 阶段为裂生多胚阶段;第4阶段为球形胚阶段;第5阶段为棒状胚阶段;第6阶段为子弹头阶段;第7、8阶段合子胚逐渐发育成熟阶段。
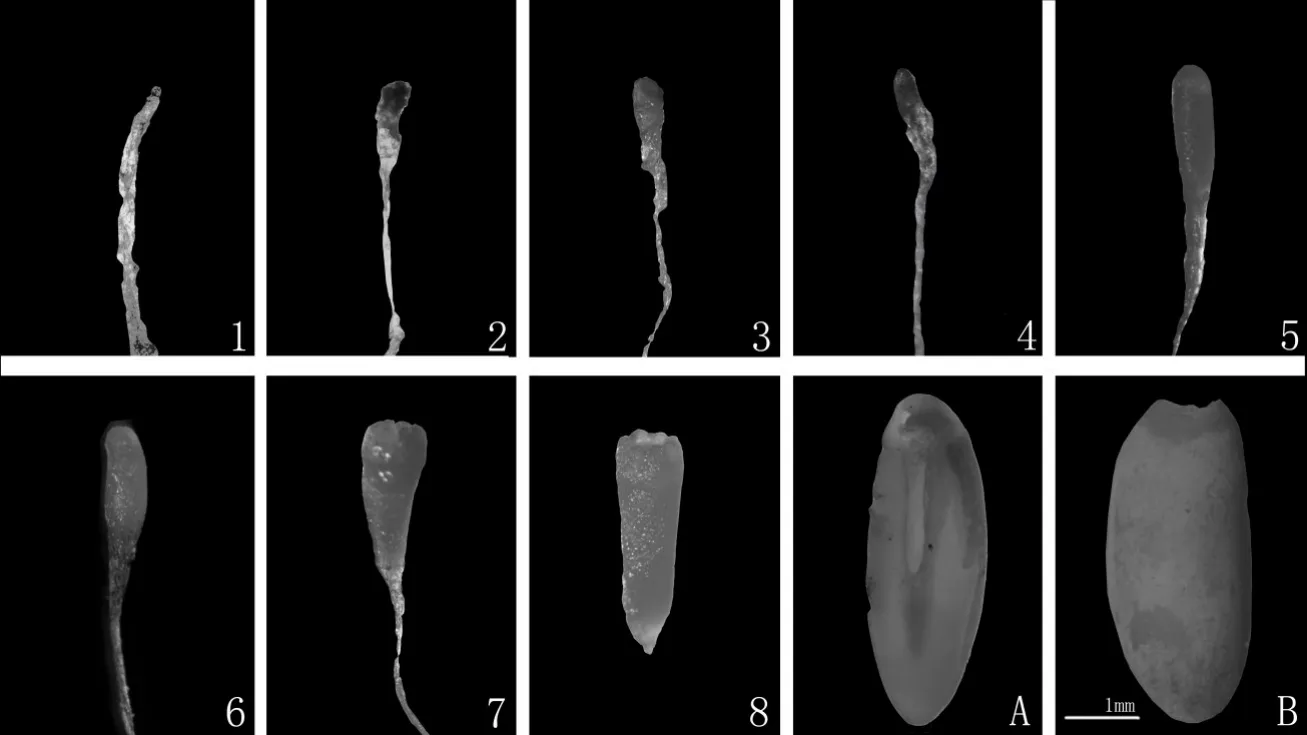
图3 合子胚的发育阶段Fig.3 Developmental stages of zygotic embryos
由表5 可知,对2019 年4 个时间段采集F-1 和F-2 两个基因型球果的的未成熟合子胚进行显微观察,发现F-1合子胚发育阶段集中在1~4阶段的早中期发育时期,胚性愈伤组织诱导率较高;F-2合子胚发育阶段集中在4~8阶段的中后期发育时期,胚性愈伤组织诱导率较低。

表5 不同基因型湿地松的合子胚发育阶段Tab.5 The zygotic embryo development stages of different genotypes of Pinus elliottii
根据酶联免疫吸附法测定结果如图4 所示,绘制F-1 和F-2 基因型的4 个时期8 个发育阶段合子胚的4种内源激素变化趋势图。IAA含量随着合子胚发育成熟呈上升趋势,ABA含量在合子胚发育早期呈上升趋势至第3阶段达最高峰147.97 ng/gFW,随后逐步下降;ZR和GA3的含量较低(4 ng/gFW 左右),随着合子胚的发育成熟没有明显的变化趋势,整体呈平稳波动状态。
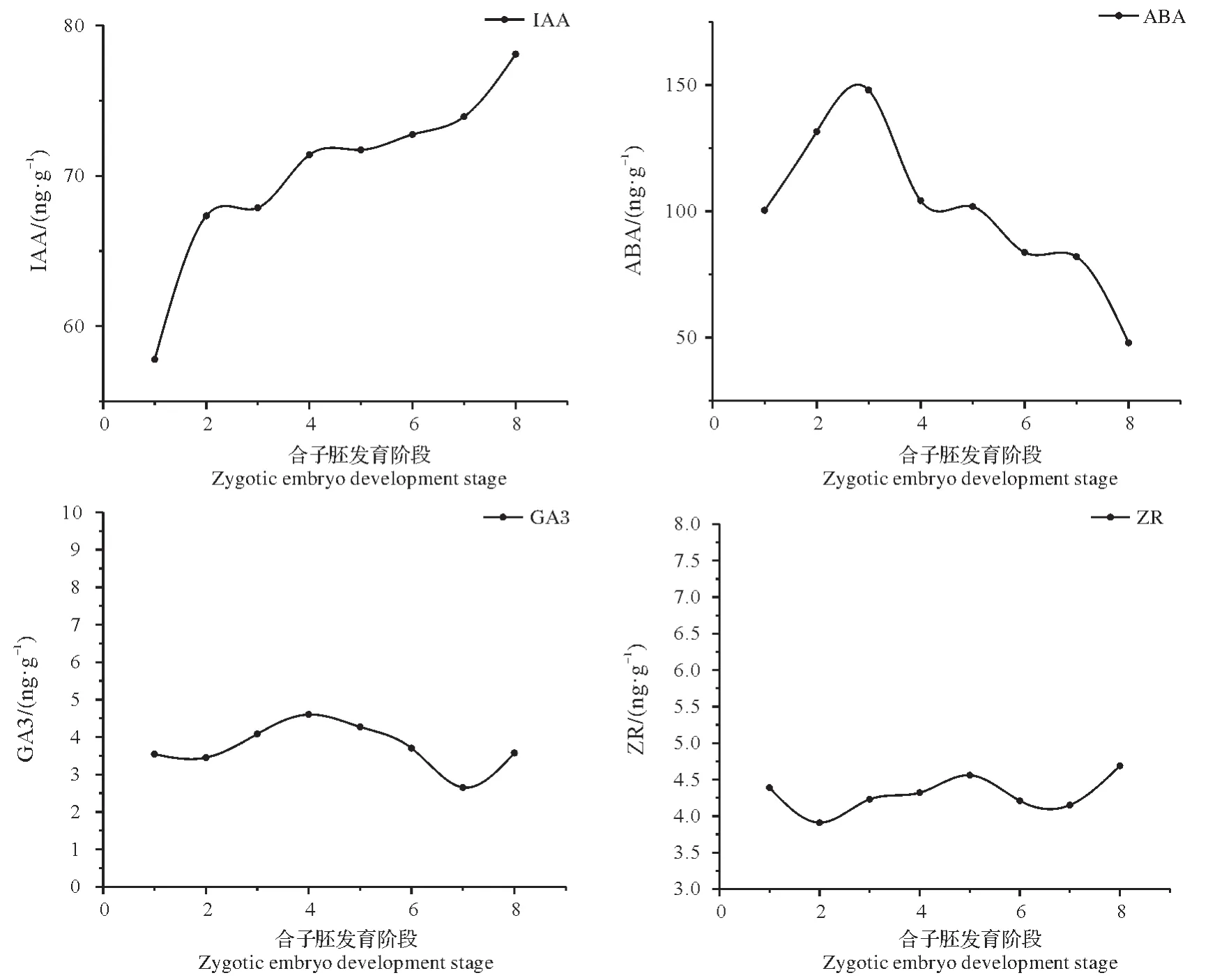
图4 湿地松合子胚发育过程中内源激素变化Fig.4 Variation trend of endogenous hormones during zygotic embryo development of Pinus elliottii
3 结论与讨论
3.1 生长调节剂对湿地松胚性愈伤组织诱导的影响
植物生长调节剂的种类及浓度配比是针叶树体细胞胚胎发生过程中的重要影响因素,在松属树种中,愈伤组织诱导最常用的外源激素为低浓度的2,4-D和6-BA[14]。本研究得到:DCR基本培养基中添加2.2 mg/L KT+2.2 mg/L 2,4-D+2.2 mg/L 6-BA是湿地松胚性愈伤组织诱导的最佳生长调节剂组合,诱导率平均达到30%,其中KT的浓度对诱导率影响最为显著,得到的愈伤组织生长状态较好,不易褐化。齐力旺[15]和徐康等[16]也在研究中添加低浓度KT得到了较高的胚性愈伤组织诱导率。
3.2 采集日期和基因型对湿地松胚性愈伤组织诱导的影响
确定适宜的球果采集时间有利于提高湿地松胚性愈伤组织诱导率[17-18]。本研究发现胚性愈伤组织诱导率随着球果采集日期呈先上升后下降的趋势,7 月4 日和7 月11 日采集的球果,合子胚发育阶段集中在合子胚发育的2~4 阶段,得到的胚性愈伤组织诱导率最高。本研究得到的最适采集日期与吴丽君[19]、徐康等[16]的研究结果略存在差异,但与张彩云等[20]相近,这可能是因为受地域、气候、家系等因素的影响;而发育至2~4阶段的合子胚适合作为胚性愈伤组织诱导的外植体的结论均一致。因此,在确定采集日期范围后,对合子胚的发育阶段进行检测,更能精准的选择最适诱导合子胚材料。
基因型是诱导湿地松胚性愈伤组织的重要因素[21-22],唐巍等[23]发现不同基因型的火炬松的胚性愈伤组织的诱导率差异显著,其中诱导率最高达到81.6%、最低为0%。吴夏雷等[24]验证了前人筛选出的3 个诱导效果较好的基因型杉木母株,可用于今后的取材选择。陈士刚等[25]研究发现红松5个不同家系未成熟种子的胚性愈伤组织诱导率不同。本研究筛选出16号基因型能够连续两年稳定保持较高的胚性愈伤组织诱导率,适于进行胚性愈伤组织的诱导。另外,通过显微观察发现7月11日采集的F-A 和F-B基因型湿地松球果处于合子胚发育的1~2 阶段,还未到球果的最适采集时间,后续可采集2~4 阶段的合子胚材料进一步研究。
同一基因型的不同采集日期的球果,合子胚的发育时期不同,胚性愈伤组织诱导率不同,且处于发育2~4阶段合子胚更易诱导出胚性愈伤组织;不同基因型球果的胚性愈伤组织诱导率差异显著,最佳采集日期也不同。这与梁芬[26]对黑松的体胚发生研究的结果一致。
3.3 碳源对湿地松胚性愈伤组织诱导的影响
体细胞胚胎发生和植株再生与碳源的种类和浓度相关[27]。碳源不仅可以提供营养物质,还能通过调节培养基的渗透压[28],帮助培养物吸收培养基中的养分和水分[29]。本研究首次以松三糖作为碳源,最适浓度为1.5 g/L,胚性愈伤组织诱导率达到40%,高于吴丽君[4]、胡继文等[5]的研究结果,对湿地松胚性愈伤组织诱导有明显促进作用,但成本较高,不适合应用在规模化、产业化的生产过程中。蔗糖和麦芽糖是组织培养中常用的碳源[30],蔗糖和麦芽糖最适浓度均为30 g/L,麦芽糖最高诱导率为30%,蔗糖最高诱导率仅为20%。但在前期试验中得到蔗糖最适浓度为30 g/L,诱导率可达30%以上,这可能是受试验材料的影响。麦芽糖和蔗糖的诱导效果可达到相近,而蔗糖成本更低,因此,本研究中添加30 g/L的蔗糖作为碳源。高芳[31]在红松愈伤组织诱导中得到蔗糖浓度不仅影响诱导率,还与胚性愈伤组织的褐化有关,添加35 g/L的蔗糖胚性愈伤组织诱导率最高,且褐化率最低。
3.4 湿地松合子胚发育阶段划分及内源激素变化
本研究参考火炬松合子胚发育时期的划分方法将湿地松合子胚划分为8个发育时期,模拟并分析8个时期的4 种内源激素的动态变化趋势,结果显示:随着湿地松未成熟合子胚逐渐发育至成熟,ABA 呈现先上升后下降的趋势,与红松[32]和楸树[33]的内源ABA 含量变化趋势一致;IAA 呈现逐渐上升的趋势;ZR和GA3的含量较低,呈平稳波动状态。
ABA是一种较强的生长抑制剂,对生长的作用与IAA相反。在种子胚发育期间,内源ABA可促进胚正常发育成熟以及抑制胚过早萌发,ABA 在转录水平上促进贮藏蛋白质的合成[34]。在针叶树的胚性愈伤组织诱导研究中发现添加适量的外源ABA,能够提高胚性愈伤组织的启动速率[12,34]。Yang等[35]也发现在湿地松诱导培养基中添加1~2 mg/L ABA提高了胚性愈伤组织的平均启动速率。本实验中合子胚内源ABA含量与胚性愈伤组织诱导率变化趋势一致,呈现先上升后下降的趋势,推测可能是因为ABA促进贮藏蛋白质的合成,贮藏蛋白质在胚性愈伤组织的形成过程中有重要作用。
3.5 其他添加物对湿地松胚性愈伤组织诱导的影响
另外本研究还发现:添加3.0 g/L 结冷胶的胚性愈伤组织诱导率显著高于添加6.0 g/L 结冷胶。随着外源添加硝酸银浓度的增加,湿地松体胚诱导率逐渐下降。这与Jain 等[36]研究结果一致,在北美云杉胚性愈伤组织的诱导培养基中添加AgNO3,明显降低了胚性愈伤组织的诱导率,还会抑制体胚的成熟。但与Pullman等[12]观点相反。这可能是不同树种和外植体导致的差异。
3.6 结论
在江西中部地区于7 月中上旬选取处于多胚头、裂生多胚及球形胚发育时期的2~4 阶段的湿地松未成熟合子胚作为外植体较好;不同基因型未成熟合子胚同一时间发育时期不同,且在不同发育时期合子胚的内源激素呈现动态变化,其中内源激素ABA对湿地松胚性愈伤组织的诱导具有重要调控作用;外源激素和碳源等因子影响湿地松胚性愈伤组织诱导,考虑到成本,以DCR 作为基本培养基,激素水平为2.2 mg/L KT+2.2 mg/L 2,4-D+2.2 mg/L 6-BA,30 g/L蔗糖为碳源,在(23±1)oC温度条件下培养7周,是湿地松胚性愈伤组织诱导最适宜培养体系。在今后需加强体胚发生机理的研究,尤其是胚性细胞同步化,构建湿地松体细胞胚胎发生及植株再生的高效稳定培养体系。
