延边牛UCP3 基因CDS 区克隆、生物信息学分析及组织mRNA 表达研究
2021-11-18张军芳孙建富王恩泽李香子
孙 斌,唐 琳,张军芳,孙建富,崔 岩,王 英,王恩泽,李 强,李香子
(延边大学农学院,东北寒区肉牛科技创新教育部工程研究中心,吉林省肉牛科学与产业技术重大需求协同创新中心,吉林延吉 133002)
延边牛属寒温带山区的役肉兼用品种,适应性强。在延边等地极为寒冷的冬季,延边牛也能够正常地生存、生产,并表现出较为理想的生产性能和遗传稳定性,在-26℃时才出现明显不安,但依然能保持正常食欲和反刍。延边牛既是我国东北部宝贵的抗寒品种,又是研究大型哺乳动物抗寒性能不可多得的优秀模型。
解偶联蛋白(UCP)是位于线粒体内膜上的蛋白质家族成员,这些蛋白质与能量消耗、生热、游离脂肪酸的调节和活性氧的减少有关[1]。UCP 能控制线粒体内膜两侧跨膜质子,通过浓度差影响下的氧化磷酸化减缓三磷酸腺苷的产生;UCP 本质即依靠解除呼吸链中应当具备的电子传递、磷酸化的关系,使得磷酸化进入到空转状态[2]。依据具体的功能,UCP 分为UCP1、UCP2、UCP3、UCP4、UCP5[3]。其中,UCP3 蛋白对哺乳动物的体温调节起着重要作用[4],主要参与非震颤产热。UCP3 蛋白为转运载体,对线粒体内膜产生影响,最后会氧化为脂肪酸阴离子,这也会造成其浓度梯度随之消失,之后则是产生质子漏,造成其合成效率显著降低,产生一定解偶联,同时将存储之能量以热能进行释放,让动物可在寒冷状态下维持体温[5]。
在大鼠中,UCP3基因主要在棕色脂肪中表达,其次是在阔筋膜张肌、胫骨前肌、腓肠肌和慢抽动氧化代谢的肌肉中表达,在心脏、肺和外周血中也发现了低表达的UCP3基因[6]。研究表明,UCP3基因表达增加是由血浆中脂质水平升高所诱导的,在禁食、饥饿、高脂饮食、冷暴露期间[7-8]和直接供应脂肪酸都可以使UCP3表达增加[9]。目前,其他哺乳动物(啮齿类动物、猪)中UCP3的基因序列已相继被报道[10]。本文围绕延边牛肌肉组织开展针对性的分析,克隆得到UCP3 的CDS 区序列,对其开展生物信息学分析,探究UCP3基因在延边牛不同组织中的表达变化,为其抗寒机理提供基础数据。
1 材料与方法
1.1 样品采集 于2020 年11 月,在延边德海牧场选取3 头20 月龄的延边牛,采集其心、肝、脾、肺、肾、小肠、脂肪和肌肉作为组织样品,放至冷冻管中并迅速置入液氮中带回实验室,保存在-80℃冰箱。
1.2 实验试剂 总RNA 提取试剂TRIzoI Reagent 购自Life 公司,RNA 反转录试剂盒和实时荧光定量试剂盒、cDNA 第一链合成预混试剂、PCR 扩增2×TaqPCR 预混试剂II 购自天根生化科技(北京)有限公司,琼脂糖凝胶DNA 回收试剂盒、T4 DNA Ligase、普通质粒提取试剂盒、氨苄青霉素、琼脂糖购自生工生物工程(上海)股份有限公司;pMD18-T 购自TaKaRa 公司。
1.3 仪器与设备 干式恒温器(GL-1800)购自海门其林贝尔仪器制造有限公司,小型台式冷冻型离心机(5417R)购自Eppendorf 公司,超微量分光光度计(NanoDrop 2000)购自Thermo 公司,电泳仪(Model 300V)购自LABNET 公司,多功能分子成像系统(Azure 600)购自Azure Biosystems 公司,梯度PCR仪(TC-5000)购自Techne 公司,实时荧光定量PCR仪(Mx3005P)购自Agilent 公司。
1.4 引物设计合成使用Primer Premier 5.0 软 件,根据GenBank 中已公布的牛UCP3基因(登录号:NM_174210)序列设计普通PCR(扩增UCP3基因的CDS 区)及实时荧光定量PCR 引物,以管家基因GAPDH(登录号:NM_001034034.2)作为内参。引物由生工生物工程(上海)股份有限公司合成,引物信息见表1。

表1 引物序列
1.5 延边牛组织总RNA 的提取及cDNA 的合成 按照TRIzol Reagent 试剂盒说明书对小块心肌组织样品的总RNA 进行提取,通过超微量分光光度计检测提取的RNA 质量(OD260/OD280),将符合要求的总RNA 进行逆转录获得cDNA,-20℃保存,备用。逆转录采用天根FastKing 一步法试剂盒,反转录体系50 μL:Total RNA 5 μL(1 µg/µL),5×FastKing-RT Super MIX 10 μL,RNase-free water 35 μL。
1.6 延边牛UCP3基因CDS 区克隆 以cDNA 为模板,对延边牛UCP3基因CDS 区进行PCR 扩增,扩增体系为20 μL:cDNA 模板2 μL(1 µg/µL),上、下游引物各0.5 μL(10 pmol/ μL),2×Taq PCR MasterMix II 10 μL,RNase-free water 7 μL。扩增条件为:94℃ 3 min;94℃30 s,58℃ 30 s,72℃ 2 min,35 个循环;72℃ 5 min。反应结束后取10 μL 反应产物进行琼脂糖凝胶电泳检测。对符合预期大小的PCR 产物用琼脂糖凝胶DNA 回收试剂盒回收。将回收后的目的DNA 片段与pMD18-T载体连接,连接反应体系10 μL:目的DNA 片段4 μL(0.1 pmol/ μL),pMD18-T 载体1 μL(0.01 pmol/ μL),10×T4 DNA ligase Buffer 4 μL,T4 DNA Ligase 1 μL,置于16℃反应8 h。连接后转化为感受态细胞,通过对含有氨苄抗性的LB 培养基实施涂布,经由单菌落开展扩繁,再提取质粒,在处理过程中以提取的质粒为模板进行PCR 鉴定,生工生物工程(上海)有限公司负责对提取鉴定出的质粒进行测序验证。
1.7 延边牛UCP3基因生物信息学分析 用NCBI 中BLAST 与黄牛(Bos taurus,登录号:NM_174210.1)、水牛(Bubalus bubalis,登录号:XM_006073312.2)、绵羊(Ovis aries,登录号:NM_001308581.1)、山羊(Capra hircus,登录号:XM_005689964.3)、野猪(Sus scrofa,登录号:AF128837.1)、北极熊(Ursus maritimus,登录号:XM_008707338.1)、野生双峰驼(Bactrian camel,登录号:XM_014556631.2)进行同源性对比分析,MEGA7.0软件构建进化树,利用在线软件ProtParam(https://web.expasy.org/protparam/)和ProtScale(https://web.expasy.org/protscale/)预测UCP3 蛋白的理化性质,NetPhos3.1(http://www.cbs.dtu.dk/services/NetPhos/)、NetOGlyc4.0(http://www.cbs.dtu.dk/services/NetOGlyc/)和Scratch Protein Predictor(http://scratch.proteomics.ics.uci.edu/)预测UCP3 蛋白潜在的磷酸化位点、糖基化位点及二硫键分析,SignalP 4.1 Server(http://www.cbs.dtu.dk/services/ Signal P-4.1/)预测UCP3 蛋白信号肽,TargetP 1.1 Server(http://www.cbs.dtu.dk/services/ TargetP-1.1/index.php)和PSORT(https://www.genscript.com/psort.html)分析UCP3 蛋白的亚细胞定位,SOPMA(https://npsaprabi.ibcp.fr/cgi-bin/npsaautomat.pl?Page=npsasopma.html)和PHYRE2(http://www.sbg.bio.ic.ac.uk/phyre2/html/page.cgi?id=index)预测UCP3 蛋白的二级结构和三级结构。
1.8 延边牛各组织相对表达量分析 以GAPDH 为内参基因进行qRT-PCR 分析延边牛各组织样品中UCP3基因的相对表达量,反应体系20 μL:2×SuperReal Premixplus 10 µL,50×Rox Reference Dye 0.3 µL,上、下游引物各0.6 µL(10 pmol/μL),cDNA 模板1 µL(1 µg/µL),RNase-free ddH2O 7.5 µL。每个待测样品设置3 个重复,反应程序:95℃ 15 min;95℃ 10 s,55℃30 s,72℃ 32 s,35 个循环;95℃ 15 s,60℃ 1 min,95℃ 15 s。
1.9 统计分析 运用2−ΔΔCT法对所得数据进行分析,利用SPSS 19.0 软件对UCP3基因在延边牛不同组织中的表达水平进行单因素方差分析,以P<0.05 为差异显著性判断标准。
2 结果与分析
2.1 PCR 扩增结果 利用超微量分光光度计测定RNA质量(OD260/OD280),测定值在1.8~2.0,RNA 结构的完整性好,无蛋白以及DNA 污染,可进行后续实验。PCR 扩增产物采用1%的琼脂糖凝胶电泳分析,可见1条1 100 bp 左右的DNA 片段(图1),与预期大小一致。

图1 延边牛UCP3 基因CDS 区扩增结果
2.2UCP3基因序列的生物信息学分析
2.2.1 序列分析结果 由图2 可知,延边牛UCP3基因与黄牛、水牛、绵羊、山羊、野猪、北极熊、野生双峰驼的同源性分别为100%、99.82%、97.33%、97.44%、90.50%、90.09%、90.72%。基于多种物种UCP3 核苷酸序列,运用MEGA7.0 描绘发育树得出,研究基因和黄牛、水牛之间的亲缘关系相对较近,而和野鸡之间的亲缘关系则是相对最远。

图2 UCP3 基因系统进化树
2.2.2 UCP3 蛋白质的理化性质 通过ProtParam 对延边牛UCP3 蛋白的理化性质进行分析,结果显示,该蛋白质的分子质量为34 205.74 ku,理论等电点(Theoretical pI)为9.46,蛋白分子式为C1526H2414N416O434S21,总原子数为4 811。UCP3基因共编码311 个氨基酸,氨基酸组成如表1 所示,其中Leu(L)最多,且不含Pyl(O),氨基酸组成结果显示,带负电残基总数(Asp+Glu)21 个,带正电残基总数(Arg+Lys)33 个,消光系数29 255,不稳定指数为45.90,说明该蛋白为不稳定蛋白,脂溶系数为81.54,在体外网状红细胞的半衰期为30 h,总平均亲水性为0.018,表明其具有一定的亲水性。
利用ProtScale 在线软件预测延边牛UCP3 蛋白质的疏水性,结果如图3 所示,组成UCP3 的氨基酸中亲水性残基所占比例较大,整体表现为亲水性,与Protparam 软件预测结果一致。

图3 UCP3 蛋白疏水性分析
2.2.3 延边牛UCP3 蛋白的磷酸化位点和糖基化位点利用在线软件Net Phos3.1 对UCP3 潜在的磷酸化位点进行分析,结果显示,UCP3 存在28 处潜在的磷酸化位点,包括3 处潜在的Tyr 磷酸化位点、10 处潜在的Thr 磷酸化位点、15 处潜在的Ser 磷酸化位点。
分别用在线软件NetOGlyc 4.0 和NetNGlyc 1.0 对UCP3 潜在的O-糖基化位点和N-糖基化进行分析,UCP3 存在4 个潜在的O-糖基化位点,分别位于第7、12、13、14 位氨基酸处;存在1 个N-糖基化潜在位点,位于第184 位氨基酸处。
2.2.4 延边牛UCP3 蛋白跨膜区预测及信号肽、亚细胞定位预测 利用TMHMM 2.0 Server 在线软件分析跨膜结构域,结果显示,该基因的编码产物不存在跨膜螺旋结构,跨膜螺旋氨基酸残基数量的预测值为4.590 98,蛋白质前60 个氨基酸的跨膜螺旋数预测值为0.877 78,位于膜细胞质侧的总概率为0.045 22。

表2 UCP3 蛋白的氨基酸组成
利用SignalP 4.1 Server 在线软件进行分析,区分信号肽和非信号肽临界值为D=0.450,UCP3 预测D=0.168。根据信号肽假说推测UCP3 编码蛋白不存在信号肽,属于非分泌蛋白。
用TargetP 1.1 Server 和PSORT 分析UCP3 蛋白的亚细胞定位发现,线粒体作用位点(mTP)所占比例很小为0.058,分泌信号通路位点(SP)占比为0.506,并且无信号肽,因此可推测其合成后没有发生转运;UCP3 蛋白主要分布于线粒体中,其次分布于细胞质,细胞核中也有少量分布(表3)。

表3 UCP3 蛋白亚细胞定位
2.2.5 UCP3 蛋白高级结构预测 UCP3 蛋白的二级结构主要含有α-螺旋(Alpha helix)、延伸链(Extended strand)、无规卷曲(Random coil)和β-转角(Beta turn)(图4)。其中α-螺旋有142 个氨基酸,占45.66%;无规卷曲有99 个氨基酸,占31.83%;延伸链有50 个氨基酸,占16.08%;β-转角有20 个氨基酸,占6.23%。利用ExPASy 中Swiss-model 平台构建延边牛UCP3 蛋白可能的三级结构模型(图5),全局模型质量估计值为0.63,与模板相似性为74.92%,按照生物信息学理论,如果2 种蛋白质在连续100 个氨基酸范围内有大于40%的一致性,那么它们在结构上则具有较为显著的相似性,已知结构的蛋白可以作为建立目标蛋白结构模型的模板。此种情况下,按照同源建模方法能够提供详细而又准确的结构预测结果。
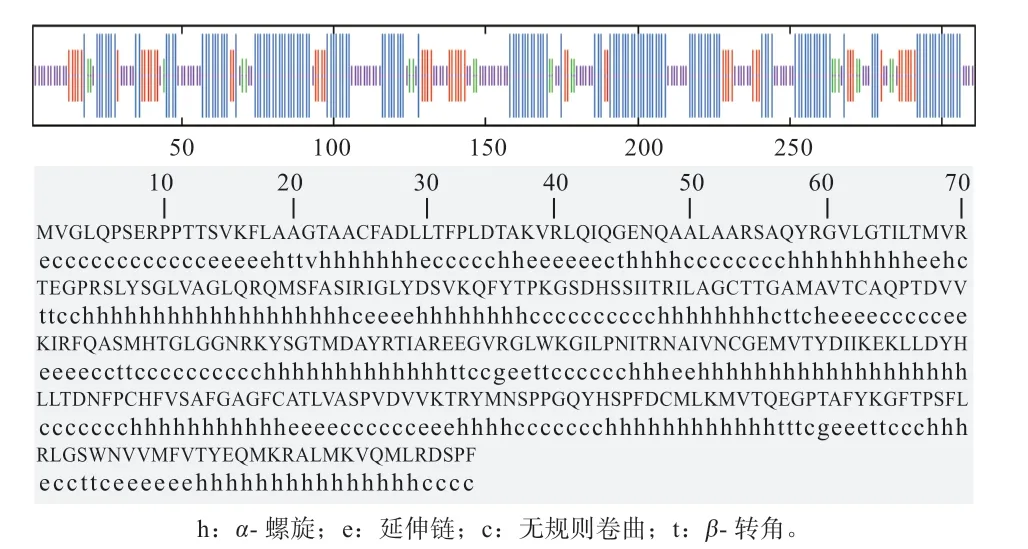
图4 预测UCP3 蛋白的二级结构
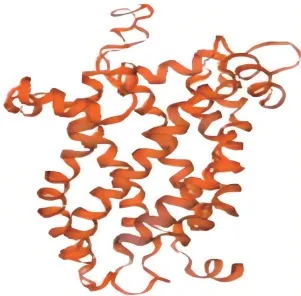
图5 UCP3 的三级结构模型
2.3UCP3基因在延边牛不同组织间的差异表达 如图6所示,UCP3基因在延边牛8 个组织中均有表达,其中在脾、肺、肌肉、小肠中的相对表达量最高(P<0.05);肝脏和肾脏中的表达量较低,两者无显著差异。
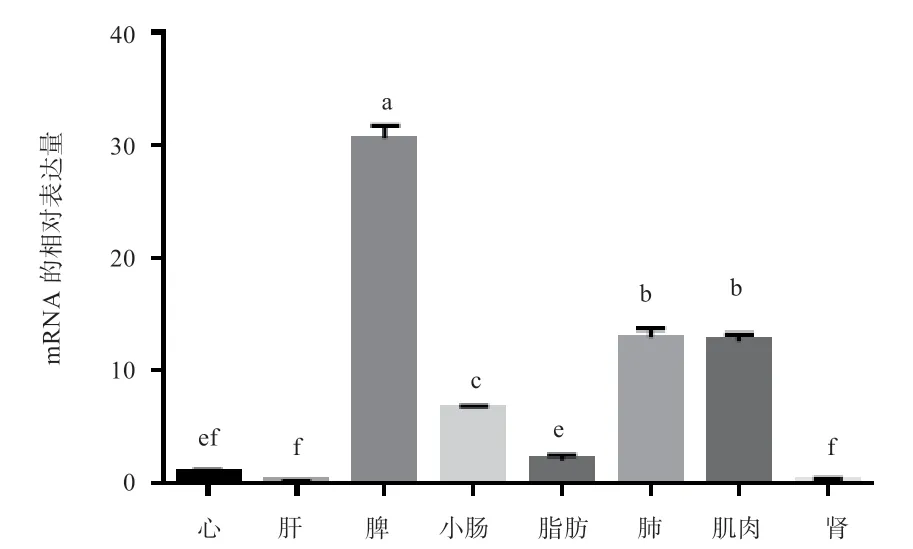
图6 UCP3 基因在延边牛各组织中的mRNA 相对表达量
3 讨 论
畜禽UCP3基因对生长性状的影响一直是动物遗传领域的研究热点[11],而在延边牛中的研究尚无报道。UCP3 是线粒体内膜中重要的转运蛋白,在机体能量代谢平衡以及体脂代谢过程中有较为显著的调控效果,并参与免疫应答和炎症过程。在哺乳动物中,UCP3 是T3产热作用的调节因子,禁食、恢复饲喂和注射瘦素等试验可调控UCP3基因的mRNA 表达水平,均可提高基础代谢率[12]。王启军等[13]对动物进行冷适应并检测其基因蛋白表达量变化,发现UCP3基因可能是骨路肌中重要的体温调节因子,通过短期内产热来调节骨骼肌中的能量平衡。研究表明,血液中游离脂肪酸(FFA)浓度对UCP3 蛋白的表达具有上调作用[14-16],UCP3 蛋白在调节机体能量代谢平衡及脂类代谢的过程中具有重要作用,能减少活性氧(ROS)种类,保护细胞免受破坏[17]。在啮齿类动物中UCP3基因表达主要分布于棕色脂肪组织和哺乳动物骨骼肌中[18-19],和机体能量代谢存在密切的联系,其可调控骨骼肌葡萄糖和线粒体脂肪转运机制,进而提供非震颤产热作用[20-21]。
本研究以延边牛肌肉为材料成功克隆出UCP3基因,分析结果显示延边牛UCP3 蛋白理化性质不稳定系数为45.90,说明蛋白理化性质不稳定。亲疏水性分析发现该蛋白平均亲水指数为-0.49,属于亲水性蛋白。根据信号肽假说推测UCP3 编码蛋白不存在信号肽,属于非分泌蛋白。UCP3 蛋白二级结构以α螺旋和无规卷曲为主,这与其转录模式相符合。蛋白质翻译后修饰是指在mRNA 翻译后形成蛋白质过程中的一种化学修饰。蛋白质翻译后修饰在蛋白质的功能和活性中起着非常重要的调节作用,而蛋白质的糖基化和磷酸化是最常见的翻译后修饰。具体而言,在蛋白质合成的过程中,磷酸基、乙酰基、糖类、脂类及碳水化合物等生化功能性基团在修饰酶的作用下共价结合到蛋白质骨架上或者侧链上。翻译后修饰会影响蛋白质的生理活性、化学、成熟度等性质,结构变得复杂、功能更加完善、作用专一性增加、调控更精确,从而增加蛋白质种类及功能的多样性,在细胞代谢过程中发挥着极为关键的作用。
涂荣剑[22]研究证实UCP3基因在猪的骨骼肌、心脏、脂肪中表达量比较丰富。仓木拉等[23]发现在人体中UCP3基因主要在骨骼肌中高表达,在心、肝、肾等组织表达量很少。Adams 等[24]研究发现小鼠UCP3 定位于7 号染色体,且仅在骨骼肌中表达。本研究检测UCP3基因在延边牛8 个不同部位的相对表达量,结果显示UCP3基因在脾脏、肺、肌肉中的表达量相对较高,在肝脏中的表达水平较低。说明UCP3基因在不同物种中的表达规律有所差异,但目前对于延边牛UCP3基因的相关性研究较少,功能与调控原理有待确认,需开展更为深入的分析。
4 结 论
本研究以延边牛肌肉为材料克隆出UCP3基因完整CDS 区,其长度为1 100 bp,编码311 个氨基酸,属于亲水性蛋白,存在28 个潜在的磷酸化位点,4 个O-糖基化潜在位点,1 个N-糖基化潜在位点,不存在信号肽。UCP3 蛋白是由α-螺旋、延伸链、无规卷曲和β-转角所组成的混合型蛋白,通过无规则卷曲连接,以α-螺旋为主。实时荧光定量PCR 结果显示,UCP3基因在延边牛脾组织中表达量最高,其次为肺和肌肉组织。本研究结果可为进一步研究延边牛UCP3基因的功能提供借鉴。
