基于内质网应激途径探讨蛇六谷提取物对大肠癌细胞5-FU耐药的逆转作用
2021-11-17陆淼炯褚卫建
陆淼炯,褚卫建
(杭州市中医院·浙江 杭州 310007)
近年来,我国大肠癌的发病率持续上升,现已高居恶性肿瘤第3位[1],死亡率位居恶性肿瘤第5位[2]。在大肠癌的治疗中化疗占重要地位,研究发现,化疗抵抗性的形成是导致化疗疗效下降的主要原因,但是具体的形成机制还不完全清楚[3-4]。5-氟尿嘧啶(5-Fluorouracil, 5-FU)作为一种抗代谢的化疗药物,能有效地降低淋巴结阳性的大肠癌患者的死亡率[5],然而其耐药问题仍然是其应用过程中的主要障碍[6]。因此,寻找低毒高效的药物对现有的化疗药物逆转耐药是肿瘤领域研究的热点和难点。魔芋葡甘露聚糖(KGM)是中药蛇六谷的主要成分,其抗肿瘤、化疗增敏等药理作用已成为研究的热点之一[7],然而目前有关KGM对逆转大肠癌5-FU耐药的作用及机制尚未明确。研究表明,激活内质网应激(endoplasmic reticulum stress, ERS)是逆转肿瘤耐药的重要途径之一[8]。因此,本研究通过构建HCT-8/5-FU耐药细胞模型,探究KGM通过ERS逆转大肠癌耐药作用,并进一步阐明其作用机制。
1 材料
1.1 细胞 人大肠癌细胞HCT-8购买于中国科学院上海细胞库。
1.2 药物与试剂 5-FU:美国Sigma公司,批号:04541;魔芋葡甘露聚糖(KGM,纯度≥98%):合肥博美生物科技有限公司,批号:180306。噻唑蓝(MTT):美国Sigma公司;DMEM培养液、胎牛血清:美国Hyclone公司;Annexin V/PI细胞凋亡检测试剂盒:美国BD公司;RIPA裂解液、BCA蛋白浓度测定试剂盒:上海碧云天公司;抗体(cleaved caspase-3、cleaved caspase-9、Bax、Bcl-2、PERK、elf2α、p-elf2α、ATF4、CHOP、GAPDH):美国CST公司;ECL显影液:美国BIO-RAD公司。
1.3 仪器 3001型全自动酶标仪:美国Thermo公司;TY-80B型转移脱色摇床:南京普阳科学仪器研究所;PowerPac Basic电泳仪:美国BIO-RAD公司;3300 Mini化学发光成像系统:中国CLinX公司;guava easyCyte流式细胞仪:美国Minipore公司。
2 实验方法
2.1 耐药株诱导、细胞培养及分组 非耐药的HCT-8细胞培养于含10%的胎牛血清、青霉素200 U·mL-1、链霉素200 U·mL-1的完全培养液中。将HCT-8细胞暴露于含10 μmol·L-15-FU、5%胎牛血清的DMEM培养液中21 d,经高浓度5-FU刺激诱导后,筛选出的细胞在无5-FU的培养液中扩增7 d,最终将细胞培养在含有1 μmol·L-15-FU的培养液中维持其耐药性,置于37 ℃、5% CO2培养箱中培养。随机将对数期的HCT-8/5-FU细胞分成4 个实验组,分别为空白对照组(等体积的PBS)、5-FU组(100 μmol·L-1)、KGM组(50 μmol·L-1)、5-FU(100 μmol·L-1)+KGM(50 μmol·L-1)组。
2.2 MTT法检测HCT-8/5-FU细胞耐药性以及KGM对其逆转耐药作用
耐药性检测:取对数期的HCT-8细胞和HCT-8/5-FU细胞接种到96孔板,调整起始细胞浓度为3 000个/孔,待大部分细胞长势良好、完全贴壁后,加入不同浓度的5-FU (5、10、15、20、25 μmol·L-1)处理HCT-8细胞,同时加入5-FU (50、100、150、200、250 μmol·L-1)处理HCT-8/5-FU细胞,每个浓度设置4个复孔。培养72 h后,每孔加入20 μL浓度为5 g/L的MTT溶液,培养箱中继续孵育4 h后每孔加入200 μL三联液,继续培养18 h,用酶标仪在570 nm条件下测定吸光度OD值。采用Graphpad Prism 5软件计算半抑制浓度(half maximal inhibitory concentration, IC50)值,RI=IC50(HCT-8/5-FU)/ IC50(HCT-8)。
逆转耐药作用检测:取对数期的HCT-8/5-FU细胞,消化离心后接种到96孔板,调整细胞浓度为3 000个/孔,待细胞贴壁生长后,用无明显抑制作用剂量下的KGM(50 μmol·L-1)联合不同浓度的5-FU(50、100、150、200、250 μmol·L-1)进行处理,计算IC50值,然后计算出耐药逆转倍数,评价逆转效果。逆转倍数= IC50(HCT-8/5-FU细胞5-FU单药)/IC50(HCT-8/5-FU细胞KGM与5-FU联用)。取HCT-8/5-FU细胞,以细胞浓度2 000个/孔的密度接种于96孔板中,随机分为空白对照组、5-FU组、KGM组、5-FU+KGM组,每组分别培养1~5 d,绘制时间-存活率的生存曲线。
2.3 Annexin V/PI双染色法检测细胞凋亡 实验分组:空白对照组、5-FU组(100 μmol·L-1)、KGM组(50 μmol·L-1)、5-FU+KGM组。将HCT-8/5-FU细胞以6×105/孔传代于6孔板中,细胞贴壁之后,按照分组情况加入药物,每组设置3个复孔,继续培养24 h后用PBS洗2遍,用胰酶消化后,用PBS重悬细胞,离心后加入1×Binding buffer 500 μL重悬细胞成细胞悬液,分别加入10 μL Annexin V-FITC和10 μL PI,避光孵育10 min,采用guava微流式细胞仪检测细胞凋亡情况,独立实验重复3次。
2.4 Western blot检测相关蛋白 将状态良好的HCT-8/5-FU细胞以8×105/孔传代于6 cm培养皿中,随机分为空白对照组、5-FU组、KGM组、5-FU+KGM组,待细胞贴壁之后,按照分组情况加入不同的药物处理24 h后,用PBS洗涤3次后加入RIPA裂解液,冰上裂解30 min后离心(12 000 r/min)取上清,采用BCA试剂盒测定蛋白浓度后,处理蛋白随后上样,用SDS-PAGE分离总蛋白,随后用湿转法转移至PVDF膜上,一抗4 ℃过夜,二抗室温孵育2 h后显影。
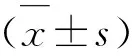
3 结果
3.1 HCT-8/5-FU细胞耐药性验证 MTT法检测不同浓度的5-FU对HCT-8和HCT-8/5-FU细胞增殖抑制作用, 5-FU对HCT-8/5-FU细胞的抑制作用明显低于HCT-8细胞,计算得到5-FU对HCT-8细胞的IC50为(15.04±2.03)μmol·L-1,对HCT-8/5-FU细胞的IC50为(152.22±5.03)μmol·L-1,耐药指数RI为10.12,说明HCT-8/5-FU细胞已具有明显的耐药特征。见图1。

图1 5-FU对HCT-8和HCT-8/5-FU细胞增殖的影响
3.2 KGM对HCT-8/5-FU细胞耐药性的逆转作用 MTT法检测结果可见KGM对HCT-8/5-FU细胞增殖具有一定的抑制作用,并且呈现出剂量依赖性。当KGM浓度为50 μmol·L-1时,开始表现出药物对细胞的抑制活性,且此时的细胞抑制率小于15%,可视为无显著抑制作用的药物剂量,因此,选择50 μmol·L-1作为KGM的联用剂量。见图2。KGM(50 μmol·L-1)联合不同浓度的5-FU可明显增加HCT-8/5-FU细胞对5-FU的敏感性,IC50为(26.12±1.08)μmol·L-1,与5-FU单用时的IC50相比,差异具有统计学意义(P<0.01),耐药逆转倍数为5.83。见图3。

图2 KGM对HCT-8/5-FU细胞增殖的影响

图3 KGM(50 μmol·L-1)联合不同浓度的5-FU对HCT-8/5-FU细胞增殖的影响
3.3 KGM与5-FU联用对HCT-8/5-FU细胞凋亡的影响
3.3.1 凋亡率流式细胞术检测检测结果 与空白对照组相比,KGM和5-FU单用时均无显著性变化;与空白对照组及5-FU单用组相比,KGM和5-FU联用组的细胞凋亡率显著上升(P<0.01)。见图4~图5。

图4 各组HCT-8/5-FU细胞凋亡率的流式细胞术检测结果

注:与Con组比较*P<0.05,**P<0.01;与5-FU组比较,#P<0.05,##P<0.01图5 各组HCT-8/5-FU细胞凋亡率比较
3.3.2 凋亡相关蛋白表达的Western blot检测结果 与空白对照组相比,KGM单用组以及5-FU联合KGM组细胞中cleaved caspase-3、cleaved caspase-9、Bax蛋白表达量显著升高(P<0.05或0.01),Bcl-2蛋白表达显著降低(P<0.05);且与5-FU单用组相比,5-FU联合KGM组cleaved caspase-3、cleaved caspase-9、Bax蛋白表达量显著升高(P<0.05或0.01),Bcl-2蛋白表达显著降低(P<0.05)。见图6~图7。
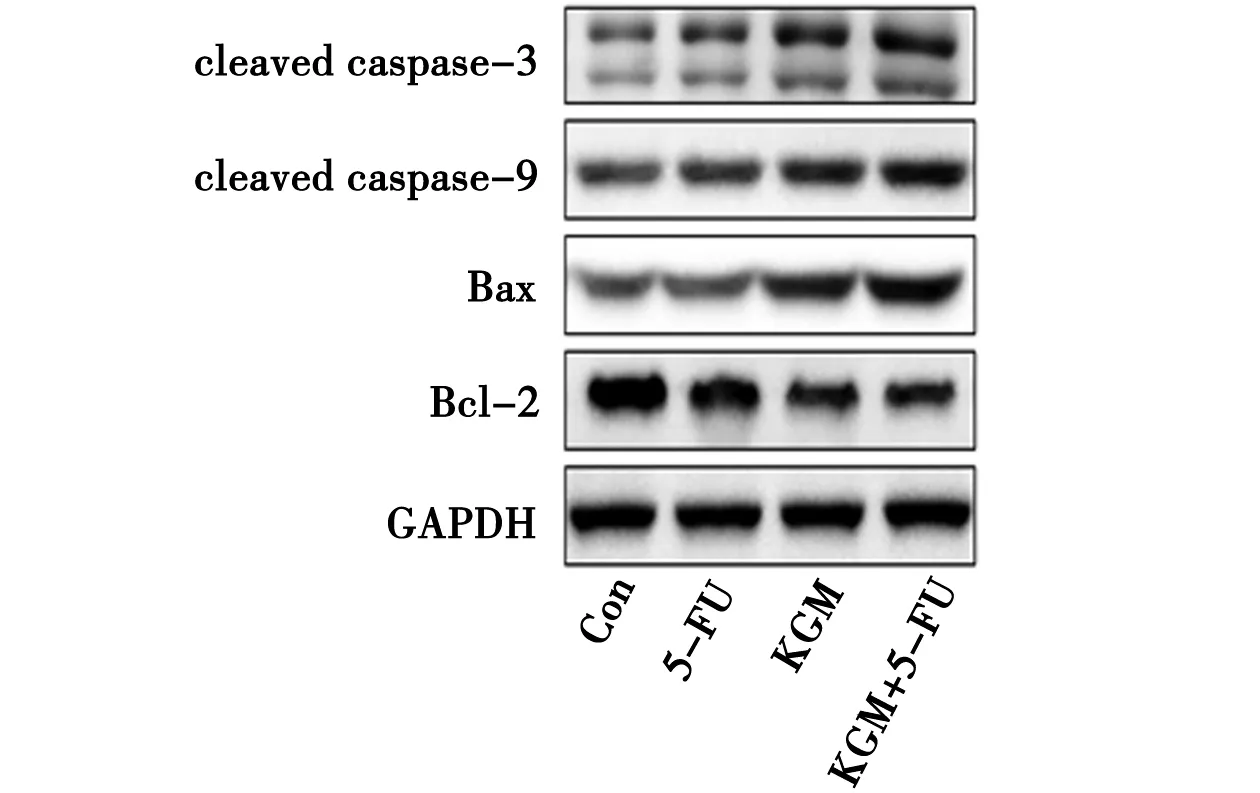
图6 各组HCT-8/5-FU细胞凋亡相关蛋白表达的Western Blot检测结果

注:与Con组比较*P<0.05,**P<0.01;与5-FU组比较,#P<0.05,##P<0.01图7 各组HCT-8/5-FU细胞凋亡相关蛋白表达的比较
3.4 KGM与5-FU联用对内质网应激相关蛋白的影响 与空白对照组相比,KGM单用组PEAK、ATF4、CHOP蛋白表达显著升高(P<0.05);5-FU与KGM联用组较空白对照组及5-FU单用组的PEAK、p-elf2α、ATF4、CHOP蛋白均显著升高(P<0.05或0.01)。见图8~图9。
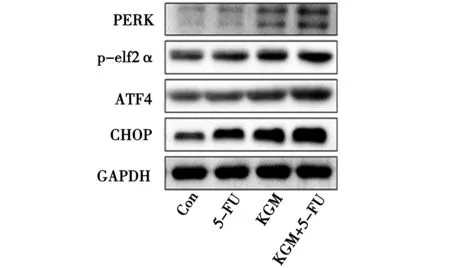
图8 各组HCT-8/5-FU细胞内质网应激信号通路相关蛋白表达的Western Blot检测结果

注:与Con组比较,*P<0.05,**P<0.01;与5-FU组比较,#P<0.05,##P<0.01图9 各组HCT-8/5-FU细胞内质网应激信号通路相关蛋白表达的比较
4 讨论
化疗后肿瘤对化疗药物产生多药耐药(MDR)已经成为大肠癌化疗失败并导致肿瘤复发和患者死亡的重要原因[9]。5-FU是一种较为成熟化疗药物,主要通过抑制胸苷酸合成酶或者结合到DNA和RNA诱导细胞发生凋亡[10]。然而,由化疗耐药而引起的复发以及转移仍然是进一步提高疗效的主要障碍。天然药物由于其多层次、多环节、多靶点、整体调节的抗肿瘤特点,对现有的化疗药物逆转耐药具有重要的作用,协同化疗优化干预治疗是目前天然药物治疗肿瘤最常见的模式之一[11]。KGM是传统中药蛇六谷的主要成分,也是发挥抗肿瘤作用的主要成分。本研究通过建立大肠癌5-FU耐药细胞株HCT-8/5-FU探究KGM对其耐药性的逆转作用,并进一步阐明其作用机制。实验发现KGM联合不同浓度的5-FU使用能够有效地抑制HCT-8/5-FU细胞的增殖,IC50从单独用药时的(152.22±5.03)μmol·L-1降低至(26.12±1.08)μmol·L-1,耐药逆转倍数达到5.83,证明KGM能够有效逆转HCT-8/5-FU细胞对5-FU的耐药性。
内质网(ER)参与蛋白质的合成、折叠和组装,同时也是脂质、固醇类合成和维持钙离子稳态的重要场所。缺氧、氧化应激、Ca2+稳态失衡等多种因素可导致异常蛋白在内质网聚集,进而引发内质网的应激反应[12-14],进而导致蛋白质的生物合成减少,降低内质网负担,维持细胞内的稳态。内质网应激(ERS)反应性凋亡是一种新的细胞凋亡通路[15-16],凋亡启动蛋白CHOP在ERS反应性凋亡中具有重要作用[17]。研究表明,在对ERS的即时反应中,内质网跨膜蛋白激酶PEAK蛋白被激活后进一步使elf2α磷酸化,同时诱导ATF4的翻译,并随上调CHOP蛋白的表达[18-19],因此PERK介导的PERK-elf2α-ATF4信号通路在诱导CHOP表达促进细胞凋亡中起着重要作用。本研究结果显示,KGM联合5-FU能够明显增加HCT-8/5-FU细胞的凋亡率,Western blot检测显示cleaved caspase-3、cleaved caspase-9、Bax蛋白表达量显著升高(P<0.05或0.01),Bcl-2蛋白表达显著降低(P<0.05),从蛋白层面证实该结论。内质网应激相关蛋白的检测结果显示,5-FU与KGM联合用药后HCT-8/5-FU细胞中PEAK、p-elf2α、ATF4、CHOP蛋白表达均上调,表明PERK-elf2α-ATF4信号通路异常活化,内质网应激被激活。
综上所述,魔芋葡甘露聚糖可通过调控PERK-elf2α-ATF4信号通路,介导内质网应激,诱导细胞产生凋亡,进而逆转大肠癌细胞5-FU耐药。
