拮抗铜绿假单胞菌的乳酸菌筛选及机制研究
2021-11-17李建周肖尧婷李红霄陈晓华李安平
李建周 肖尧婷 李红霄 陈晓华,,4 李安平
(1.中南林业科技大学食品学院,湖南 长沙 410004;2.衡阳师范学院南岳学院,湖南 衡阳 421002;3.衡阳师范学院生命科学与环境学院,湖南 衡阳 421008;4.衡阳师范学院南岳山区生物资源保护与利用湖南省重点实验室,湖南 衡阳 421008)
铜绿假单胞菌(Pseudomonasaeruginosa,PA)又称绿脓杆菌,是典型的条件致病菌[1],同时也是重要的食源性致病菌,其产生的毒力因子可引起食物中毒和饮用水的污染,导致患者产生头晕、呕吐和腹泻等症状[2-3]。由于PA具有内源性、获得性和适应性多重耐药机制,常导致多重耐药性PA菌株的出现和抗生素治疗的失败[4]。2017年世界卫生组织将耐碳青霉烯的PA列为迫切需要开发新抗菌药物治疗的细菌之一。因此,开发新的抗菌药物和寻找天然具有抗菌作用的替代物是临床PA治疗的理想选择。
乳酸菌(Lacticacidbacteria,LAB)是一类对人体有益的重要微生物,被公认为是安全的食品级微生物。LAB在自然界中广泛存在,土壤、食品以及人体、畜禽肠道内均含有LAB。LAB代谢过程中产生的有机酸抗菌肽,可抑制病原微生物生长繁殖、调节肠道微生物菌群平衡,从而对宿主的营养状态、生理功能、应激反应等产生作用。目前临床中许多益生LAB已被用来预防或治疗各种胃肠疾病,包括感染性腹泻、新生儿肠炎、慢性结肠炎、肠易激综合症和炎症性肠病[5]。
微生物通过群体感应系统(QS)协调群体行为,其中存在多种QS系统,革兰氏G+和革兰氏G-中都存在的自诱导物AI-2,是不同种属细菌间通讯交流的通用信号分子。AI-2是一种呋喃酮类化合物,为对称的双五圆环结构的呋喃酮酰硼酸二酯,是甲硫氨酸循环通路——甲基循环的一个副产品。目前已知70多个种属的细菌基因组中含有luxS的同源序列,并且AI-2的生物合成途径基本相似。微生物菌群中AI-2信号分子的表达受AI-2/LuxS QS系统调控,且参与QS的luxS基因可调控LAB的生理活性[6],LAB的抑菌机制与AI-2/LuxS的表达系统有关[7-8]。QS系统可以调控LAB的多项重要生理功能,如调控菌体生物膜的形成[9]、胞外酶的合成[10]、抗菌肽的合成[11]、肠道定殖能力[12]等。Park等[13]发现从泡菜中筛选出的清酒乳杆菌(Lactobacillussakei)NR28 对大肠埃希氏杆菌(Escherichiacoli)ATCC43894的AI-2具有淬灭作用,能达到降低致病性的目的。陈小春等[14]研究发现太平洋杆菌可通过抑制PA的QS系统降低PA毒力因子的表达。Rana等[15]利用LAB(乳酸乳球菌、发酵乳杆菌和鼠李糖乳杆菌)上清液抑制PAO1信号分子AHL的表达,从而抑制弹性蛋白酶活性,降低PA生物膜的形成。Chappell等[16]通过构建乳杆菌工程菌,表达降解PA生物膜的酶,抑制PA生物膜的形成。综上,LAB有抑制PA的作用,但LAB抑制PA的作用机制尚未明晰。
研究拟筛选抑制PA的LAB,通过测定LAB群体感应信号分子AI-2的表达,LAB抑制PA生物膜形成、绿脓菌素(PYO)表达及LAB无菌上清液与PA共培养时AI-2信号分子的表达探讨LAB拮抗PA的机制。旨在为乳杆菌拮抗PA的机制研究提供新的思路,也为乳杆菌益生特性的应用提供依据。
1 材料与方法
1.1 菌株与培养基
12株LAB(其中6株来源于泡菜,2株来源于腐乳,2株来源于鸡粪便,1株来源于发酵米,1株来源于酸奶)、铜绿假单胞菌(PAO1)、哈维氏弧菌(VibrioharveyiBB170, BB152)大肠杆菌(EscherichiacoliDH5α):实验室保存菌株;
LAB培养用MRS培养基、AO1用LB培养基、BB170和BB152用海生培养基、DH5α用LB培养基:青岛海博生物技术有限公司。
1.2 菌株的培养及上清液制备
LAB按体积分数2%接种于MRS培养基中,37 ℃活化3代,继续培养18 h;PAO1按体积分数1%接种于LB培养基,37 ℃活化3代,继续培养18 h;BB170、BB152按体积分数2%接种于AB培养基中,30 ℃活化3代,继续培养12 h;DH5α按体积分数1%接种于LB培养基中,30 ℃活化3代,继续培养18 h。以上菌株获得培养液后,6 000 r/min离心10 min,上清液用0.22 μm过滤器过滤,获得试验菌株的无菌上清液,于-80 ℃超低温冰箱保存备用。
1.3 共培养物上清液的制备
将LAB上清液、MRS培养基上清液、DH5α上清液以及LB培养基上清液分别按V上清液∶VPA菌液=1∶1分别接入浓度为106CFU/mL的PA菌液中,培养24 h,6 000 r/min离心10 min,上清液用0.22 μm滤菌器过滤,得到无菌共培养上清液,于-80 ℃超低温冰箱保存备用。
1.4 LAB抑菌能力测定
参照Chappell等[16]的方法并稍作修改。将质量分数2%琼脂灭菌后倒入平板中,凝固后放入4个无菌牛津杯,倒入浓度约为106CFU/mL的PA菌液,待凝固后,用镊子夹出。取200 μL LAB上清液加入到牛津杯孔中,37 ℃培养24 h,测定抑菌圈直径。每个样品做3个平行,重复3次。以MRS培养基(pH 4.0)作为空白对照。抑菌圈直径>15 mm判定为高度敏感;抑菌圈直径为11~15 mm 判定为中度敏感;抑菌圈直径为5~10 mm 判定为低度敏感;抑菌圈直径为4 mm 判定为不敏感[17]。
1.5 信号分子AI-2的检测
参照蔡针华等[18]的方法稍作修改。将BB170按体积分数2%接种于海生培养基,30 ℃培养12 h,至菌体OD600 nm为0.8~1.2,用新鲜的AB培养基以1∶100稀释BB170培养液,充分震荡混匀后备用。将LAB上清液、BB152无菌上清液、DH5α无菌上清液和BB170培养稀释液分别作为待测样品、阳性对照、阴性对照和介质对照,各4个平行。按体积比1∶100与稀释后的BB 170培养液混合培养3.5 h,测定化学发光值。用相对荧光强度表示信号分子AI-2的强度,分别按式(1)和式(2)进行计算。
(1)
(2)
式中:
NAI-2——阴性对照组相对荧光强度;
FI,1——阴性对照组荧光强度;
FI,2——阳性对照组荧光强度;
TAI-2——待测组相对荧光强度;
FI,3——待测样品荧光强度;
FI,4——介质对照组荧光强度。
1.6 绿脓菌素(PYO)的测定
参照Lou等[19]的方法稍作修改。将共培养物上清液于-80 ℃超低温冰箱中预冻2 h后冻干浓缩。加入3 mL三氯甲烷,待完全溶解后加入1 mol/L的盐酸1 mL,充分振荡后静置。待分层后取盐酸层测定其OD520 nm,此OD520 nm即表示PYO含量。
1.7 生物膜的测定
参照张立冬等[20]的方法并稍作修改。PA按体积分数1%接种于LB培养基,37 ℃培养18 h后,用LB培养基按1∶100稀释,充分震荡备用。将LAB上清液按体积比1∶100与稀释后的PA培养液混匀,移取200 μL至96孔酶标板中,37 ℃培养18 h,倒掉菌液,用PBS冲洗4次,烘干。吸取200 μL结晶紫染液染色10 min,倒出染色剂再用PBS冲洗4次,烘干。加入200 μL脱色剂,测定OD600 nm。以OD600 nm表示生物膜的生成量,以MRS与PA共培养的OD600 nm为阳性对照,并按式(3)计算细胞膜抑制率。
(3)
式中:
BFI——细胞膜抑制率,%;
A1——各种LAB与PA共培养时所测的OD600 nm;
A2——MRS与PA共培养时所测的OD600 nm。
1.8 数据分析
采用SPSS 20单因素方差分析进行差异性分析(P<0.05),并使用GraphPad Primer 8.5软件进行绘图。
2 结果与分析
2.1 LAB抑菌能力
由表1和图1可知,LGchen、S-5-6和L1 3株LAB的抑菌圈直径分别为22.27,20.20,20.13 mm,显著高于其他9种LAB的,N34的抑菌圈直径最小,为12.33 mm,说明LAB对PA的抑菌效果具有菌株特异性。试验中MRS-pH 4.0作为参照也有一定的抑菌效果,说明酸对PA生长有一定的抑制效果,但筛选的LAB的抑制效果强于MRS抑制效果,推测LAB的抗菌作用除受酸影响外,还可能与LAB的其他代谢物质有关,如过氧化氢、乙酸、乳酸及其他有机酸和细菌素等物质均有抑菌作用。刘君等[21]从鱼、虾肠道分离得到的戊糖片球菌对美人鱼发光杆菌、大肠杆菌、溶藻弧菌、铜绿假单胞菌、创伤弧菌、副溶血弧菌等有不同程度的抑制作用。朱英莲等[22]从发酵食品中分离出的6株LAB,其中3株有较好的抑制假单胞菌效果,产生的LAB素具有很好的耐热性,在酸性条件下表现出良好的抑菌效果。LAB上清液对PA的生长也有明显的抑制效果,说明LAB的代谢物具有抗菌作用,其具体抗菌物质需进一步研究。

图1 LAB抑制PA生长
为研究LAB抑制PA感染的机制,选取4株抑菌高度敏感(LGchen、ZX5、L1和S-5-6)和2株抑菌中度敏感(N34和L23)的LAB进一步研究。经16S rRNA鉴定,N34和L23为植物乳杆菌,S-5-6和ZX5L为唾液乳杆菌,LGchen和L1分别为格氏乳杆菌和戊糖片球菌。
2.2 LAB信号分子AI-2的表达
LAB群体感应信号分子AI-2具有保守性,利用指示菌BB170识别LAB产生的AI-2信号分子,LAB可诱导BB170荧光酶基因的表达,从而产生发光反应。依据文献[23]报道,LAB的AI-2表达最高值出现在稳定期初期或对数期末期,故采用培养18 h的LAB上清液进行测定。由图2可知,S-5-6、LGchen和ZX5产生信号分子AI-2的能力较强,而L23表达AI-2的能力较弱。结合表1 分析,推测LAB信号分子AI-2的表达可能与LAB的抑菌能力相关。AI-2作为LAB种间交流信号分子,受其QS系统的调控,影响LAB的多项重要生理功能。邵长林[24]发现粪肠球菌 V583在培养过程中孵育过量的信号分子 AI-2会降低其翻译、代谢、能量产生等15个相关蛋白的表达量,并促进生物膜的形成。杨杰[25]在培养植物乳杆菌 KLDS1.0391 时添加外源信号分子AI-2,发现菌体细菌素产量增加,并且不同添加量对细菌素的促进作用不同。宋刚等[26]研究发现,菌体释放的自诱导分子AI-2或者共培养环境中的某些特定菌株,能够激发LAB的群体感应系统,而LAB细菌素的产生受群体感应系统的调控,其合成量会提高,进而使得LAB对PA的抑菌能力提高。由此推测,LAB的AI-2表达能力会促进其抗菌能力,LAB的AI-2表达量高可能会增强其抑制PA的生长能力。
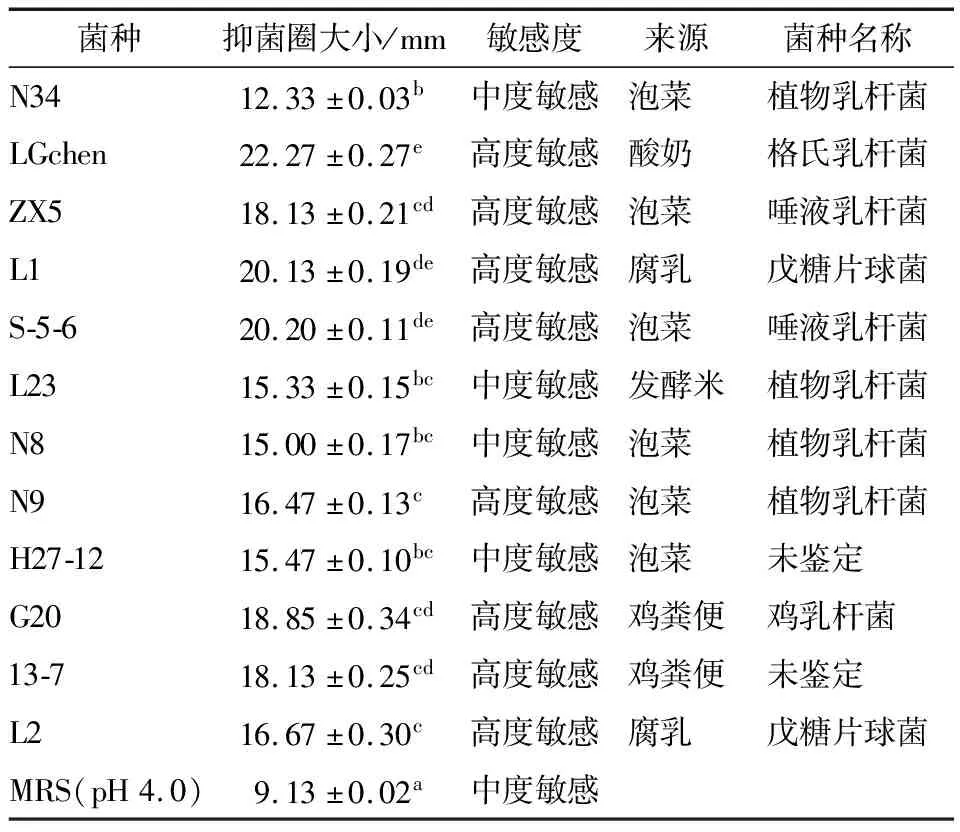
表1 LAB上清液对PA的抑菌效果†

字母不同表示差异性显著(P<0.05)
2.3 LAB上清液与PA共培养信号分子AI-2的表达
由图3可知,共培养物上清液的相对荧光强度有显著差异性(P<0.05),其中LGchen和L1对共培养的AI-2表达有明显的抑制作用,ZX5与S-5-6对共培养的AI-2表达影响不大,而N34和L23上调了共培养的AI-2表达。

字母不同表示差异性显著(P<0.05)
2.4 LAB对PYO表达的影响
由图4可知,6株LAB中LGchen、S-5-6和L23抑制绿脓菌素表达的效果显著(P<0.05),而菌株N34、L1上调了PA绿脓菌素的表达,ZX5对PA绿脓菌素的表达影响不大。PYO是PA一种重要的毒力因子,与PA的致病性和感染性都密切相关[27]。PYO是有活性的次级代谢物,可无阻碍穿透生物膜、打断呼吸链、产生大量的氧自由基和过氧化氢等导致细胞死亡[28]。抑制PYO的表达,在一定程度上可以抑制PA的生长,从而降低PA的毒性,抑制其感染。唐云鹏等[29]研究表明,不同浓度PYO对PA生长具有一定的促进作用。

字母不同表示差异性显著(P<0.05)
2.5 LAB对PA生物膜形成的影响
PA生物膜的形成与其耐药性产生有密切关系,生物膜可以阻止PA与抗菌药物直接接触,从而提高PA对抗菌药物的耐药性[30]。因此,去除病原菌的生物膜来抑制病原菌的生长与定植是一个非常好的防治病原菌感染的策略。由图5可知,6株LAB均能抑制PA的生物膜形成,但抑制率存在差异,其中,LGchen和S-5-6对PA生物膜形成的抑制率较好,N34的抑制效果较差;而ZX5、L1和L23的抑制效果相差不大,说明LAB可以通过抑制PA生物膜形成达到抗菌的目的。Srikanjana等[31]研究表明,LAB具有拮抗李斯特菌、沙门氏菌和金黄色葡萄球菌的作用,是因为LAB将其他致病菌的细胞膜破坏,从而使致病细胞萎缩或裂开从而达到抗菌作用。
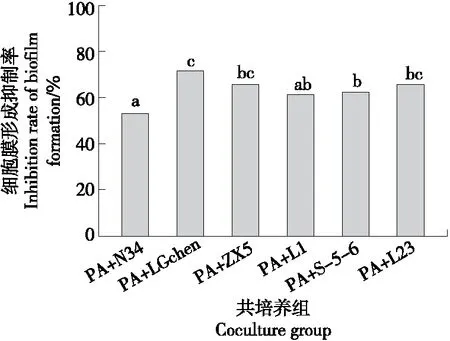
字母不同表示差异性显著(P<0.05)。
2.6 LAB拮抗PA的相关性分析
由表2可知,LAB的抑菌能力与LAB抑制PA生物膜形成能力及LAB的AI-2表达量呈正相关,说明LAB抑制能力越强,其抑制PA生物膜形成的能力越强,同时,LAB 的AI-2表达影响LAB抑菌能力。LAB抑菌能力与共培养物上清液AI-2表达量呈负相关,说明LAB的抑菌能力越强,PA的AI-2表达能力越弱。LAB的AI-2表达与共培养物上清液AI-2表达呈负相关,说明LAB表达AI-2能力越强,其抑制PA的AI-2表达能力越强。综上,LAB的抑菌性与其AI-2的表达、抑制PA生物膜形成及抑制PA的AI-2表达有关,但与PYO的表达无显著相关性。
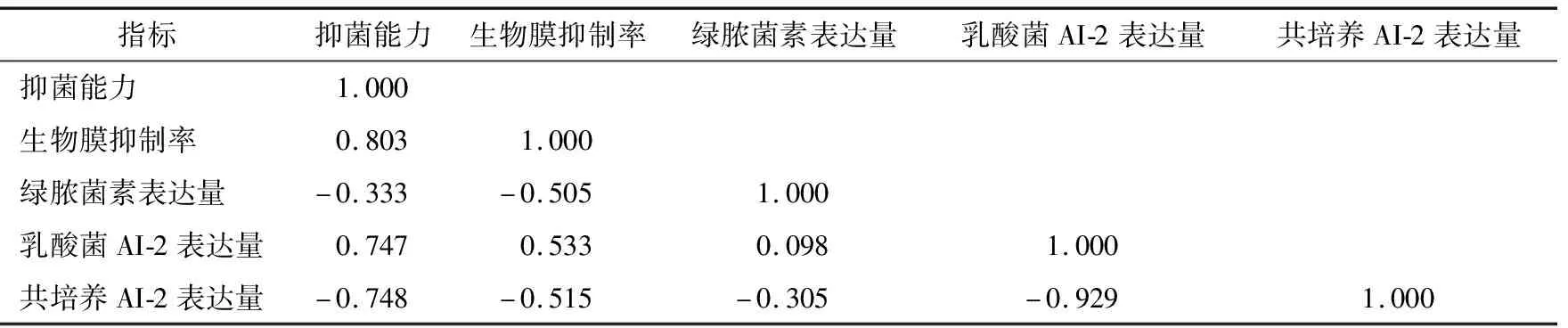
表2 皮尔森相关性分析
3 结论
试验筛选的植物乳杆菌N34和L23,唾液乳杆菌S-5-6和ZX5,格氏乳杆菌LGchen和戊糖片球菌L1可以拮抗铜绿假单胞菌感染,其抗菌机制与乳酸菌抑制铜绿假单胞菌生长,抑制铜绿假单胞菌生物膜形成,乳酸菌自身AI-2表达量以及抑制铜绿假单胞菌的AI-2表达量有关。其中,格氏乳杆菌LGchen和唾液乳杆菌S-5-6的整体抗菌效果比较显著,具有潜在商业应用的价值,后续将从代谢组学和转录组学进一步研究拮抗机制。
莫婷婷、张凤霞、陈政良、陈小珍等人参与该研究的试验数据测定,在此表示感谢!
