Daxx对γ射线诱导HeLa细胞凋亡的影响
2021-11-17唐双阳申海艳伍虹蓉廖雅琪熊雨棱
唐双阳 丁 霜 申海艳 伍虹蓉 胡 煜 廖雅琪 熊雨棱 李 乐
1(南华大学病原生物学研究所 特殊病原体防控湖南省重点实验室 衡阳 421001)
2(南华大学公共卫生学院 衡阳 421001)
3(南华大学衡阳医学院 衡阳 421001)
电离辐射能通过多种信号转导通路引发细胞损伤,促进细胞凋亡[1]。有研究报道,凋亡是放射线导致肿瘤细胞死亡的主要方式之一[2],肿瘤细胞对辐射的敏感性主要取决于辐射后细胞内的DNA损伤修复水平和辐射引发的信号转导机制,从而导致凋亡相关基因表达、细胞凋亡及细胞周期进程的改变。
人死亡结构域相关蛋白(hDaxx)是一种高度保守的多功能蛋白,能使受损DNA无法修复而使细胞发生凋亡[3-4],从而可能促进放射治疗后肿瘤细胞的凋亡。细胞凋亡是由Caspase-8诱导的一种“细胞自杀程序”,Caspase-8不会引起组织损伤,是死亡受体介导的凋亡途径的关键启动子。Daxx在影响细胞凋亡的作用机制方面尚未完全明确。Daxx作为HIF-1a/HDAC1/Slug轴介导癌细胞浸润的抑制子,有可能成为抑制癌症转移的一个潜在的治疗靶点[5]。
课题组前期研究表明,Daxx高表达可下调宫颈癌HeLa细胞中HPV16E6蛋白对Caspase-8的抑制作用,从而促进凋亡[6]。本研究选用HeLa细胞为研究对象,通过研究过表达Daxx对经γ射线照射细胞的凋亡的影响,探讨Daxx与辐射诱导细胞凋亡之间的关系及其机制,为开辟宫颈癌放射治疗新途径提供理论基础。
1 材料与方法
1.1 主要试剂
真核表达载体pcDNA3.1(+)/Daxx以及pcDNA3.1(+)-C1空载体由南华大学病原生物学研究所提供;改良eagle培养基(DMEM)购自Gibco公司(USA);MTT,LipofectamineTM2000购于Invitrogen公司(USA);鼠抗人Daxx单克隆抗体购自Santa Cruz公司(USA);Hoechst33342、Caspase-8活性测定试剂盒购自北京Solarbio公司;AnnexinV-FITC/PI细胞凋亡检测试剂盒购自上海联科生物公司。
1.2 细胞及细胞转染
人宫颈癌HeLa细胞株由南华大学病原生物学研究所提供。取对数生长期宫颈癌HeLa细胞,分别接种于6孔细胞培养板中,次日细胞生长至约75%时,将pcDNA3.1(+)/Daxx真核表达载体按照脂质体转染方法转染HeLa细胞,同时设pcDNA3.1(+)-C1空载体阴性转染组,加入含1%青霉素和1%链霉素的无血清细胞培养基,5%CO2、37℃培养6h,然后更换成含10%胎牛血清的DMEM细胞培养基,相同条件下继续培养,用于后续实验。通过转染将HeLa细胞分为正常对照组(NC组)、空质粒转染阴性对照组(Mock组)与Daxx真核表达载体转染组(Daxx组)。
1.3 电离辐射
使用137Cs γ射线生物细胞辐照仪照射细胞,剂量率为321cGy/min,剂量分别为0Gy、2Gy、4Gy和8Gy,照后培养0h、6h、12h和24h观察细胞形态。
1.4 Western blot检测Daxx蛋白表达
转染细胞培养24h后,分别给予0Gy、2Gy、4Gy、8Gy γ射线照射,12h后收获细胞,细胞裂解,BCA法测定蛋白浓度,上样20μg蛋白行SDS-PAGE聚丙烯酰胺凝胶电泳。使用凝胶成像系统拍照扫描显色条带,使用ImageJ灰度扫描软件分析光密度值,检测Daxx蛋白表达水平。
1.5 MTT检测细胞增殖
细胞培养24h后,给予4Gy γ射线照射,继续培养8h后弃上清液,每孔加200μL无血清培养基及20μL MTT,37℃孵育4h后弃上清液,每孔加入200μL二甲基亚砜,置涡旋振荡器上振荡裂解10min,使蓝色结晶溶解,酶标仪测定450nm吸光度值,计算细胞增殖抑制率(PI率),检测Daxx过表达对辐照后宫颈癌细胞增殖的影响。
1.6 ELISA检测Caspase-8相对活性
细胞培养24h后,给予4Gy γ射线照射,继续培养12h后,收集细胞并裂解,取上清液,经酶标仪测定样品。Caspase水解底物的pNA吸光度为样品A405减去空白对照A405。
1.7 流式细胞术检测细胞凋亡
将密度为5.0×105mL-1的细胞培养于含有盖玻片的24孔培养皿中24h,4Gy γ射线照射,继续培养6h,加入终浓度为10μg/mL的Hoechst33342,37℃孵育30min,固定封片,于荧光显微镜下观察。
培养转染细胞于CO2细胞培养箱中孵育24h后,给予4Gy吸收剂量照射,照射结束后继续培养6h,离心收集细胞,按照AnnexinV-FITC/PI细胞凋亡检测试剂盒说明书避光染色,使用流式细胞仪检测细胞凋亡。
1.8 统计学分析
使用SPSS19.0统计软件完成实验数据分析,采用GraphPad Prism5软件绘图,计量资料结果以(xˉ±s)表示,两组间样本均数比较采用t检验,多组间样本均数比较采用单因素方差分析,p<0.05表明差异有统计学意义。
2 结果
2.1 辐照细胞的形态观察
生物显微镜观察经0Gy、2Gy、4Gy和8Gy γ射线照射的宫颈癌细胞形态。辐照后6h各辐射组细胞均出现不同程度的形态异常,随着吸收剂量增加,细胞数量逐渐减少,部分细胞变圆,细胞间隙加大;随着照后时间的延长,各辐射组细胞数量逐渐减少、变形、皱缩,漂浮细胞逐渐增加;其中4Gy照射组在辐照后12h,出现少部分细胞皱缩、变形,8Gy组在辐照后12h,已少见正常形态细胞,大部分细胞皱缩、变形(图1)。

图1 显微镜观察辐照细胞形态Fig.1 Morphology of irradiated cells observed by microscope
2.2 辐照细胞中Daxx的表达
收取经0Gy、2Gy、4Gy和8Gy γ射线照射后12h的细胞,经Western blot检测细胞中Daxx的表达水平,Daxx表达水平随着吸收剂量增加而升高,4Gy组、8Gy组与0Gy组比较,差异均有统计学意义(p<0.05,p<0.01)(图2)。表明Daxx表达水平与吸收剂量相关。
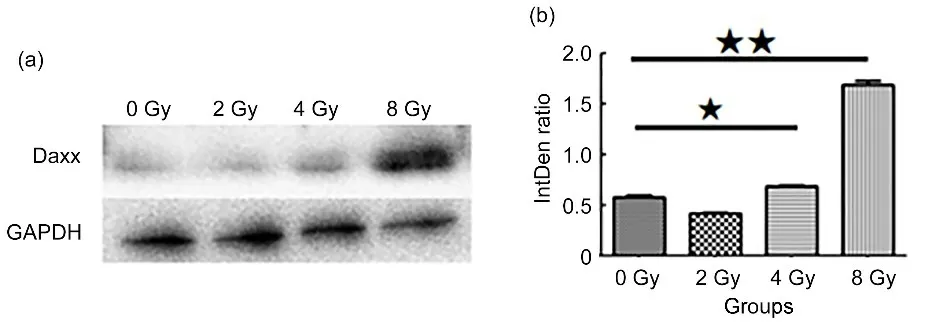
图2 辐照细胞中Daxx的表达:(a)各组的Western blot条带图;(b)各组的蛋白表达水平;★p<0.05,★★p<0.01Fig.2 Expression of Daxx protein in irradiated cells:(a)representative Western blot for protein expression;(b)densitometry analysis of protein levels;★p<0.05,★★p<0.01
2.3 Daxx对辐照细胞增殖的影响
MTT检测辐照12h后细胞的增殖情况,以未辐照组为对照,计算各实验组细胞增殖抑制率。转染Daxx的辐照细胞组明显高于其对应的未辐照组、空质粒辐照组以及正常细胞辐照组,差异均有统计学意义(p<0.01)(图3)。提示Daxx有利于辐照导致的细胞增殖抑制。

图3 MTT检测Daxx对辐照细胞的增殖抑制的影响;★★p<0.01Fig.3 Proliferation inhibition of Daxx protein on irradiated cells by MTT;★★p<0.01
2.4 Daxx对辐照细胞Caspase-8活性的影响
ELISA检测辐照后12h各组细胞的Caspase-8相对活性。转染Daxx的辐照组细胞的A405值明显高于其对应的未辐照细胞组、空质粒辐照组以及正常细胞辐照组,差异均有统计学意义(p<0.05)(图4)。提示Daxx能增强辐照细胞Caspase-8的相对活性。
2.5 Daxx对辐照细胞凋亡的影响
荧光显微镜观察辐照12h后细胞的凋亡。辐照组核固缩细胞的比例高于未辐照组,其中转染Daxx的辐照组核固缩细胞最高(图5)。

图5 荧光显微镜观察辐照细胞凋亡形态Fig.5 Apoptotic morphology of irradiated cells observed by fluorescence microscope
流式细胞术检测发现,转染Daxx的辐照组的细胞凋亡率明显高于其对应的未辐照组、空质粒辐照组以及正常细胞辐照组,差异均有统计学意义(p<0.05)(图6)。提示Daxx参与辐照细胞的凋亡。

图6 流式细胞术检测Daxx对辐照细胞凋亡的影响:(a)各组的代表性流式细胞图;(b)各组的凋亡率;★p<0.05Fig.6 Daxx protein on apoptosis of irradiated cells detected by flow cytometry:(a)representative flow cytometry data;(b)apoptotic rate;★p<0.05
3 讨论与结论
放射治疗已经成为治疗宫颈癌的主要手段之一,约80%的宫颈癌患者接受单独或联合的放射治疗,尤其对不能手术的Ⅱ期以下或晚期宫颈癌患者,可取得较为理想的效果。Daxx在细胞中的不同表达情况有可能导致细胞的生长与凋亡不同。有研究认为,Daxx在胰腺神经内分泌肿瘤组织病变中出现基因突变[7]或表达缺失[8];在泌尿道上皮组织癌细胞中,Daxx的分布区域及其核分布区域的大小都有变化[9];食管鳞癌组织内Daxx的定位和表达与临床患者的生存指数密切相关[10]。
本研究结果显示:Daxx表达水平随着吸收剂量增加而升高,由此推测Daxx参与细胞中辐照引发某些生物学效应;而过表达Daxx能明显上调辐照细胞的Caspase-8活性,促进细胞凋亡。有研究表明:增强Caspase-8与Fas-Daxx之间的相互作用能促进细胞凋亡[11]。Caspase-8是Fas/FasL系统的重要效应子。经典的Fas诱导的细胞凋亡途径是Fas受体通过FADD-Caspase-8通路及其下游的Caspase家族成员而实现的。因为FADD(Fas相关死亡结构域)能够与Caspase-8(或-10)前体蛋白结合形成死亡诱导信号复合物(DISC),激活Caspase-8(或-10),进一步激活Caspase级联,导致细胞凋亡[12],故Daxx通过与Fas受体结合,激活级联酶,诱导细胞凋亡[13]。有研究表明:在辐射条件下,γ干扰素诱导的溶酶体巯基还原酶(GILT)可通过上调Daxx表达而抑制盒配对基因3,从而诱导自噬,增加人黑色素瘤细胞死亡[14]。Daxx对0.7Gy电离辐射诱导的肿瘤也具有抑制作用[4]。高表达果蝇的Daxx样蛋白,能有效通过Daxx-ASK1-JNK途径诱导凋亡,而该蛋白的缺失增强了对氧化应激以及UV照射的抵抗作用[15]。然而,也有研究认为,在卵巢癌细胞中过表达Daxx能保护癌细胞免受X射线以及化疗诱导的DNA损伤,促进癌细胞增殖,增强癌细胞对放疗与化疗等的抵抗性[16]。
综上所述,在宫颈癌HeLa细胞中,Daxx能够促进经γ射线照射的细胞凋亡,其作用机制可能是在辐照细胞内,Daxx通过正反馈Caspase-8活性,从而抑制细胞增殖,促进细胞凋亡,具体的作用机制还有待进一步研究。
