常氧及低氧条件下SHG-44胶质瘤细胞中活性氧及低氧诱导因子-1α的表达及意义
2021-11-16谢江涛冯乐宵王世锋刘振锋李云翔
谢江涛,冯乐宵,王世锋,刘振锋,李云翔
(1.咸阳市中心医院神经外科,陕西 咸阳712000;2.乾县人民医院神经外科,陕西 乾县713300)
胶质瘤是颅内最常见的原发性恶性肿瘤,胶质瘤瘤体的快速生长和增殖需要消耗大量氧气,因此瘤体处于一种相对低氧的状态,在这种低氧条件下低氧诱导因子-1α(Hypoxia inducible factor-1α,HIF-1α)表达增高,从目前的研究得知HIF-1α应对低氧微环境时,能调节多种涉及低氧应激下细胞适应和存活的靶基因,增加其转录活性并表达相应的产物以适应低氧应激反应[1]。HIF-1α的表达受到了诸多因素的影响,因此对HIF-1α的调控成为胶质瘤适应低氧微环境的核心点。活性氧(Reactive oxygen species,ROS)就有可能是影响HIF-1α表达的因素之一,但相关机制仍不清楚。本实验拟于常氧(常规培养箱)及低氧(氯化钴化学低氧法)条件下培养SHG-44胶质瘤细胞并应用抗氧化剂N-乙酰半胱氨酸(N-acetylcysteine,NAC)研究ROS对HIF-1α表达水平的调节,为进一步研究低氧条件下胶质瘤的生物学行为及治疗靶点提供新思路。
1 材料与方法
1.1 实验材料 胶质瘤SHG-44瘤株购于中国科学院上海细胞研究所,NAC、氯化钴(CoCl2)均购于Sigma公司,ROS检测试剂盒购于碧云天公司,HIF-1α引物设计由Primer 5.0软件完成,引物合成由北京三博远志生物技术有限公司合成,RNA提取试剂盒、RT-PCR检测全套试剂盒购于Fermentas公司。5% CO2培养箱(型号THERMO371),流式细胞分析仪(美国BD FACSCalibur,型号DICKIN SON),多重实时荧光定量PCR仪(型号Bio-Rad iQTM5)等。
1.2 实验方法
1.2.1 细胞系培养与传代:SHG-44胶质瘤细胞采用含10%小牛血清的DMEM培养液,在 37 ℃,5% CO2培养箱中培养,48 h后传代(1∶2)。
1.2.2 CoCl2化学法模拟低氧:5% CO2细胞培养箱常规培养SHG-44瘤株的基础上在DMEM细胞培养液中加入CoCl2溶液(终浓度150 μmol/L共培养24 h),阻断细胞中氧信号的转导,模拟低氧信号。
1.2.3 实验分组:常氧对照组,常氧条件下培养SHG-44胶质瘤细胞;常氧NAC干预组,常氧条件下培养SHG-44胶质瘤细胞+NAC;低氧对照组,CoCl2化学法模拟低氧条件培养SHG-44胶质瘤细胞;低氧NAC干预组,CoCl2低氧法培养SHG-44胶质瘤细胞+NAC。
1.2.4 MTT法检测CoCl2化学法模拟低氧环境后细胞增殖情况:取对数生长期的SHG-44 胶质瘤细胞,制成4×104细胞/ml细胞悬液,接种于96孔板,每孔100 μl(设5个复孔),每孔添加100 μl CoCl2溶液,并使各孔终浓度为150 μmol/L。培养24 h后检测OD值。
1.2.5 按预设实验分组加入CoCl2和(或)NAC:四组每组一块6孔板,一块Double well双孔玻片。取处于对数生长期的SHG-44胶质瘤细胞,制成4×104细胞/ml细胞悬液,接种于6孔板,每孔3 ml,低氧对照组及低氧NAC干预组次日每孔补加1 ml含CoCl2DMEM培养液(600 μmol/L),使CoCl2终浓度为150 μmol/L;常氧对照组及常氧NAC干预组次日每孔补加1 ml DMEM培养液。同时稀释细胞悬液为2×104细胞/ml,接种于Double well双孔玻片,每孔200 μl,低氧对照组及低氧NAC干预组次日小心吸弃上清,并补加200 μl含氯化钴DMEM培养液(150 μmol/L),常氧对照组及常氧NAC干预组次日小心吸弃上清,并补加DMEM培养液200 μl,继续培养24 h后常氧NAC干预组和低氧NAC干预组各孔加入活性氧的抑制剂NAC(终浓度为10 mmol/L),各组继续培养48 h。
1.2.6 各组细胞ROS表达检测:配制荧光探针DCFH-DA,取DCFH-DA(10 mmol/L)5 μl加入5 ml无血清DMEM培养基中(1∶1000),四组六孔板到达培养时间后,每孔加入500 μl荧光探针DCFH-DA(1∶1000),混匀后继续放入37 ℃细胞培养箱内孵育20 min,以使DCFH-DA进入细胞后被细胞内的ROS氧化为有荧光的DCF。使用流式细胞仪检测DCF的荧光(488 nm激发波长,525 nm发射波长)以检测胞内ROS的水平。
1.2.7 各组细胞HIF-1α mRNA表达检测:四组六孔板到达培养时间后转入1.5 ml EP管中(冰浴中完成),RNA提取试剂盒(RNAfast 200)快速抽提RNA。取抽提的总RNA 5 μl,mRNA反转录合成cDNA,再以逆转录反应液(cDNA)1 μl作为模板进行扩增反应,其中引物设计,见表1。RT-PCR 反应条件为:50 ℃、2 min 1个循环,95 ℃、10 min 1个循环,变性 95 ℃、15 s,退火 60 ℃、30 s,延伸 72 ℃、30 s,共40个循环。设定反应条件后置于多重实时荧光定量PCR仪(Bio-Rad iQTM5)中进行反应,到时间中止反应后分析实验数据,计算目的基因的相对变化量。目的基因的相对变化量2-△△CT=2-(实验组目的基因-实验组参照基因)/(对照组目的基因—对照组参照基因)。
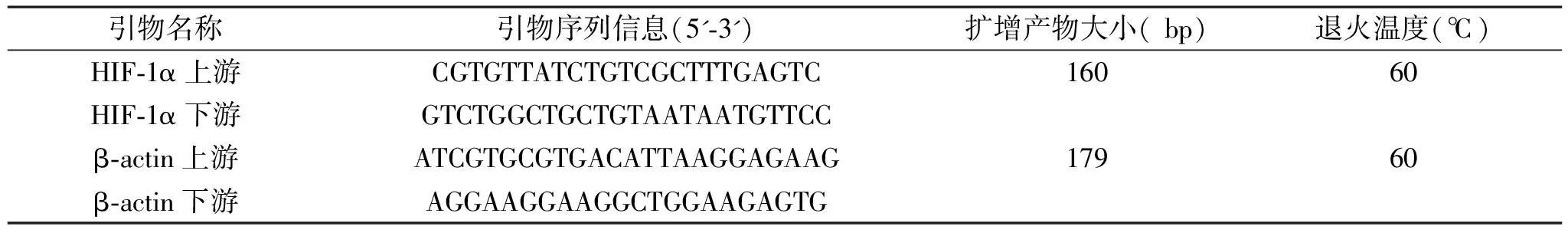
表1 HIF-1α及β-actin引物序列
1.3 统计学方法 应用SPSS 13.0统计学软件分析实验数据,各组数据之间应用方差分析进行比较(数据经方差齐性检验符合方差齐性),P<0.05表示差异有统计学意义。
2 结 果
2.1 MTT法检测CoCl2化学法模拟低氧环境后细胞增殖情况 常氧组随着NAC浓度梯度增大,NAC在0~5 mmol/L浓度,细胞的吸光度(OD值)升高(均P<0.05),而浓度增大至10、15 mmol/L时细胞的吸光度(OD值)下降(均P<0.05);然而0 mmol/L组与10 mmol/L组之间比较无统计学差异(P>0.05)。低氧组随着NAC浓度梯度增大,NAC在0~5 mmol/L浓度,细胞的吸光度(OD值)无明显变化(均P>0.05),而浓度增大至10 mmol/L及15 mmol/L细胞的吸光度(OD值)明显下降(均P<0.05)。提示低氧条件下NAC在一定浓度范围内对细胞活力没有太大影响,但在较大浓度时(>10 mmol/L)则对细胞活力影响较大。见表2。
表2 常氧及低氧组不同浓度NAC作用后细胞增殖OD值
2.2 各组细胞ROS表达情况比较 常氧对照组ROS表达低于低氧对照组(P<0.05),常氧NAC干预组ROS表达低于常氧对照组(P<0.05),低氧NAC干预组ROS表达低于低氧对照组(P<0.05)。结果提示低氧条件下培养胶质瘤细胞ROS表达水平明显高于常氧条件培养胶质瘤细胞,而且应用ROS的干预剂NAC后可明显降低常氧及低氧培养条件下的ROS表达。见表3。
表3 各组细胞ROS表达情况比较
2.3 各组细胞HIF-1α mRNA表达情况比较 低氧组HIF-1α mRNA表达高于常氧组(均P<0.05),低氧组HIF-1α mRNA表达高于常氧NAC干预组及低氧NAC干预组(均P<0.05)。常氧组HIF-1α mRNA表达与常氧NAC干预组及低氧NAC干预组比较均无统计学差异(均P>0.05),低氧NAC干预组HIF-1α mRNA表达与常氧NAC干预组比较无统计学差异(P>0.05)。见表4。
表4 各组HIF-1α mRNA相对表达量比较
3 讨 论
HIF-1α是Wang 和Semenza于1992年从缺氧的Hep-3细胞核中首次提取分离出缺氧诱生的并具有DNA结合活性的一种转录因子,肿瘤的恶性增殖使其组织内耗氧及血管形成不全,导致微环境含氧量不足,使肿瘤各区域处于不同的低氧微环境中[2]。HIF-1α应对低氧微环境时,能调节多种涉及低氧应激下细胞适应和存活的靶基因,增加其转录活性并表达相应的产物以适应低氧应激反应[3-4]。
从目前的研究得知HIF-1β持续性稳定表达于胞质中,不受缺氧及其他因素的调节和干扰,对HIF-1α的调控分为HIF-1α降解水平的调节和影响HIF-1α转录水平的调节[5-6]。HIF-1α降解水平的调节目前研究的相对较多,尤其是pHDs-pVHL——泛素化蛋白水解酶降解途径研究的比较透彻了[7],此外还有一些其他降解途经,例如OS-9[8-9]促进脯氨酸羟化酶诱发的依赖pVHL的泛素化蛋白水解酶降解途径。而关于影响HIF-1α转录水平的调节目前相关报道较少,Steffen等[10]发现GSK3β通过抑制HIF-1α的转录起始因子eIF2B,使HIF-1α的mRNA表达水平降低,GSK3β的抑制剂靛玉红可明显提高HIF-1α mRNA表达水平。
本研究中低氧条件下培养胶质瘤细胞ROS表达水平明显高于常氧条件培养胶质瘤细胞,而且应用ROS的干预剂NAC后可明显降低常氧及低氧培养条件下的ROS表达。而Alex等[11]也认为肿瘤细胞内ROS升高可能是一种参与调控HIF-1α的重要因素。ROS可能作为一种特殊的第二信使参与信号转导及影响基因的转录活性,启动多种细胞生物学效应[12-13]。ROS是线粒体的电子转运链在运氧过程中电子遗漏,基态氧通过转运链时接受漏出的电子变为ROS,肿瘤组织因生长失控,其内部处于一种相对低氧的状态,因此线粒体有氧呼吸电子转运链有可能因受阻而产生ROS[14-15]。因此可以得出SHG-44胶质瘤细胞于低氧条件下培养时ROS表达水平明显高于常氧条件培养,然而给予抗氧化剂NAC之后两组ROS表达水平均明显下降。
本次试验中低氧条件下HIF-1α mRNA表达水平高于常氧条件下,但是应用抗氧化剂NAC后HIF-1α mRNA表达下降。而Koshikawa等[16]的研究也指出ROS可能通过激活PI3K-PKB/Akt通路进而影响HIF-1α的表达。PI3K-PKB/Akt通路并非直接调节HIF-1α的表达和稳定性,它有很多的下游调节靶点,可以间接调节HIF-1α的表达。mTOR可通过改变翻译调节因子真核细胞启动因子4E结合蛋白 (4E-BP1)和核糖体p70S6激酶1(p70S6K1)的磷酸化状态启动HIF-1α翻译过程,而HIF-1α的一种下游靶基因产物REDD1却可以抑制mTOR的活性,从而下调HIF-1α的表达水平,这也是HIF-1α自身的一种负反馈调节机制[17]。Brooke等[18]认为低氧条件下p38MAPK的激活有赖于线粒体产生的ROS,ROS可以使MAPK的上游激酶(MAPKKK)的丝氨酸和苏氨酸位点的磷酸化进而激活p38MAPK信号通路[19-20]。因此也可以推断出这样一个结论,即抗氧化剂NAC可使胶质瘤细胞中HIF-1α mRNA表达下降,进而可使HIF-1α生成减少,使得胶质瘤细胞适应低氧应激反应的能力下降,可以起到抑制胶质瘤细胞生长的作用。
本研究明确了胶质瘤细胞在低氧条件下ROS表达水平及HIF-1α mRNA表达水平明显高于常氧条件,但是应用ROS干预剂NAC之后低氧条件下SHG-44胶质瘤细胞中HIF-1α mRNA表达下降,提示ROS在促进HIF-1α mRNA表达中起某种重要作用,而抗氧化剂NAC可阻断这种作用,因此也提示在脑胶质瘤的其他辅助治疗中抗氧化剂也可以起到抑制胶质瘤细胞生长的作用,这为进一步研究抗氧化剂在胶质瘤辅助治疗中的应用提供了新的思路。
