lncRNA-p23154通过miR-375/KLF4途径对SKOV3细胞增殖、侵袭的影响
2021-11-16栾丽霞
洪 甲,杨 洋,栾丽霞
(1.西安国际医学中心医院产科,陕西 西安 710100;2.西安医学院第一附医院妇科,陕西 西安 710077)
卵巢癌(Ovarian cancer,OC)作为妇科常见肿瘤可发生于任何年龄,具有较高的致死率[1]。其中,卵巢上皮性癌(Epithelial ovarian cancer)是最常见的卵巢癌病理类型,其发生比例可高达85%~90%,但目前,该类种肿瘤发病机制不清。相关研究[2]认为肿瘤相关基因突变、失活、过表达,以及遗传等相关因素是该疾病的潜在发生机制。在诸多致病因素中,包括长链非编码RNA(long non-coding RNA,lncRNA)、微小RNA (microRNA,miRNA)在内的多种非编码RNA(non-coding RNAs,ncRNA)是目前的研究热点,已有多个ncRNA被发现参与了卵巢癌等多种妇科恶性肿瘤的疾病过程[3-4]。lncRNA通过与miRNA协同,构成调控关系网路,在诸多生理过程中发挥重要作用[5-6]。有研究[7]发现,lncRNA-p23154可通过调控细胞糖酵解、侵袭转移及化疗敏感性等方式,参与肿瘤发生发展;并且lncRNA-p23154在口腔鳞癌细胞中可以通过对miR-375发挥竞争性内源RNA (competing endogenous RNA,ceRNA )作用,影响口腔鳞癌细胞增殖[8];而miR-375与卵巢癌发病直接相关[9],其能够通过靶向调控KLF4,抑制直肠癌细胞增殖功能[10]。因此,本研究在上述发现的基础上,对lncRNA-p23154能否通过调节miR-375/KLF4通路,影响卵巢癌细胞功能,参与疾病发病过程进行了探索。
1 材料和方法
1.1 实验材料 人卵巢癌细胞株SKOV3购自中国科学院细胞库,RPMI-1640培养基、胎牛血清(FBS)购自美国Gibco公司,Lipofectamine2000试剂盒购自美国Invitrogen公司,转染质粒购自中国上海吉玛公司,Trizol试剂盒购自美国Invitrogen公司,反转录试剂盒购自美国Invitrogen公司,SYBR Premix Ex Taq试剂盒购自美国Invitrogen公司,BCA法蛋白定量试剂盒购自美国Gibco公司,CCK-8测定试剂盒购自中国碧云天公司,SDS裂解液购自美国Gibco公司,Tanswell小室购自美国BD公司,Matrigel胶购自美国BD公司,所有抗体购自英国Abcam公司。
1.2 实验方法
1.2.1 细胞培养与转染:将SKOV3细胞接种培养于含10%胎牛血清的RPMI 1640培养基中,并置于37 ℃、5%CO2培养箱中培养;按照Lipofectamine2000试剂盒说明书步骤,取对数生长期细胞接种于96孔板中进行转染实验。实验共分三组:过表达组(转染pcDNA3.1-p23154质粒)、抑制组(转染siRNA-p23154抑制序列)、对照组(转染空质粒),转染后24 h进行后续实验。每组重复3次。
1.2.2 qRT-PCR检测lncRNA-p23154转染效率及各组细胞中miR-375、KLF4 mRNA表达水平:按照Trizol试剂盒说明步骤分别提取1.2.1中三组转染细胞总RNA,并检测RNA质量。按反转录试剂盒说明书步骤,反转录合成lncRNA-p23154、miR-375及KLF4 cDNA。分别以U6、β-actin为内参,按照SYBR Premix Ex Taq试剂盒说明行实时定量PCR反应。目的基因引物序列由中国上海吉玛公司合成生产,具体序列及PCR反应条件,见表1。采用2-△△Ct法计算目的基因的相对表达量。每次检测设定3个复孔,每个样本重复3次。

表1 目的基因引物序列及PCR反应条件
1.2.3 Western blot检测各组细胞中KLF4蛋白表达水平:按照SDS裂解液说明分别提取1.2.1中三组转染细胞总蛋白,BCA法测定蛋白质浓度,上样后凝胶电泳、分离等量蛋白质,转膜至聚偏二氟乙烯膜(PVDF),5%脱脂奶粉液室温封闭1 h后,4 ℃冰箱中将PVDF膜加入鼠抗人KLF4(1∶1500)、鼠抗人GAPDH(1∶1500)单克隆抗体孵育液中过夜;洗膜后,加HRP标记二抗(1∶2000)室温下孵育1 h,使用化学发光检测系统显影并记录印迹条带,以KLF4/GAPDH比值计算目的蛋白表达量。每次检测设定3个复孔,每个样本重复3次。
1.2.4 CCK8法检测SKOV3细胞增殖能力:按照CCK-8测定试剂盒说明步骤,检测转染后各组SKOV3细胞增殖能力。取1.2.1中三组对数生长期细胞,调整细胞密度至4×105个,接种于96孔细胞培养板中,CCK-8溶液孵育,酶标仪检测并记录分组培养0、24、48、72 h时490 nm OD值。每次检测设定3个复孔,每个样本重复3次。
1.2.5 Transwell检测SKOV3细胞侵袭能力:将转染后的各组SKOV3细胞消化后使用不含胎牛血清的1640培养基重悬,并接种于涂有Matrigel胶的Transwell(8 μm)的上室中,下室加入含10%胎牛血清的1640培养基,培养24 h后,用70%乙醇固定侵入小室的细胞,并用0.1%结晶紫染色,再次洗涤后,于光学显微镜下随机选择5个区域计数侵入细胞的数目。每组重复3次。
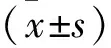
2 结 果
2.1 各组细胞转染后lncRNA-p23154、miR-375、KLF4 mRNA及KLF4蛋白表达量比较 细胞转染后,qRT-PCR检测结果显示,与对照组相比,lncRNA-p23154在过表达组SKOV3细胞中表达水平增高、在抑制组中表达水平降低(均P<0.05),表明细胞转染成功。qRT-PCR检测结果提示,在SKOV3细胞中过表达与抑制lncRNA-p23154效果显著(均P<0.05);与对照组和抑制组相比,过表达组SKOV3细胞中miR-375表达降低,KLF4表达均升高(均P<0.05);Western blot结果显示,与抑制组相比,过表达组SKOV3细胞中KLF4在蛋白水平表达升高(P<0.05)。见表2。
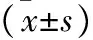
表2 各组细胞转染后lncRNA-p23154、miR-375、KLF4 mRNA、KLF4蛋白表达量比较
2.2 lncRNA-p23154对SKOV3细胞增殖能力的影响 CCK8 法检测结果显示,与对照组及过表达组SKOV3细胞在24、48、72 h时间点比较,抑制组SKOV3细胞增殖能力升高(均P<0.05),见表3。
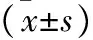
表3 各组SKOV3细胞转染后不同时间的OD值
2.3 lncRNA-p23154对SKOV3侵袭能力的影响 Transwell结果显示,与对照组及过表达组SKOV3细胞相比,抑制组SKOV3细胞侵袭能力升高,差异有统计学意义(P<0.01),见表4(图1)。

表4 各组细胞侵袭能力比较 [细胞数(个)]

图1 Transwell检测各组细胞侵袭情况(结晶紫染色,×200)
3 讨 论
卵巢癌作为威胁女性健康的恶性疾病,早期确诊率低,中晚期致死率高、患者预后不佳[11]。多数患者确诊后单纯手术治疗效果不佳,反复多次化疗,极易产生耐药,最终导致生存率不高[12-13],为社会及患者家庭带来了多方面的负担。因此,进一步探究卵巢癌发病机制,寻找新的诊断及治疗靶点尤为重要。卵巢癌病因复杂,现有诸多研究[3,14]明确了不同病理学类型的卵巢癌组织中差异表达的miRNA、lncRNA等,能够通过上游路径调控卵巢癌疾病相关因子,参与卵巢癌发病过程;例如lncRNA-HOTAIR在卵巢癌组织中病理性高表达,并能够进一步通过促进miR-206表达,发挥其抑癌作用[15]。而Wang等[7]发现,lncRNA-p23154在口腔鳞癌发病过程中的相关机制,其能够影响肿瘤细胞功能,参与疾病过程;并且lncRNA-p23154与卵巢癌相关miR-375之间具有调控关系[8]。以上提示,lncRNA-p23154具有参与诸如卵巢癌等其他妇科恶性肿瘤疾病的可能。因此,本研究选取lncRNA-p23154作为研究因子。
非编码RNA在生物医学领域内的重要作用可见一斑,lncRNA虽不能直接编码蛋白质,但其通过与miRNA之间的调控关系[16],共同参与了多种生理病理过程。在口腔鳞癌细胞中lncRNA-p23154与miR-375之间的负向调控关系已得到验证[8],p23154能够通过对miR-375发挥ceRNA作用,间接影响口腔鳞癌细胞相关功能。而本研究中,我们发现在SKOV3细胞中过表达与抑制lncRNA-p23154效果显著,并且在特异性的过表达与抑制lncRNA-p23154后,各组SKOV3细胞中miR-375表达同时出现了被负性调控影响的趋势。
miR-375不仅在卵巢恶性肿瘤组织中高表达,并且还在该类型患者外泌体中稳定存在[9]。miR-375能够负性调控KLF4,影响直肠癌细胞[10]、前列腺癌细胞的增殖及侵袭能力[17]。在初步明确lncRNA-p23154与卵巢癌可能具有相关性的基础上,我们通过细胞增殖、侵袭能力检测,发现抑制p23154后SKOV3细胞增殖及侵袭能力均增强;p23154表达增强后,miR-375的靶基因KLF4在mRNA及蛋白水平均升高。KLF4作为锌指蛋白成员,能够通过直接或间接、单独或协同的方式,影响细胞增殖、分化相关基因,从而参与细胞周期G1/S等过程的调控,与细胞增殖、侵袭功能相关[18]。在宫颈癌中,KLF4与癌细胞生殖、疾病转移均有相关性[19]。另外,KLF4与miR-375在3’UTR端具有互补结合的种子序列,两者间具有负性调控关系;在子宫内膜异位症相关性卵巢肿瘤中,KLF4低表达[20];在卵巢癌中,其能够发挥抑癌作用,抑制肿瘤细胞增殖和侵袭[18]。
因此,lncRNA-p23154与miR-375-KLF4构成的调控网络在卵巢癌发病过程中可能起到的重要作用。结合本研究中实验结果,提示:lncRNA-p23154能够特异性结合miR-375,通过充当竞争性内源性RNA,在其高表达时负性调控,即抑制了miR-375表达;因此,继而间接影响了miR-375对其靶基因KLF4的负性调控过程;当SKOV3细胞中KLF4表达受到抑制时,细胞增殖、侵袭能力增强。
综上,lncRNA-p23154与卵巢上皮性癌相关,其可能通过miR-375/KLF4途径,影响SKOV3细胞增殖、侵袭;但具体的调控机制和作用靶点仍需后续研究进一步明确。通过本研究,为探寻卵巢癌发病机制及潜在的疾病预测诊断靶点提供了一定理论依据。
