姜黄素@普朗尼克纳米胶束抑制前列腺癌PC-3细胞生长实验研究
2021-11-16王志刚董青川
程 继,王志刚,付 国,董青川
(陕西省人民医院泌尿外科,陕西 西安 710068)
前列腺癌(Prostate cancer)是常见的恶性肿瘤,发病率和病死率均呈逐年上升趋势,手术切除、放疗和化疗是目前常用的临床治疗手段[1-2]。但常规化疗药物和放射治疗引起的不良反应,严重影响了患者术后的康复和生活质量[3-5]。姜黄素(Curcumin)是从姜黄、郁金等姜科植物中提取的一种多酚类物质,具有抗肿瘤、抗氧化、抗炎等多种药理作用[6]。研究[7-8]发现,姜黄素的水溶性差、难吸收、易降解,导致其生物利用度低,限制了临床的进一步应用。因此,制备姜黄素的脂质体、胶束等纳米微粒,有望提高姜黄素的生物利用度,对于临床姜黄素的广泛应用具有重要的指导意义。普朗尼克(Pluronic)是由聚氧乙烯(PEO)、聚氧丙烯(PPO)聚合而成的两亲性三嵌段共聚物,可自组装形成胶束,具有良好的生物相容性[9-11]。本实验以姜黄素为研究对象,选择Pluronic-P123为载体材料,包裹姜黄素制备胶束,评价姜黄素@普朗尼克胶束的理化性质及对前列腺癌PC-3细胞的体内外抗肿瘤活性,通过构建高效的递药系统,改善姜黄素生物利用度,为临床前列腺癌的化疗提供新的策略和实验依据。
1 材料与方法
1.1 实验材料 二氧化碳培养箱购自中国上海力申公司;倒置显微镜购自日本Olympus公司;激光粒度仪购自英国Malvern公司;透射电镜购自日本Olympus公司。人前列腺癌PC-3细胞株购自美国ATCC公司;Pluronic-P123购自德国BASF公司;裸鼠购自湖南斯莱克景达实验动物有限公司;姜黄素购自美国Sigma公司;DMEM培养液和胎牛血清均购自美国Invitrogen公司。
1.2 姜黄素@普朗尼克胶束的制备 通过溶剂挥发法制备姜黄素载药胶束:姜黄素150 mg,溶于三氯甲烷,再加入三乙胺(姜黄素∶三乙胺=1∶3,摩尔比),磁力搅拌器避光搅拌4 h;再加入5 g Pluronic-P123和100 ml蒸馏水,超声分散均匀,室温下避光继续搅拌2 h,旋转蒸发仪中去除有机溶剂,真空干燥过夜,得到的胶束溶液通过0.8 μm滤膜过滤,冷冻干燥即得姜黄素@普朗尼克载药胶束。通过激光粒度仪测定姜黄素@普朗尼克载药胶束的粒径分布,透射电镜观察载药胶束形态。
1.3 姜黄素@普朗尼克胶束的载药量和包封率 称取50 mg姜黄素@普朗尼克载药胶束冻干粉末,溶于无水乙醇,水浴超声10 min,通过高效液相色谱(HPLC)检测姜黄素含量,按下式计算载药量和包封率。HPLC检测条件为:色谱柱(C18,250 mm×4.6 mm,5 μm,Diamonsil),流动相组成为0.01 mol/L甲醇∶醋酸钠∶冰醋酸(70∶29∶1),流速1 ml/min,进样量20 μl,柱温25 ℃。载药量=(姜黄素在载药胶束中的量/载药胶束量)×100%。包封率=(姜黄素在载药胶束中的量/姜黄素投药量)×100%。
1.4 姜黄素@普朗尼克胶束体外释药性研究 姜黄素@普朗尼克胶束(2 mg/ml,姜黄素浓度)溶于磷酸盐缓冲液(pH7.4)中,置于透析袋中,将透析袋置于200 mlPBS中,37 °C孵育72 h,选择不同的时间点,于 0.5、1、2、4、6、8、12、24、48、72 h分别取样20 μl,每次取样后立即补充等体积PBS,HPLC检测姜黄素@普朗尼克胶束体外释药性能,检测方法同1.3。
1.5 细胞毒性试验 常规培养人前列腺癌PC-3细胞,接种于96孔培养板,密度为5×103/孔,分别给予0.5、1、5、10、50、100 μmol/L(姜黄素浓度)的姜黄素、姜黄素@普朗尼克胶束及P123空白胶束处理。48 h后收集细胞,加入5 mg/ml的MTT 20 μl,37 °C孵箱放置4 h,弃去上清液,PBS冲洗3次,每孔加入150 μl 二甲基亚砜(DMSO),振荡溶解,酶标仪测定吸光度(570 nm),观察细胞存活情况,计算IC50,评价姜黄素@普朗尼克胶束对PC-3细胞增殖的影响。
1.6 PC-3细胞对载药胶束的摄取 取对数生长期的前列腺癌PC-3细胞接种于6孔板中,细胞接种密度为 1×105个/孔,培养过夜后加入10 μmol/L(姜黄素浓度)的姜黄素和载药胶束,分别孵育0.5、2、8 h后吸去培养液,PBS冲洗3次,胰酶消化细胞,离心提取后,通过高效液相色谱(HPLC)法分析细胞对药物的摄取。
1.7 载药胶束的体内抗肿瘤活性 取对数生长期的前列腺癌PC-3细胞悬液(1×107),裸鼠皮下注射肿瘤细胞,建立PC-3荷瘤模型,观察接种部位变化,至肿瘤体积生长至100 mm×100 mm×100 mm后,随机分为模型组、姜黄素组、姜黄素@普朗尼克胶束组,分别静脉注射生理盐水、姜黄素和姜黄素@普朗尼克胶束(5 mg/kg),每4 d给药1次,给药5次。每两天记录裸鼠体重并用游标卡尺测量记录肿瘤体积和裸鼠体重。治疗结束后,处死动物,剥离肿瘤组织,称重并计算肿瘤生长抑制率。肿瘤体积计算公式为:V=L(长)×W(宽)2/2。肿瘤生长抑制率(%)=(1-给药组肿瘤重量/生理盐水组肿瘤重量)×100%。
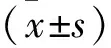
2 结 果
2.1 胶束的表征 溶剂挥发法制备得到的胶束为胶体微粒分散系统,该姜黄素@普朗尼克胶束的平均粒径为322 nm,呈圆球状(图1、2)。通过HPLC检测姜黄素含量,计算姜黄素@普朗尼克胶束的载药量为(15.7±0.3)%和包封率为(89.4±1.2)%。

图1 姜黄素@普朗尼克胶束电镜图(×20 000)
2.2 胶束的体外释药性能 通过HPLC法检测姜黄素@普朗尼克胶束在磷酸盐缓冲液(pH7.4)中的释药性能,结果显示构建的姜黄素@普朗尼克胶束具有一定的缓释效应,24 h后约50%游离药物释放,而72 h后,体外释药率可达80%,提示载药胶束具有长循环特性,见图3。
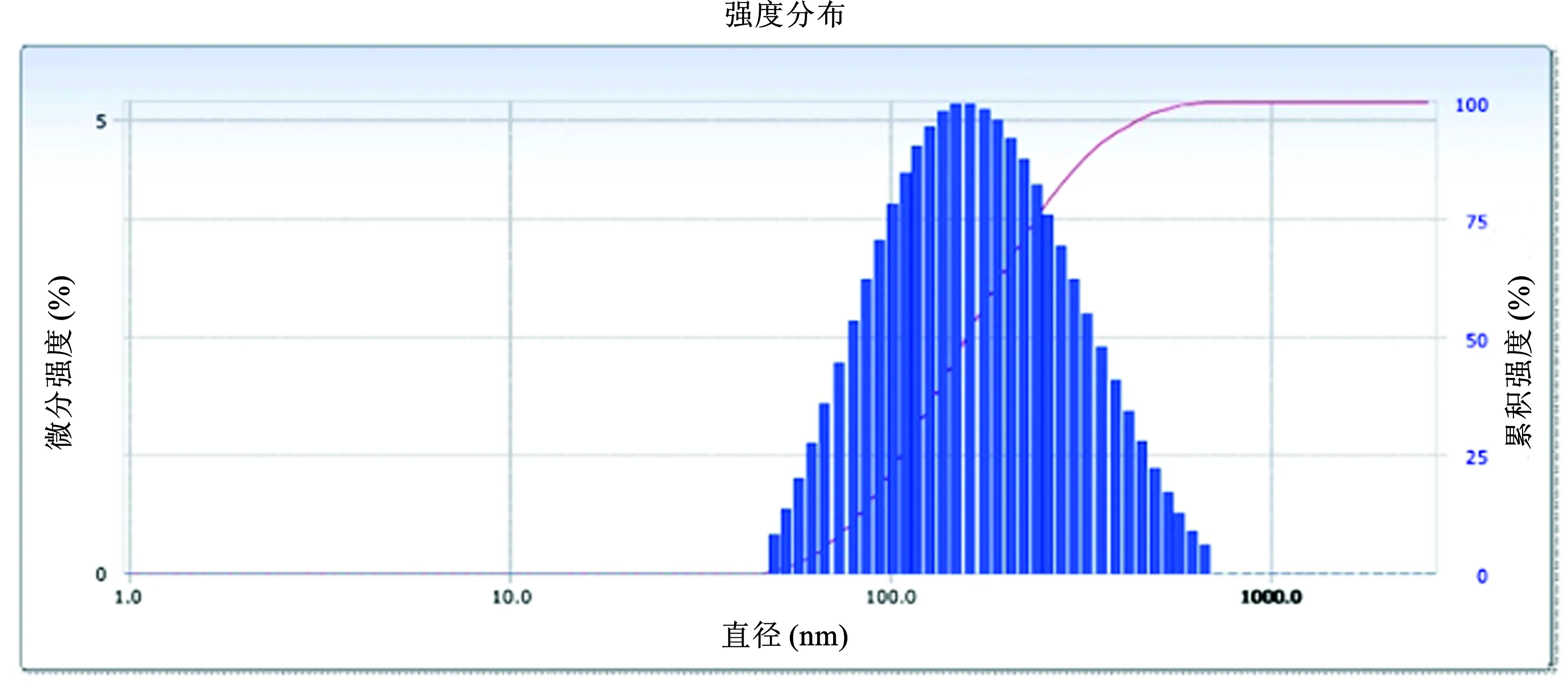
图2 姜黄素@普朗尼克胶束粒径分布
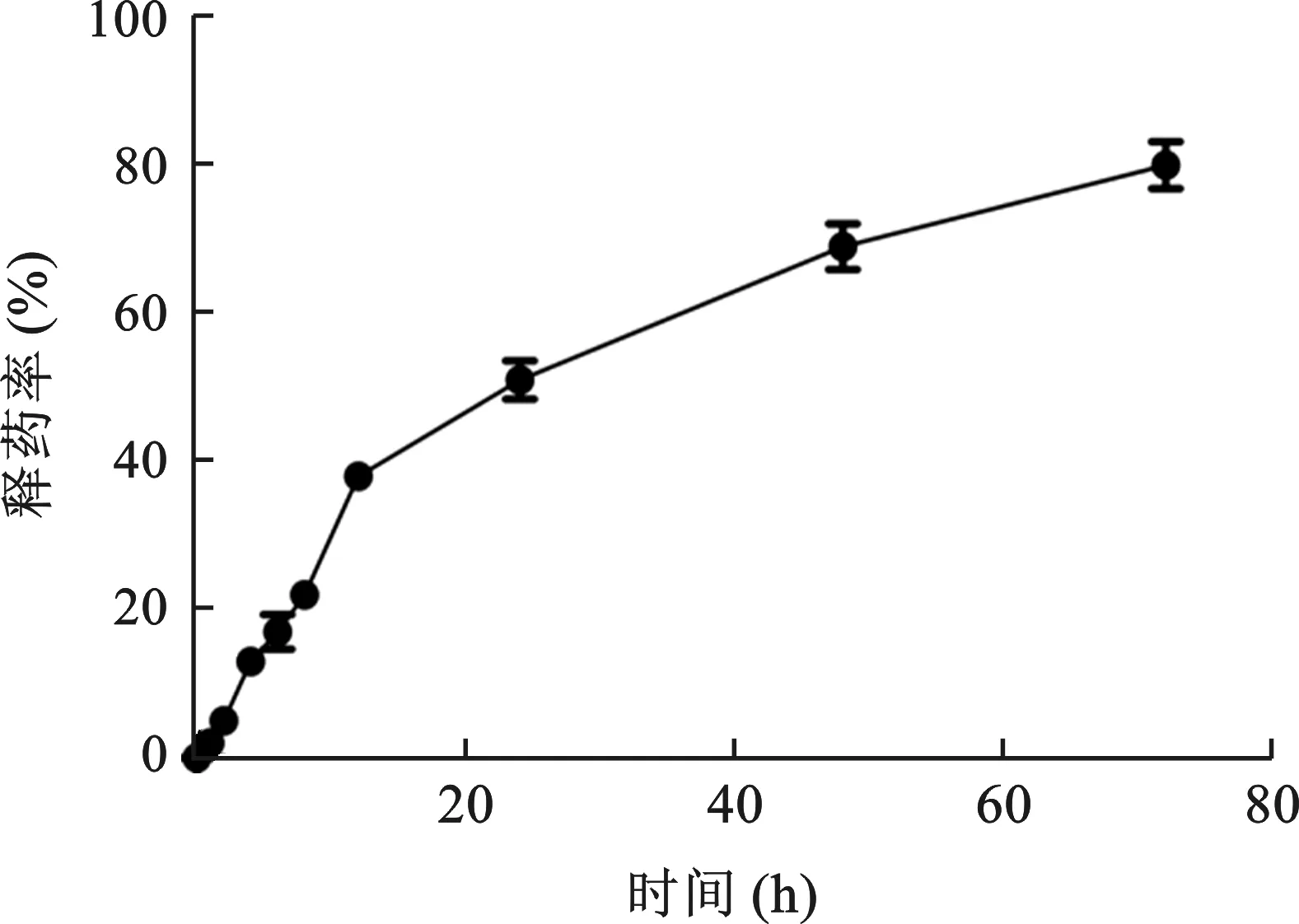
图3 姜黄素@普朗尼克胶束体外释药曲线
2.3 胶束的细胞毒性 MTT法检测胶束对前列腺癌PC-3细胞的抑制作用,结果显示姜黄素和姜黄素@普朗尼克胶束均可抑制PC-3细胞增殖,呈剂量依赖性。与游离姜黄素相比,姜黄素@普朗尼克胶束细胞增殖抑制作用显著增加,提示构建的胶束具有一定的抗肿瘤效应,可以在体外显著抑制前列腺癌PC-3细胞增殖,见表1。分别计算姜黄素和姜黄素@普朗尼克胶束的IC50值,见表2,结果显示姜黄素@普朗尼克胶束的IC50值显著低于姜黄素组,证实姜黄素@普朗尼克胶束的细胞毒性强于姜黄素,说明姜黄素@普朗尼克胶束可显著提高游离姜黄素的体外抗肿瘤活性,其作用机制可能与增加姜黄素在肿瘤细胞内的聚集有关。而空白胶束的IC50值很大,表明空白胶束几乎无细胞毒性,生物相容性好,提示选择的载药胶束材料,安全性好。
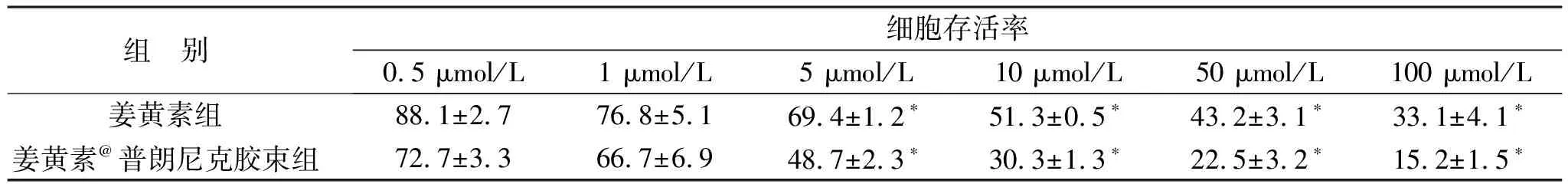
表1 姜黄素@普朗尼克胶束对PC-3细胞存活率的影响(%)

表2 姜黄素@普朗尼克胶束的细胞毒性(μmol/L)
2.4 PC-3细胞对胶束的摄取作用 HPLC法检测PC-3细胞对姜黄素@普朗尼克胶束的摄取,结果见表3。药物与细胞孵育0.5 h后,姜黄素胶束和游离药物均可被肿瘤细胞摄取并进入细胞,但胶束组和游离姜黄素组间比较无统计学差异(P>0.05)。但随着时间增加,胶束处理组细胞摄取率明显增加,孵育2、8 h后其细胞摄取率分别是游离姜黄素组的1.7和2.4 倍,呈现出统计学差异(P<0.05)。上述结果提示,肿瘤细胞对胶束的摄取表现出时间依赖性增强,呈现出缓释趋势,孵育2 h后,胶束的细胞摄取率明显高于姜黄素组,证实胶束可有效增加药物的胞内浓度,提高治疗效果。
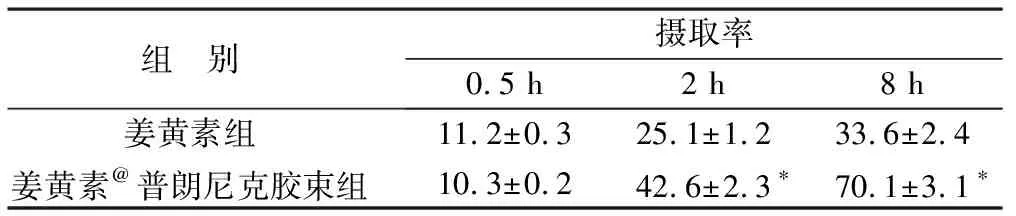
表3 姜黄素@普朗尼克胶束在PC-3细胞中的摄取率(%)
2.5 胶束的体内抗肿瘤作用 通过肿瘤体积、肿瘤生长抑制率分析胶束的体内抗肿瘤效果,结果见图4。生理盐水处理组肿瘤生长迅速,治疗结束时肿瘤体积可达6257 mm3,而游离姜黄素和胶束处理组肿瘤生长显著抑制(P<0.01),治疗结束时肿瘤体积分别为4855 mm3和3218 mm3,且姜黄素胶束显著增加了姜黄素的肿瘤抑制作用(P<0.05)。姜黄素对肿瘤生长的抑制率为(32.1±2.3)%,而姜黄素@普朗尼克胶束可以显著增加对肿瘤生长抑制率为(60.4±0.2)%。肿瘤生长抑制率结果显示姜黄素及其胶束均可抑制肿瘤生长,与游离姜黄素相比,姜黄素@普朗尼克胶束的肿瘤抑制率显著提高(P<0.01)。
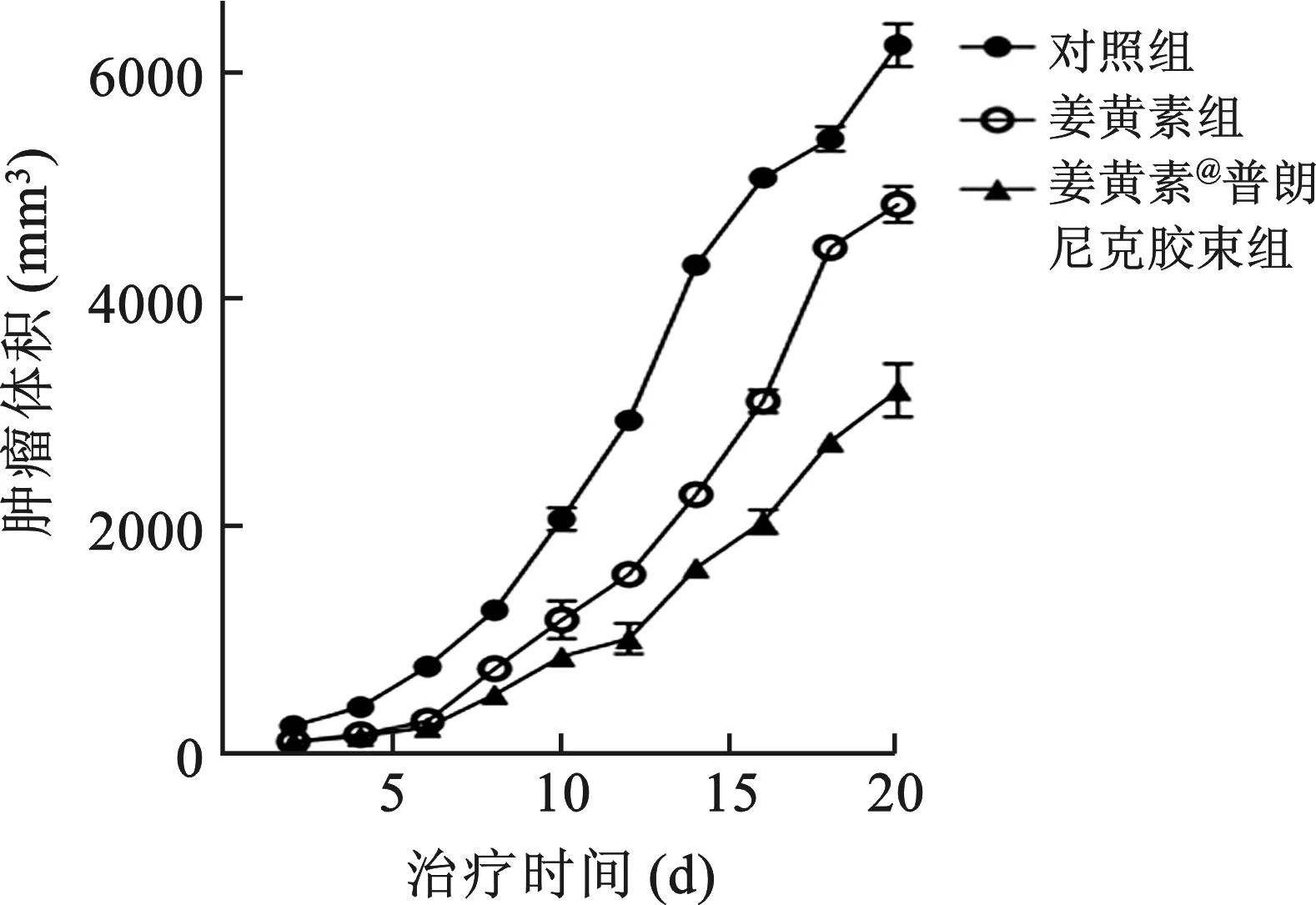
图4 三组荷瘤裸鼠肿瘤体积变化
3 讨 论
姜黄素作为一种传统的植物药,已在中国和印度有超过2000年的应用历史。2016年,美国营养保健品市场的统计数据显示,含有姜黄素的营养保健品增长率超过21%。在加拿大,因姜黄素的抗氧化效应和抗炎效应,已被认定为天然的健康保健品[12-13]。姜黄素是一种天然多酚类物质,安全性好,具有抗炎、抗氧化等多种药理作用,是一种极具潜力的抗肿瘤活性物质。但姜黄素水溶性差、半衰期短、导致其生物利用度低,极大限制了其的进一步开发应用。如何针对姜黄素,有效延长半衰期,提高生物利用度,是其研究的热点。
两亲性的高分子材料或嵌段共聚物可自组装形成聚合物胶束,呈核-壳状结构。聚合物胶束具有高度的热力学和动力学稳定性,在体内可保护胶束不被网状内皮系统识别和摄取;其内核具有一定的载药容量,可包裹难溶性的小分子化疗药物,发挥增溶作用[14-15]。聚合物胶束可有效增加难溶性药物溶解度,增加循环时间,提高生物利用度并呈现一定的缓释效果;同时,依据肿瘤高渗透长滞留效应,还可实现被动靶向作用,使聚合物胶束聚集于肿瘤组织,更好发挥治疗作用[16-17]。因此,设计制备姜黄素聚合物胶束可实现靶向、高效、长循环等作用,有效提升姜黄素生物利用度。Pluronic-P123为两亲性嵌段共聚物,可包裹药物自组装形成聚合物胶束,增加难溶性药物溶解度,延长药物作用时间,提高肿瘤细胞内药物有效浓度,实现其在靶部位的高效聚集。且Pluronic-P123为P糖蛋白底物,能抑制P糖蛋白参与的药物外排,与逆转肿瘤多药耐药(MDR)作用机制相关,呈现出一定的逆转多药耐药作用[11,18]。
我们以Pluronic-P123为载体材料,采用溶剂挥发法成功制备了姜黄素聚合物胶束,结果显示胶束大小均一,平均粒径为322 nm,具有良好的生物相容性。体外释药显示,姜黄素胶束呈现出一定的缓释效果,可持续释放姜黄素发挥药效作用。MTT结果显示空白胶束几乎无细胞毒性,证实胶束生物相容性好,为安全的纳米载体;而载药胶束呈现出良好的体外抗肿瘤活性,与游离姜黄素相比,细胞毒性明显增加。细胞摄取结果显示,载药胶束与游离药物相比,姜黄素胶束可被PC-3细胞高效摄取,入胞效率明显增加,说明聚合物胶束可有效增加药物在肿瘤细胞内蓄积,从而发挥更强的细胞毒性作用,提示姜黄素的高效浓集是载药胶束抗肿瘤活性增加的原因之一。体内实验进一步证实姜黄素胶束可有效抑制肿瘤增长,肿瘤生长抑制率显著优于游离姜黄素,具有良好的抗肿瘤作用。
此外,前期研究还显示,姜黄素能够影响血管生成,调控肿瘤血管生成的过程。姜黄素还可调控p53、NF-κB、MAPK、Nrf2等信号通路,影响前列腺癌等恶性肿瘤的病理进程,并能阻止NF-κB亚单位p65的核转录作用,减少IL-6和IL-11等细胞因子的分泌,抑制NF-κB活性,从而影响肿瘤细胞的凋亡、增殖等过程[19-20]。因此,我们将在后续的研究中,继续探讨姜黄素聚合物胶束诱导凋亡、调控血管生成等作用的相关机制和通路。本研究成功构建了一种粒径小、大小均一、生物相容性高的姜黄素聚合物胶束,与游离姜黄素相比,胶束可明显提高细胞摄取率,呈现良好的体内外抗肿瘤活性,并具有一定的缓释效果,可能为临床前列腺癌的治疗提供新的策略和实验依据。
