Box-Behnken响应面法优化胡黄连苷提取工艺△
2021-11-16杜昊忱屈玲霞a郝大伟杨梅毕艳艳关永霞张贵民
杜昊忱,屈玲霞a,郝大伟,杨梅,毕艳艳,关永霞*,张贵民
1.鲁南厚普制药有限公司,山东 临沂 276006;2.中药制药共性技术国家重点实验室,山东 临沂 276006;3.鲁南制药集团股份有限公司,山东 临沂 276006
胡黄连是玄参科植物胡黄连Picrorhiza scrophulariifloraPennell 的干燥根茎,主要分布于我国西藏、云南和四川的高原地区,能退虚热、除疳热、清湿热,主要用于骨蒸潮热、小儿疳热、湿热泻痢、黄疸尿赤、痔疮肿痛[1]。胡黄连中有效成分主要为环烯醚萜苷(胡黄连苷)类、葫芦素类及酚苷类,具有保肝利胆、抗肿瘤、抗糖尿病等多种功效[2]。其中,胡黄连苷类成分可对抗释放自由基诱导的肝损伤,并可以改善肝脏中胆固醇的代谢,对肝脏具有保护作用[3]。
本课题组通过硅胶柱色谱分离得到的胡黄连苷为中药五类新药,具有清热利湿、保肝、利胆、降酶的药理作用,主要用于肝胆湿热证肝炎或化学品及药物毒性造成的肝损害。
现阶段,胡黄连提取方法主要有乙醇回流提取法[4]、渗漉法[5]、浸渍法[6]、二氧化碳超临界萃取法等,多采用正交设计法或均匀设计法评价最佳提取工艺,但这些方法不能在给出的整个区域找到因素和响应值之间的一个明确的函数表达式,从而无法找到整个区域中因素的最佳组合和响应的最优值。考虑到正交设计法和均匀设计法的局限性,本研究在单因素试验基础上,以胡黄连提取物出膏率及胡黄连苷Ⅰ、胡黄连苷Ⅱ转移率为指标,用Box-Behnken 响应面法[7]对胡黄连提取工艺进行优化。
1 材料
1.1 仪器
Agilent 1260 型高效液相色谱仪;R2002 型旋转蒸发器(上海申顺生物科技有限公司);SHB-B95型循环水式多用真空泵(郑州长城科工贸有限公司);XS204型电子分析天平(Mettler Toledo公司)。
1.2 试药
对照品胡黄连苷Ⅰ(批号:111727-201702,纯度:95.6%);胡黄连苷Ⅱ(批号:111596-201805,纯度:93.4%)均购自中国食品药品检定研究院;高效液相色谱用试剂均为色谱纯;分析用试剂均为分析纯。
胡黄连(产地为西藏自治区,批号:190401)经中药制药共性技术国家重点实验室范建伟高级工程师鉴定为玄参科植物胡黄连Picrorhiza scrophulariifloraPennell的干燥根茎。
2 评价指标的测定
2.1 出膏率的测定
精密吸取相当于2 g 原药材量的胡黄连提取液,置已干燥至质量恒定(W1)的蒸发皿中,热风循环干燥箱中干燥,放置室温后精密称质量(W2)。

2.2 胡黄连苷Ⅰ、胡黄连苷Ⅱ转移率的测定
2.2.1 色谱条件 Agilent Zorbax SB C18色谱柱(250 mm×4.6 mm,5μm);流动相:甲醇-水-磷酸(35.0∶65.0∶0.1);流速:1.0 mL·min-1;柱温:30 ℃;检测波长:275 nm;进样量:10 μL。
2.2.2 对照品溶液的制备 精密称取胡黄连苷Ⅰ、胡黄连苷Ⅱ对照品适量,加甲醇制成含胡黄连苷Ⅰ1.250 mg·mL-1、胡黄连苷Ⅱ3.444 mg·mL-1的溶液,即得对照品储备液。精密吸取对照品储备液3 mL 置25 mL量瓶中,加甲醇稀释至刻度,摇匀,即得。
2.2.3 供试品溶液的制备 精密吸取各提取液0.5 mL,置于50 mL量瓶中,精密加甲醇至刻度线,摇匀即得。
2.2.4 胡黄连苷Ⅰ、胡黄连苷Ⅱ转移率测定 分别精密吸取对照品溶液和供试品溶液各10 μL 注入色谱仪,按2.2.1 项下色谱条件测定胡黄连苷Ⅰ、胡黄连苷Ⅱ的峰面积。

2.2.5 方法学考察 线性关系考察:精密移取2.2.2 项下对照品溶液,分别对对照品溶液进行0、2.5、5.0、10.0、20.0、40.0 倍稀释,按2.2.1项下色谱条件进样测定,记录峰面积值。以峰面积为纵坐标(Y),对照品质量浓度为横坐标(X),绘制标准曲线,并线性回归,得胡黄连苷Ⅰ、胡黄连苷Ⅱ的回归方程分别为Y=10 836X+22.585(r=0.999 3),线性范围0.003 8~0.150 0 mg·mL-1;Y=12 217X+10.21(r=0.999 7),线性范围0.010 3~0.413 3 mg·mL-1。
精密度试验:取同一对照品溶液,按2.2.1 项下色谱条件进样测定,连续进样6 次,计算RSD。结果,胡黄连苷Ⅰ峰面积的RSD 为3.41%,胡黄连苷Ⅱ峰面积的RSD 为2.67%,表明仪器精密度良好。
稳定性试验:取同一供试品溶液,分别于0、2、4、6、12、24、48 h,按2.2.1 项下色谱条件进样测定,计算RSD。结果胡黄连苷Ⅰ峰面积的RSD为2.11%,胡黄连苷Ⅱ峰面积的RSD 为3.27%,表明样品48 h内稳定性好。
重复性试验:取同一供试品溶液6 份,按2.2.1项下色谱条件进样测定,计算RSD。结果,胡黄连苷Ⅰ含量的RSD 为2.76%,胡黄连苷Ⅱ含量的RSD为3.27%,表明该方法的重复性好。
加样回收率试验:分别取已知含量的胡黄连提取 液6 份,分别按照1.0∶0.8、1.0∶1.0、1.0∶1.2 比例加入胡黄连苷Ⅰ、胡黄连苷Ⅱ对照品,按2.2.1 项下色谱条件进样测定,计算回收率和RSD。结果,胡黄连苷Ⅰ、胡黄连苷Ⅱ平均回收率分别为103.98%、101.34%,RSD分别为3.41%、2.75%。
3 单因素考察试验与结果
单因素考察主要考察提取溶剂、液料比、提取时间、提取次数,在前期预试验的基础上,将提取溶剂的考察条件定为50%、70%、95%乙醇和水;液料比考察条件定为12∶1、16∶1、20∶1、24∶1;提取时间考察条件定为1.5、3.0、4.5、6.0 h;提取次数考察定为1、2、3、4 次。在各项考察条件中选出1 个最优条件作为后续的提取条件,并为最终的响应面优化条件提供依据。
3.1 提取溶剂的单因素考察
取胡黄连粗粉150 g,分别选用50%、70%、95%乙醇和水为提取溶剂,液料比为16∶1,提取时间为3 h,提取次数为3 次,合并滤液后回收溶剂得稠膏,备用。按2.1 项下方法进行出膏率、胡黄连苷Ⅰ转移率和胡黄连苷Ⅱ转移率的测定。结果见表1。
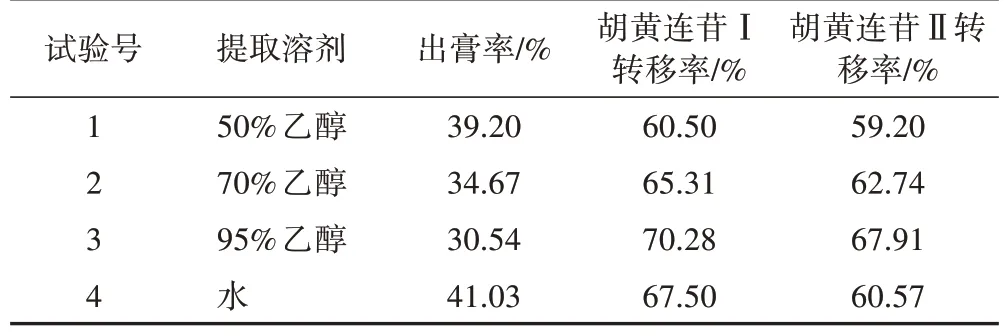
表1 乙醇体积分数对胡黄连苷提取工艺的影响
由表1 可知,95%乙醇作为提取溶剂,胡黄连苷Ⅰ和胡黄连苷Ⅱ转移率高,故选择95%乙醇为提取溶剂。
3.2 液料比的单因素考察
取胡黄连粗粉150 g,选用95%乙醇为提取溶剂,液料比考察条件定为12∶1、16∶1、20∶1、24∶1,提取时间为4.5 h,提取次数为3 次,合并滤液后回收溶剂得稠膏。按2.1 项下方法进行出膏率、胡黄连苷Ⅰ转移率和胡黄连苷Ⅱ转移率测定。结果见表2。

表2 液料比对胡黄连苷提取工艺的影响
由表2可知,液料比为12∶1、16∶1、20∶1时,随着液料比的增加,出膏率、胡黄连苷Ⅰ转移率和胡黄连苷Ⅱ转移率均增加,当液料比为24∶1时,胡黄连苷Ⅰ转移率和胡黄连苷Ⅱ转移率又略下降。因此,选择液料比为16∶1~24∶1 进行后续Box-Behnken 响应面优化。
3.3 提取次数的单因素考察
取胡黄连粗粉150 g,选用95%乙醇为提取溶剂,液料比考察条件定于20∶1,提取时间为4.5 h,提取次数分别为1、2、3、4 次,合并滤液后回收溶剂得稠膏,备用。按2.1 项下方法进行出膏率、胡黄连苷Ⅰ转移率和胡黄连苷Ⅱ转移率的测定。结果见表3。

表3 提取次数对胡黄连苷提取工艺的影响
由表3可知,提取次数超过3次时,胡黄连苷Ⅰ转移率和胡黄连苷Ⅱ转移率略微有点下降。因此,选择提取次数在2~4 次进行后续Box-Behnken 响应面优化。
3.4 提取时间的单因素考察
取胡黄连粗粉150 g,选用95%乙醇为提取溶剂,溶剂用量3.0 L,提取次数为3 次,提取时间分别为1.5、3.0、4.5、6.0 h,合并滤液后回收溶剂得稠膏,备用。按2.1项下方法进行出膏率、胡黄连苷Ⅰ转移率和胡黄连苷Ⅱ转移率的测定。结果见表4。
由表4 可知,随着提取时间的增加出膏率、胡黄连苷Ⅰ转移率和胡黄连苷Ⅱ转移率均增加,当提取时间为6 h 时,胡黄连苷Ⅰ转移率和胡黄连苷Ⅱ转移率又略下降。因此,选择提取时间为3.0~6.0 h进行后续Box-Behnken响应面优化。
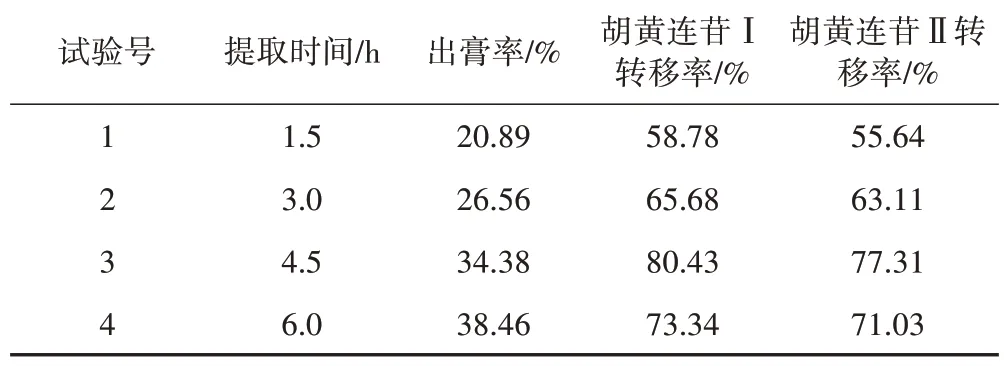
表4 提取时间对胡黄连苷提取工艺的影响
4 Box-Behnken设计响应面优化提取工艺
4.1 Box-Behnken设计试验与结果
根据Box-Behnken 设计原理,称取胡黄连粗粉150 g,分别以液料比(A)、提取次数(B)、提取时间(C)为考察因素,以出膏率、胡黄连苷Ⅰ和胡黄连苷Ⅱ转移率及综合得分(R综)[8]为响应值,设计17 个试验点,筛选各因素的最优条件。胡黄连苷提取工艺综合评分指标见表5,Box-Behnken响应面的因素水平设计及结果见表6,响应面二次回归方程方差结果分析见表7。

表5 胡黄连苷提取工艺综合评分指标
利用Design-Expert v 10.0.7 软件对表6 中的数据进行二次多元回归拟合,R综对各因素的二次多项回归模型方程为R综=-379.49+29.65A+29.07B+51.06C-0.44AB-0.76AC-1.02BC-0.59A2-2.02B2-3.49C2(r=0.977 0)。提示该模型拟合度较好,实验误差小,可用此模型进行分析和预测。进一步对方程进行方差分析,结果见表7。

表6 Box-Behnken响应面优选胡黄连苷提取工艺设计及结果
由表7 结果,对综合评价指标R综来说,A、B、A2和C2因素均达到极显著水平(P<0.01);交互项AC 影响差异有统计学意义(P<0.05);交互项AB和BC的影响差异无统计学意义,失拟项影响差异无统计学意义,提示回归方程拟合度良好。R综建立的回归整体模型其P<0.01,达到极显著水平。各因素对R综值的影响大小顺序为A>B>C。
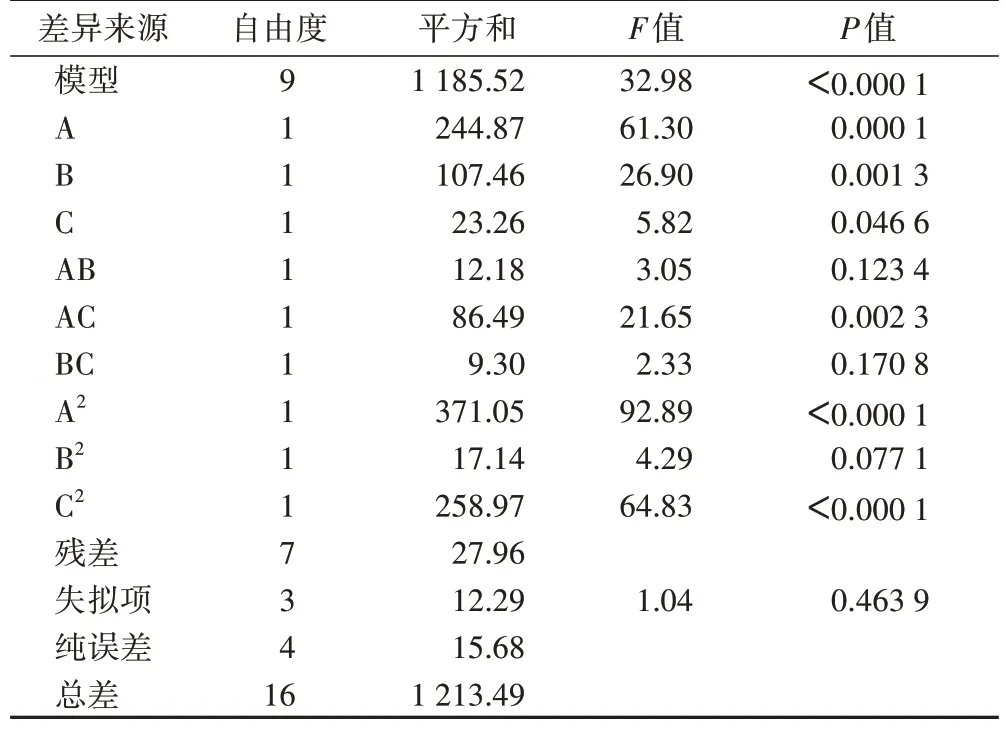
表7 Box-Behnken响应面优选胡黄连苷提取工艺二次回归方程方差分析结果
4.2 响应面法优化提取工艺
利用Design-Expert 10.0.7 软件得到二次回归方程的响应面图,以此评价试验因素之间的交互强度,以确定最优工艺参数。见图1~3。
由图1 可知,当提取次数一定时,随着液料比的增加,R综逐渐增加,当液料比超过20∶1 时,R综开始降低;当液料比一定时,随着提取次数的增加,R综逐渐增加,当提取次数超过3 次时,R综增加缓慢。由图2 可知,当提取时间一定时,随着液料比的增加,R综逐渐增加,当液料比超过20∶1 时,R综略微降低;当液料比一定时,随着提取时间的增加,R综逐渐增加,当提取时间超过4.5 h 时,R综变化不明显。由图3 可知,当提取时间一定时,随着提取次数的增加,R综逐渐增加,当提取次数超过3次时,R综增加缓慢;当提取次数一定时,随着提取时间的增加,R综逐渐增加,当提取时间超过4.5 h 时,R综开始下降。A 的曲面较陡峭,提示因素A 对响应值影响显著,其次是B 和C。由等高线图可知,液料比和提取次数、提取次数和提取时间交互作用的等高线图没有呈现椭圆形,说明液料比和提取次数、提取次数和提取时间交互作用不显著;液料比和提取时间交互作用的等高线图呈现明显的椭圆形,说明液料比和提取时间交互作用显著。
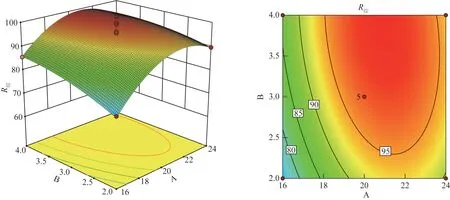
图1 提取次数和料液比对R综的响应面和等高线图

图2 提取时间和料液比对R综的响应面和等高线图

图3 提取时间和提取次数对R综的响应面和等高线图
经Design-Expert 10.0.7 软件优化得到胡黄连总苷类成分的最优提取工艺条件液料比为21.23∶1、提取次数3 次、提取时间4.61 h。结合实际所需,最终确定提取工艺为称取液料比为20∶1,提取次数3次,提取时间4.5 h。
4.3 验证实验
称取胡黄连粉末150 g,按优化的提取工艺进行3 次验证实验,得到出膏率、胡黄连苷Ⅰ转移率和胡黄连苷Ⅱ转移率分别为45.12%、94.15%和91.98%,与预测值的相对误差分别为0.57%、0.84% 和0.65%,提示优化得到的提取工艺稳定可靠。
5 结论
本实验通过单因素试验,确定了提取溶剂,以及液料比、提取时间、提取次数三因素的考察范围。在此基础上,运用Box-Behnken 响应面法获得了胡黄连总苷的最优提取工艺:95%乙醇提取3 次,液料比为20∶1,提取4.5 h。该方法提取完全、操作简单、稳定性好,胡黄连苷Ⅰ、胡黄连苷Ⅱ转移率高,可为将来胡黄连苷进一步分离纯化提供参考。
