2 型糖尿病患者发生微量白蛋白尿预测模型的建立与验证研究
2021-11-15卢作维刘涛刘向阳王琼赖敬波陈艳艳李晓苗
卢作维,刘涛,刘向阳,王琼,赖敬波,陈艳艳,李晓苗
国际糖尿病联盟(IDF)发布的最新全球糖尿病地图显示,目前糖尿病患者(20~79 岁)数量最多的前3 个国家或地区分别为中国、印度和美国,糖尿病患者数量分别为1.164 亿、7 700 万和3 100 万,预计到2030 年前3 位排名保持不变,中国糖尿病患者数量将达到1.405 亿[1]。糖尿病肾病(diabetic kidney disease,DKD)是糖尿病最常见的微血管并发症之一,是目前引起终末期肾脏疾病(ESRD)的主要原因[2],并增加了糖尿病患者的死亡风险。最新流行学研究显示,全球糖尿病患者DKD 的患病率为20%~40%[3],而我国DKD 的患病率亦呈快速增长趋势,2009—2012 年我国2 型糖尿病(T2DM)患者的DKD 患病率在社区患者中为30%~50%[4],在住院患者中为40%左右[5],已超过原发性肾小球肾炎的患病率,成为慢性肾脏病(CKD)的首要病因(Trends in Chronic Kidney Disease in China)。DKD 的死亡人数在1990—2013 年增加了2.8倍,是死亡率增长速度最快的慢性疾病[6]。
尿微量白蛋白/ 肌酐(UACR)作为DKD 临床诊断的重要指标[2],对DKD 的早期筛查具有重要作用。根据Mogensen 临床分期[7],DKD 起病较隐匿,Ⅰ~Ⅲ期病程缓慢,主要表现为微量白蛋白尿(MAU),病变为可逆性。发生MAU 的T2DM 患者10 年中有30%可转变为正常白蛋白尿(NAU)或尿白蛋白阴性,30%~45%则转变为大量白蛋白尿(CAU)[8],一旦进入大量白蛋白尿期(Ⅳ期),进展至ESRD(Ⅴ期)的速度显著加快。
早期筛查UACR 对于预防与延缓糖尿病MAU 的发生、发展具有重要作用,有利于阻止或延缓DKD 的恶化,防止其进展至ESRD,从而降低糖尿病患者的死亡率和致残率,提高患者的生活质量。因此,本研究基于列线图构建一个简单、有效的个性化风险预测模型,筛选独立危险因素,通过独立危险因素预测T2DM 患者发生MAU 的风险,从而采取有效的控制措施,早期诊治和改善预后。
1 对象与方法
1.1 研究对象 选取2014 年3 月至2016 年3 月于空军军医大学第一附属医院内分泌科住院的T2DM 患者1 311 例,为建立和验证预测模型将研究对象分为两个部分,2014 年3 月至2015 年9 月的数据作为开发队列(933 例),2015 年10 月至2016 年3 月的数据作为验证队列(378 例)。纳入标准:(1)符合1999 年世界卫生组织(WHO)制定的糖尿病诊断标准[9];(2)年龄≥18 岁,男女不限;(3)过去3 个月内有稳定的降糖方案。排除标准:(1)年龄<18 岁;(2)UACR>300 mg/g;(3)1 型糖尿病、妊娠期糖尿病及其他特殊类型糖尿病;(4)糖尿病酮症酸中毒;(5)尿路感染、急性肾损伤、多囊肾、肾移植、肾脏肿瘤等其他疾病引起的肾脏损伤;(6)在过去3 个月内有高血糖高渗状态或严重和反复发生的低血糖事件;(7)恶性肿瘤、精神障碍或严重的肾或肝功能障碍病史。本研究经空军军医大学第一附属医院伦理委员会审核批准,所有患者知情同意。
1.2 MAU 诊断标准 依据《中国2 型糖尿病防治指南(2020年版)》[10],T2DM 患者在排除24 h 内运动、感染、发热、充血性心力衰竭、月经、显著高血糖、显著高血压以及其他CKD 后,将随机UACR ≥30 mg/g 称为尿白蛋白排泄增加,3~6 个月内重复测定3 次UACR 中有2 次尿白蛋白排泄增加即可诊断白蛋白尿。同时,将UACR<30 mg/g 称为NAU;UACR 30~300 mg/g 称 为MAU;UACR>300 mg/g 称 为CAU。本研究对象已剔除UACR>300 mg/g 的患者,仅包括NAU 和MAU 患者。
1.3 基本特征和实验室指标收集 基本特征包括性别、年龄、糖尿病家族史、糖尿病病程、吸烟状况〔吸烟定义为患者每日吸烟1 支(含)以上,连续或累积6 个月〕、饮酒状况(饮酒定义为平均每周饮酒1 次以上)、收缩压(SBP)、舒张压(DBP)、体质指数(BMI)和腰臀比(WHR)。入院时测量BMI和WHR,BMI=体质量(kg)/身高2(m2),WHR=腰围(m)/臀围(m)。患者禁食8~12 h,于次日清晨空腹抽取肘静脉血5 ml,采用检验科全自动生化分析仪(4 000 r/min 离心5 min,离心半径22.5 cm,留取血清)检测三酰甘油(TG)、总胆固醇(TC)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)、白蛋白(ALB)、血肌酐(Scr)、尿素氮(BUN)、尿酸(UA)、胱抑素C(Cys C),采用罗氏卓越型血糖仪检测空腹血糖(FPG),采用高效液相色谱法检测糖化血红蛋白(HbA1c)。并于次日晨起留取晨尿5 ml 送检,使用免疫比浊法检测UACR。伴发疾病包括糖尿病视网膜病变(DR)、颈动脉内-中层膜厚度(CIMT)以及是否注射胰岛素和口服肾素-血管紧张素系统阻滞剂(RASB)降压药。
1.4 统计学方法 采用SPSS 23.0 和R 4.0 软件进行统计学分析,符合正态分布的计量资料以(±s)表示,两组间比较采用两独立样本t 检验。计数资料以相对数表示,两组间比较采用χ2检验。运用LASSO 回归筛选变量,通过多因素Logistic回归分析建立预测模型,并绘制列线图。依靠区分度、校准度和临床净收益三个方面评估预测模型,以受试者工作特征曲线(ROC 曲线)下面积(AUC)评估区分度;校准曲线和Hosmer-Lemeshow 拟合优度检验评估校准度;决策曲线分析(DCA)评估临床有效性。以P<0.05 为差异有统计学意义。
2 结果
2.1 开发队列和验证队列患者基本特征和实验室指标比较开发队列和验证队列患者性别、年龄、糖尿病家族史、糖尿病病程、吸烟者所占比例、饮酒者所占比例、SBP、DBP、BMI、WHR、FPG、HbA1c、TG、TC、LDL-C、HDL-C、ALB、Scr、BUN、UA、Cys C、DR 发生率、CIMT 发生率、注射胰岛素者所占比例、口服RASB 降压药者所占比例比较,差异均无统计学意义(P>0.05)。验证队列MAU 发生率高于开发队列,差异有统计学意义(P<0.05),见表1。

表1 开发队列和验证队列患者基本特征和实验室指标比较〔n(%)〕Table 1 Comparison of basic demographics and laboratory parameters in development and validation sub-cohorts of type 2 diabetes mellitus patients
2.2 LASSO 回归筛选变量 根据开发队列中患者的人口学、体格检查、生化检查、伴发疾病和药物使用情况,使用LASSO 回归分析从25 个变量中筛选出7 个非零系数的预测变量(图1),在λ 最小值(λ=0.012)和最小值的1 SE(λ=0.039)处绘制垂直线,当log(λ)=-3.242 时筛选出7 个非零系数的预测变量,此时LASSO 回归模型最适合。筛选的预测变量包括糖尿病病程、SBP、FPG、TG、Scr、Cys C、DR。
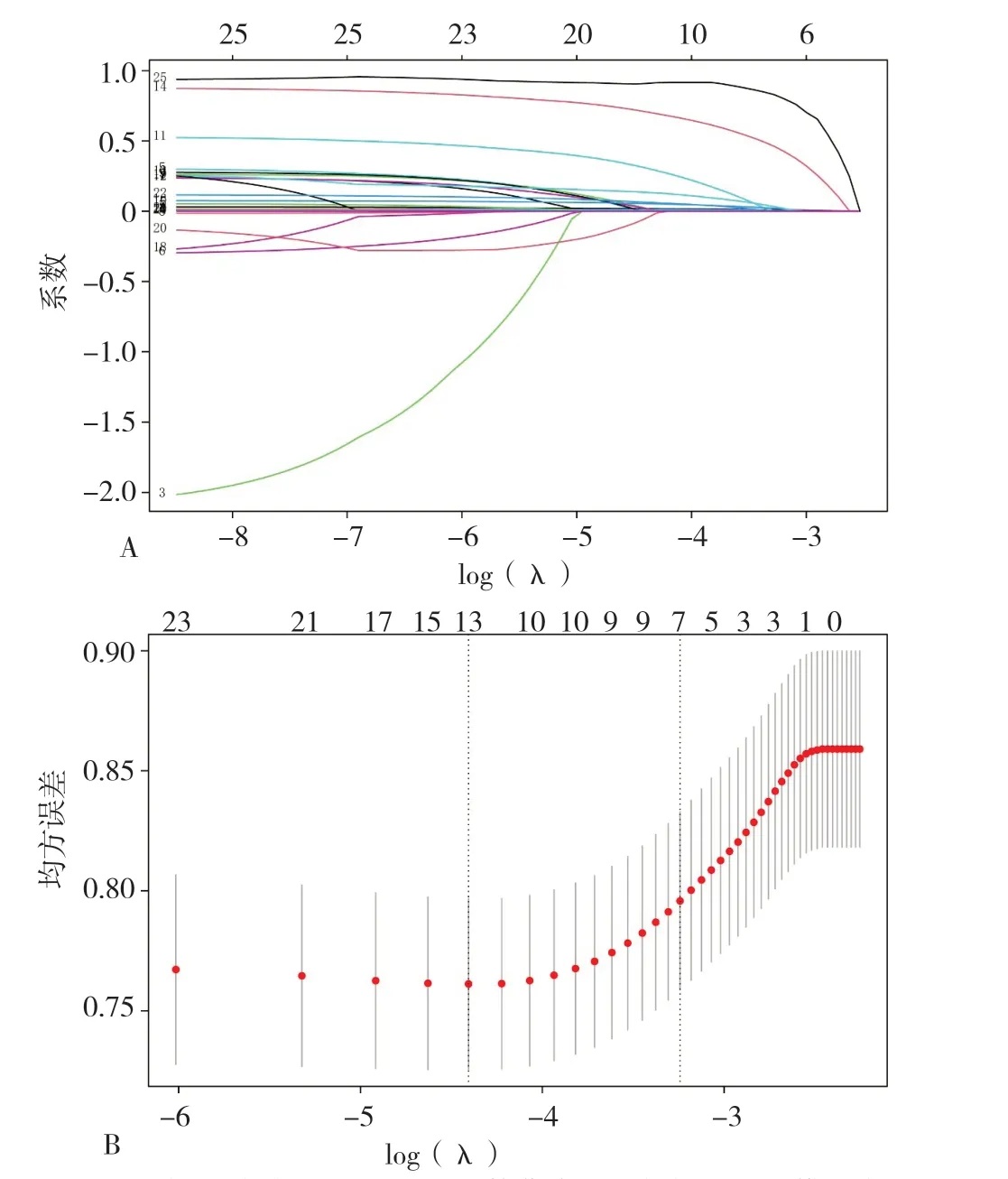
图1 使用LASSO 回归模型筛选预测变量Figure 1 Selection of predictors of microalbuminuria in type 2 diabetes mellitus using the LASSO binary Logistic regression model
2.3 构建预测模型 以T2DM 患者发生MAU 为因变量(赋值:NAU=0,MAU=1),以LASSO 回归分析筛选的7 个预测变量为自变量(赋值见表2)构建多因素Logistic 回归预测模型,结果显示,SBP ≥140 mm Hg、FPG ≥7.0 mmol/L、TG ≥1.7 mmol/L、Scr>106 μmol/L、Cys C>1.09 mg/L、合 并DR 是T2DM 患者发生MAU 的危险因素(P<0.05),见表3。并根据预测变量绘制列线图,即Nomogram(图2)。通过列线图可对每个变量相应数值进行评分,然后将所有变量的分数相加即可得到总分,并根据总分向下绘制一条垂直线,可标出T2DM 患者发生MAU 的估计概率。
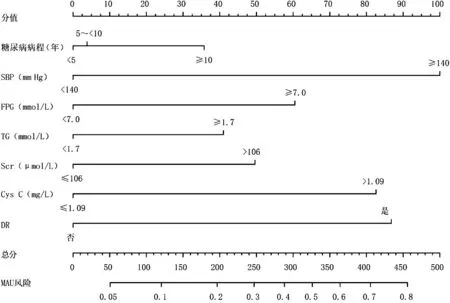
图2 T2DM 患者发生MAU 风险的预测模型列线图Figure 2 Nomogram predicting microalbuminuria in type 2 diabetes mellitus
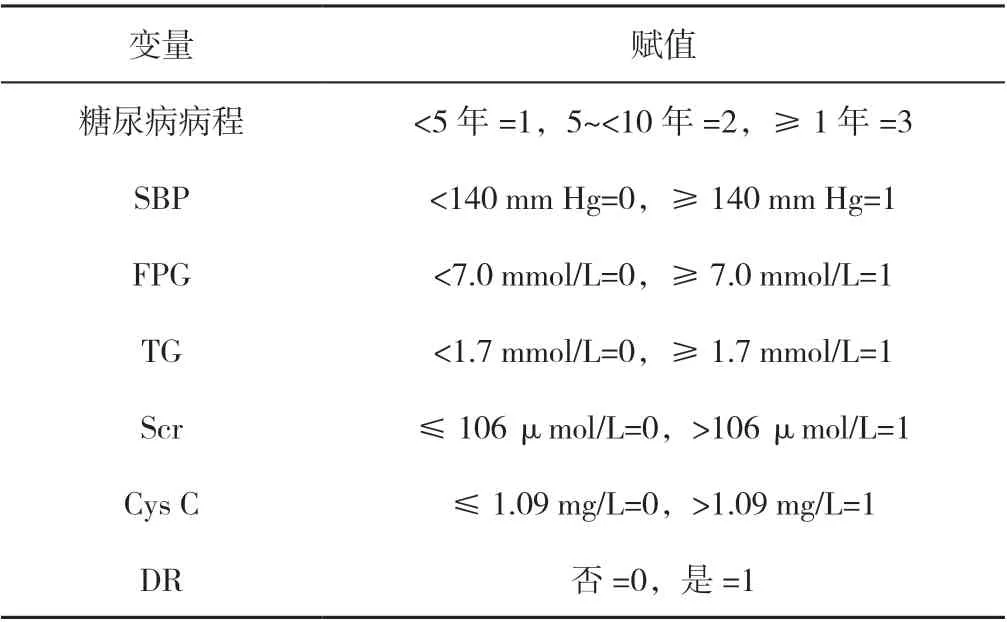
表2 T2DM 患者发生MAU 影响因素的多因素Logistic 回归分析赋值表Table 2 Assignment table of influencing factors of microalbuminuria in type 2 diabetes mellitus analyzed using multivariate Logistic regression

表3 T2DM 患者发生MAU 影响因素的多因素Logistic 回归分析Table 3 Multivariate Logistic regression analysis of influencing factors for microalbuminuria in type 2 diabetes mellitus
2.4 预测模型的验证 该预测模型的验证主要基于模型的区分度和校准度,通过绘制预测模型预测T2DM 患者发生MAU 的ROC 曲线评估模型区分度。开发队列的AUC 为0.762〔95%CI(0.734,0.789)〕,截断值为0.175(图3A);验证队列的AUC 为0.734〔95%CI(0.686,0.777)〕,截断值为0.210(图3B),表明预测模型具有良好的判别能力。同时,Hosmer-Lemeshow 拟合优度检验显示出较好的拟合度(开发队列P=0.377;验证队列P=0.217),表明该模型预测概率与实际概率基本一致,具有较好的校准度。另外,开发队列和验证队列的校准曲线显示具有中度的一致性,预测模型的校正能力良好(图4)。综上所述,预测模型的Nomogram 具有中等的预测能力。
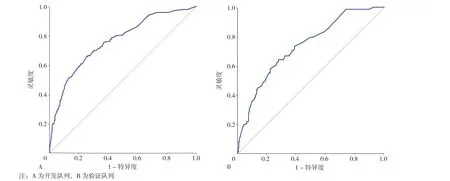
图3 预测模型预测T2DM 患者发生MAU 的ROC 曲线Figure 3 ROC curve of the nomogram for predicting microalbuminuria in type 2 diabetes mellitus
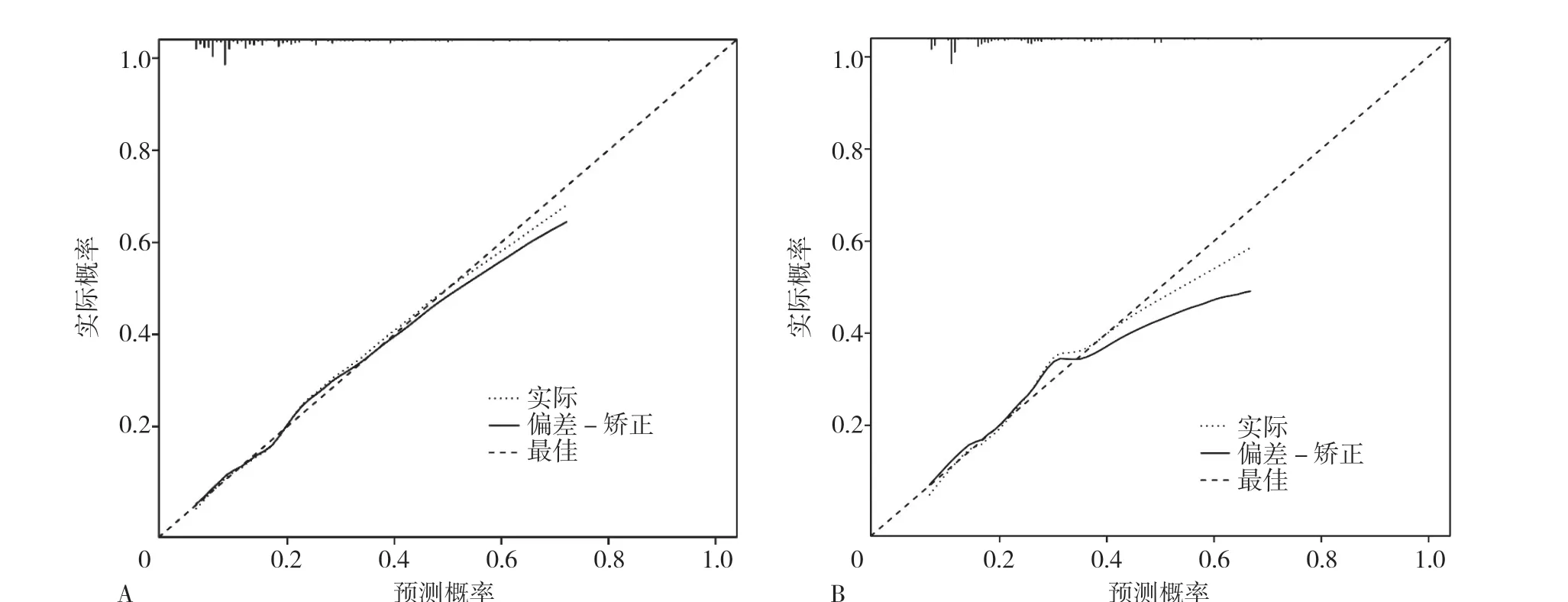
图4 预测模型的校准曲线Figure 4 Calibration curve of the nomogram predicting microalbuminuriain type 2 diabetes mellitus
2.5 临床应用 利用DCA 评估预测模型的临床有效性,T2DM 患者发生MAU 风险列线图的DCA 见图5。结果显示,如果患者和医生的阈值概率分别>20%,则在当前研究中使用该列线图预测MAU 发生风险会比对所有患者实施干预方案更有利,在这个范围内,预测模型的净收益显著高于两个极端状况,即所有患者得到了临床干预。

图5 预测模型的DCA 分析Figure 5 Decision curve analysis of the nomogram predicting microalbuminuriain type 2 diabetes mellitus
3 讨论
目前,Nomogram 是临床研究中可靠性高、实用性强的疾病预测方法[11],已被国内外广泛应用于肿瘤学和慢性疾病的风险预测[12],通过分析整合影响疾病发生、发展以及预后的危险因素来预测疾病某一事件的发生概率,基于Nomogram 建立的列线图预测模型界面简单、直观、易于理解[13],而且具有较高的准确性,有助于为临床医生提供更好的临床决策[14]。
本研究中,开发队列有15.3%的T2DM 患者合并MAU,通过LASSO 回归和多因素Logistic 回归分析筛选出7 个与MAU 独立相关的危险因素,即糖尿病病程、SBP、FPG、TG、Scr、Cys C、DR,根据这些独立危险因素构建并验证了T2DM患者发生MAU 风险的列线图预测模型。预测模型预测开发队列的AUC 为0.762,预测外部验证队列的AUC 为0.734,提示模型的预测水准较高。同时,开发队列和验证队列的校准曲线均显示出实际诊断与预测诊断之间的良好一致性。另外,DCA 曲线也提示该预测模型具有很好的临床有效性。该预测模型表明,对于T2DM 患者,通过降低血糖、血压、血脂以及改善肾脏功能可以有效降低T2DM 患者发生MAU 的风险。
最新研究证实,糖尿病病程与DKD 的发生、发展密切相关,病程在10 年以上的T2DM 患者通常会出现从MAU 逐渐发展为CAU[15]。同样,ADLER 等[16]研究证实,随访10 年后,约25%的糖尿病患者发展为MAU 或CAU。因此,《2020年糖尿病肾病ADA 指南》[2]建议所有T2DM 患者和病程≥5年的1 型糖尿病患者每年至少检测1 次UACR,UACR ≥30 mg/g 的患者每年检测2 次。本研究同样证实,与病程<5 年的T2DM 患者相比,病程≥10 年的T2DM 患者出现MAU 的风险是其1.465 倍,虽不具备统计学意义,但也可为诊断DKD 提供一定的证据。
高血压、高血糖、血脂异常是DKD 重要的独立危险因素。高血压是T2DM 患者微血管并发症发生和发展的独立危险因素[17],与UACR 存在显著的相关关系[18]。HOLMAN等[19-20]2 项长期随访的队列研究发现,血压每升高10 mm Hg(1 mm Hg=0.133 kPa),T2DM 患者发生MAU 的风险将增加23%;随访5 年后,与血压控制不严格的糖尿病患者相比,血压控制较好患者的糖尿病微血管病变风险下降37%(P=0.009),糖尿病死亡率下降32%(P=0.020);随访10年后,血压控制较好患者的糖尿病微血管病变风险下降16%(P=0.170),糖尿病死亡率下降16%(P=0.120)。本研究的结果再次佐证了这些研究,SBP 是T2DM 患者发生MAU 的独立危险因素。FPG 作为评估T2DM 患者日常血糖控制情况的基本指标,是DKD 的独立危险因素[21],直接影响T2DM微血管并发症的病程进展,积极有效的降糖治疗可延缓DKD的发生、进展。ISMAIL-BEIGI 等[22]研究显示,与标准治疗组相比,强化降糖组患者MAU 发生率显著降低,且发展为CAU 或ERSD 的风险也降低。TG 作为血脂代谢异常的重要指标之一,与DKD 存在独立的相关关系[23-24],同时,三酰甘油葡萄糖乘积(TyG)指数也与UACR 呈高度正相关[25]。
Scr 与UACR 密切相关[26],可共同用于评估肾脏功能,是目前诊断DKD 的关键指标。本研究同样证实了Scr 是MAU的独立危险因素,与Scr ≤106 μmol/L 的患者相比,Scr>106 μmol/L 的T2DM 患 者 发 生MAU 的 风 险 是 其1.699 倍。同样,Cys C 也是DKD 的独立危险因素[26],是一种评估肾功能的内源性标志物[27],与机体肾功能的损害程度明显相关。ZENG 等[28]研究发现,Cys C 与UACR 呈正相关(r=0.594,P<0.001),在MAU的诊断分析中,Cys C的AUC为0.805〔95%CI(0.733,0.877)〕,提示诊断效能较高。
DR 和DKD 是糖尿病最常见的微血管并发症,视网膜血管与肾脏血管具有相似的生理结构,暴露于同样的糖尿病微环境,二者具有相似的发病机制,互为危险因素,常伴随发生[29]。一项荟萃分析显示,DR 与DKD 的发生、发展密切相关,同时也是MAU 或进展为CAU 的预测指标;反之,CAU 也与DR 的严重程度密切相关[30]。本研究结果显示,合并DR 的T2DM 患者发生MAU 风险是单纯T2DM 患者的2.528 倍,表明DR 可作为MAU 良好的预测指标。
但是,本研究仍存在不足之处。首先,本研究纳入的研究对象是UACR ≤300 mg/g 的T2DM 患者,仅为DKD 早期提供风险预测,尚需更多研究进一步完善该模型;其次,本研究是一项回顾性研究,列线图预测模型的预测效能还需更多外部数据进行验证,尤其是不同地区、种族的多中心、大样本队列研究;最后,危险因素分析并未包含影响T2DM 发生MAU 的所有潜在危险因素,例如饮食结构、运动状况、是否使用钠-葡萄糖协同转运蛋白(SGLT-2)抑制剂以及其他因素。
综上所述,本研究构建了一个包含糖尿病病程、SBP、FPG、TG、Scr、Cys C 和DR 7 个预测变量的个性化风险预测模型,开发队列和外部验证队列的ROC 曲线、校准曲线和DCA 均显示该模型具有良好的预测性能,能够应用于临床实践,可为临床医生提供有效的诊疗决策,通过控制血压、血糖、血脂以及改善肾脏功能,阻止或者延缓T2DM 患者出现MAU,防止其发展为CAU 或ERSD,从而减轻患者或者社会的经济负担。
作者贡献:卢作维、刘涛、刘向阳、王琼、赖敬波、李晓苗进行文章的构思与设计,论文的修订;卢作维、刘涛、刘向阳、李晓苗进行研究的实施与可行性分析,负责文章的质量控制及审校;卢作维、陈艳艳进行数据收集及整理;卢作维、刘涛、王琼、赖敬波、陈艳艳进行统计学处理;卢作维、刘涛、王琼、赖敬波、陈艳艳进行结果的分析与解释;卢作维、刘涛、陈艳艳撰写论文;卢作维、刘涛、李晓苗对文章整体负责,监督管理。
本文无利益冲突。
