移植心脏病理学诊断标准及其进展
2021-11-15郭晖
郭晖
1 移植心脏病理学研究的简史
1.1 国际移植心脏病理学研究的简史
自20世纪初以来,研究者围绕心脏移植中的血管吻合技术、心脏保存方法和体外循环技术等进行了大量的动物实验研究,在此基础上,1967年Christian Barnard在南非实施了人类首例临床心脏移植,该受者存活了18 d。借此,Thompson对该人体首例移植心脏进行了详细的解剖病理学研究。随着20世纪80年代环孢素等强效免疫抑制剂的临床应用,心脏移植例数和移植心脏存活时间均显著提升。与此同时,这一成绩在很大程度上也要归功于心内膜心肌活组织检查(endomyocardial biopsy,EMB)技术的建立及其在临床心脏移植中的应用,使得移植心脏的排斥反应等并发症可以得到及时、准确的诊断和治疗。
EMB的临床应用取决于活组织检查(活检)设备的发明及其不断改进、完善并转化应用于临床。EMB设备最初于1962年由日本东京女子医科大学年轻的心脏外科医师Konno发明,其通过将可弯曲的活检导管经左前臂贵要静脉进入右心室或通过左侧腋动脉插入到左心室,借助导管前端可张合的活检钳口夹取心内膜下的心肌组织标本以供组织病理学诊断,其对5例原发性心肌病的患者共进行了10次EMB,均得到了明确的病理学诊断且未发生活检导致的不良事件,初步证明了这一方法安全可行,但这一极具临床应用前景的医学发明由于当时仅发表于日文医学杂志,影响力有限,而且更主要是因为宗教及人文的因素,日本在2008年以前一直未开展心脏移植,使得日本科学家的这一发明未能得到临床应用。直到1973年,正在美国Stanford大学医学院从事研究工作的英国年轻外科医师Caves受到移植肾和移植肝活检病理学诊断排斥反应的启发,利用Konno活检钳首次在实验犬的心脏移植中尝试取得心肌活检组织,进而与年轻的病理科医师Margaret Billingham合作,系统地观察了活检移植心脏的病理学表现,进而开创了移植心脏病理学这一新的领域。在此基础上,Caves与医疗仪器研发者Schulz合作,进一步对Konno活检钳予以改进,使其更柔软、更安全,发明了基本定型的活检钳(Stanford Caves-Schultz bioptome)并沿用至今。更重要的是他开创了一种经颈内静脉穿刺进行EMB的方法。由于EMB设备的日益完善、EMB经验的日渐成熟,EMB迅速成为移植心脏并发症最为准确的诊断手段,包括排斥反应在内的移植心脏多种并发症的病理学特征得以观察和掌握。借此,1981年Billingham基于美国Stanford大学的经验,提出了移植心脏急性排斥反应的活检病理学诊断与分级标准,为心脏移植术后并发症的正确诊断提供了依据。相继地,欧美其他心脏移植中心也陆续提出和应用了各自的EMB活检病理学诊断标准,但各移植中心的活检诊断标准分级繁琐、诊断结果不一。
为提高各移植中心之间活检病理结果的通用性,便于各移植中心之间的交流和多中心的协作研究,在借鉴淋巴瘤病理学诊断及其分类标准的基础上,1989年在国际心肺移植学会(International Society for Heart and Lung Transplantation,ISHLT)的组织下,由Billingham综合各移植中心的诊断标准提出了移植心脏排斥反应的ISHLT诊断及分级标准(以下简称“ISHLT标准”),并于1990年正式发布(1990年ISHLT标准)[1],包括无急性排斥反应(缺乏排斥反应组织学表现)、轻度排斥反应(局灶性或弥漫性淋巴细胞浸润不伴有心肌细胞损伤)、中度排斥反应(局灶性或弥漫性淋巴细胞浸润伴有心肌细胞损伤)和重度排斥反应(大量淋巴细胞浸润并混有中性粒细胞以及出血)。随后Gallo等应用ISHLT标准,回顾性地分析了1 037例次移植心脏EMB活检病理学的诊断,验证了ISHLT标准具有良好的准确性及可重复性。随着EMB在心脏移植中的广泛应用,其病理学方法也得以统一,包括明确规定可在≥1个部位活检取得心肌组织 ;每次活检的心肌组织标本数量最好有5~10粒,至少3~5粒;主要进行光学显微镜(光镜)检查,必要时进行电子显微镜(电镜)检查;光镜检查包括苏木素-伊红(hematoxylin-eosin,HE)染色、Masson三色染色和弹力纤维染色等。2004年ISHLT又更新并提出了新的活检诊断体系(2004年ISHLT标准),其主要针对急性排斥反应中的细胞免疫和体液免疫两种免疫效应机制,除了原有的、单一的急性细胞性排斥反应(acute cellular rejection,ACR)或称为T细胞介导的排斥反应(T cell-mediated rejection,TCMR)类别以外,增加了急性体液性排斥反应或称为抗体介导的排斥反应(antibody-mediated rejection,AMR)这一特定类别,体现出对AMR这一主要并发症类型的高度认可和重视;后续于2013年进一步对AMR深入研究,尤其是对AMR所致微血管损伤(microvascular injury,MI)或微血管炎(microvascular inflammation,MVI)病变,即心肌间毛细血管C4d阳性沉积和心肌间毛细血管内巨噬细胞淤积浸润的组织病理学特点予以确定,提出了2013年ISHLT标准[2]。
非常有意义的是,正是受到1990年ISHLT标准的启发,1991年举办了首届Banff移植病理学会议,提出了移植肾活检病理诊断的Banff活检病理学诊断标准(以下简称“Banff标准”),更进而在广泛研讨的基础上逐渐建立了多种移植器官活检的Banff标准。随着Banff会议研讨的深入,移植心脏病理学及其诊断也成为Banff会议专题研讨的主要内容之一,在Banff会议中专门设立了移植心脏病理学的专题会场,主要围绕移植心脏AMR病理学诊断及其进展等议题进行专题讨论[3-4]。
1.2 中国移植心脏病理学研究的简史
中国首例心脏移植于1978年由张世泽等在上海瑞金医院实施,也是亚洲首例原位心脏移植,受者存活了109 d。随着近年来心脏移植技术的提高和公民逝世后器官捐献的实施,心脏移植例数稳步增长。自2003年上海中山医院王齐兵等率先报道了移植心脏冠状动脉血管病(transplant coronary artery disease,TCAD)的研究病例开始,部分心脏移植中心逐渐开展了移植心脏的病理学研究,其中尤其是中国医学科学院阜外医院系统地开展了大例数的移植心脏EMB和病理学研究[5-6],良好地指导了临床移植心脏并发症的治疗和管理。
2 移植心脏术后主要并发症及其病理学诊断标准
无论是单纯心脏移植还是心肺联合移植,是儿童心脏移植或是成人心脏移植,移植心脏均具有基本相同的病理组织学表现,这有利于我们在不同类型的心脏移植术后利用EMB的组织病理学观察诊断其术后并发症。目前已明确,在心脏移植术后的不同阶段,可以出现移植心脏右心室衰竭(right ventricular failure,RVF)、缺血-再灌注损伤、急性排斥反应、“Quilty病变”、感染和以TCAD为特征的慢性排斥反应(chronic rejection,CR)等一系列并发症。以下结合心脏移植术后主要并发症及其ISHLT标准予以阐述。
2.1 移植心脏右心室衰竭
移植心脏RVF主要于心脏移植术中立即发生,在未关闭胸腔前可见移植心脏心室收缩减弱,心室扩张并可见心脏外观因心肌间质出血而呈暗紫色。造成这一现象的原因是多方面的,最常见的原因是肺动脉高压所致的肺动脉阻力升高,这一因素可以通过移植术前对受者进行详尽的体检予以排除或改善,因而目前这一因素导致的RVF已非常少见了。即便受者确实存在明显的肺动脉高压,可以选择施行心肺联合移植。其它偶尔可导致移植心脏RVF的原因包括供者在捐献前的紧急抢救过程中使用了大量的心肺复苏药物而导致心肌细胞功能超负荷甚至衰竭。移植心脏RVF的组织病理学表现缺乏特异性,主要为右心室心肌组织内弥漫性出血,有时可见为微血管内纤维素样血栓栓塞,甚至部分病例由于发展迅速而没有明显的组织病理学表现,只有结合临床发生的时间予以综合判断。
2.2 移植心脏缺血-再灌注损伤
移植心脏缺血-再灌注损伤主要为心脏的缺血损伤和血管吻合再通后的再灌注损伤,其次与供者严重的颅脑损伤、蛛网膜下腔出血、儿茶酚胺的大量释放等也有关,部分文献将其笼统地称为移植前损伤(pre-transplant injury),主要出现于术后几周尤其是最初的3周内。
对于缺血-再灌注损伤,移植心脏EMB表现为小灶状的心肌溶解性坏死(图1),国外文献中有时称为“心肌缺失(dropout)”,少数表现为心肌缺血性坏死或凝固性坏死(coagulation necrosis),也可以称为微梗死。其可能的原因除心肌的直接缺血损伤外,心脏切取或移植过程中的微小空气栓子所造成的微小栓塞也是一种原因。凝固性坏死的心肌细胞嗜酸性染色明显增强,胞核固缩甚至消失。缺血性坏死灶内发生完全或不完全坏死的心肌细胞固缩而与其周围正常心肌细胞之间形成较为明显的空隙,这在应用Masson三色染色时尤其明显。严重的缺血性损伤时还可出现心肌间质内明显的出血。如果缺血性病变在一定时间内如1周左右,有时可见坏死灶周围存在少数中性粒细胞浸润,以及少许增生的肉芽组织。就单纯的缺血性损伤或是移植后血液循环恢复后的缺血-再灌注损伤的精细组织学比较研究而言,前者的心肌损伤或坏死灶的部位主要位于心内膜下心肌组织内,而后者多见于深部心肌组织内。而在实际情况中,两者常混合存在而难以截然分开。对于供者的严重颅脑损伤、儿茶酚胺大量释放所致的心肌细胞损伤,主要表现为心肌细胞或心肌纤维断裂、心肌细胞固缩及嗜酸性坏死,坏死心肌细胞边缘有少量中性粒细胞浸润。
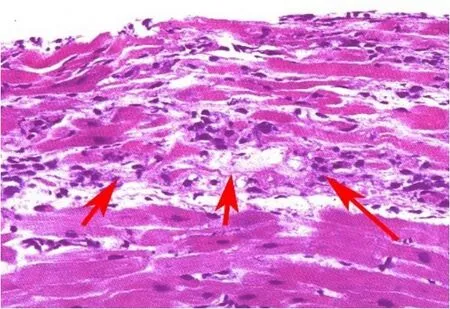
图1 移植心脏缺血-再灌注损伤的病理学表现Figure 1 Pathological findings of ischemia-reperfusion injury in heart allograft
2.3 升压药物导致的移植心脏损伤
在供者抢救复苏过程中以及心脏移植术中或术后均有可能使用大量儿茶酚胺等升压药物,由此形成术后早期阶段移植心脏的升压药物损伤或称为“儿茶酚胺效应”。其EMB活检组织中可见微小灶状心肌细胞轻微变性或坏死等损伤(图2),损伤灶内可有极少的包括中性粒细胞在内的混合性炎症细胞浸润。其诊断除观察到上述组织病理学表现外,还必须有儿茶酚胺等升压药物应用史。这一药物损伤与急性排斥反应的鉴别诊断要点为,前者损伤灶中仅有极少数炎症细胞浸润,而后者即急性排斥反应时一般有较多的以淋巴细胞为主的炎症细胞浸润。
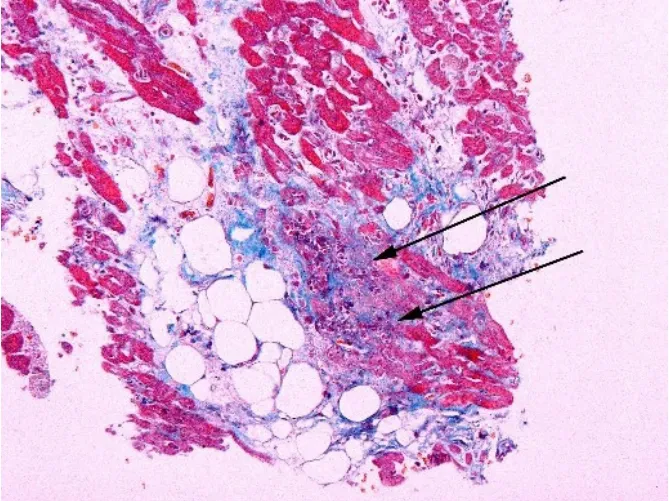
图2 移植心脏“儿茶酚胺效应”的病理学表现Figure 2 Pathological findings of catecholamine effect of the heart allograft
2.4 移植心脏排斥反应
目前移植心脏的排斥反应已经明确依照排斥反应的免疫效应机制分为TCMR和AMR两种类型,其EMB活检中排斥反应均依次进行诊断。其中既往所谓的超急性排斥反应(hyperacute rejection,HAR)实则是严重的、迅猛发生的急性AMR(acute AMR,aAMR),应归入AMR的诊断类别中;同时也要注意在实际的急性排斥反应病例中,往往急性TCMR(acute TCMR,aTCMR)和aAMR伴同发生,称为混合性排斥反应。在此仅简要介绍HAR和混合性排斥反应,而着重阐述aTCMR和aAMR的病理学特点,两者最终将共同导致CR。
2.4.1 超急性排斥反应 HAR作为移植术后最严重的排斥反应,一旦发生常难以逆转,所以其关键在于术前预防。目前因术前良好的免疫学选择,心脏移植HAR已非常罕见。其致病机制为受者体内的预存抗体(performed antibody)与移植心脏移植抗原结合后迅速激活补体级联反应并活化血小板,导致移植心脏血管内皮损伤及广泛的微血栓形成,造成严重的血液循环障碍及心肌组织损伤。形成HAR的原因主要为供、受者ABO血型不相容或主要组织相容性复合体(major histocompatibility complex,MHC)抗原不匹配,也有报道是由于受者迅速产生了抗供者内皮细胞等移植抗原的抗体所致,由于其主要由抗体及补体等参与,可见是一种典型的AMR。
发生HAR时,移植心脏迅速出现心律失常甚至搏动消失,肉眼可见移植心脏迅速肿胀,颜色迅速变为暗红色甚至暗紫色,除非立即建立心脏辅助系统或者马上能获得新供心,否则受者将难以存活。对切除的移植心脏的病理解剖学观察可见心脏明显肿大并呈出血状外观(图3)。镜下可见,心肌组织内广泛水肿、出血、大量中性粒细胞浸润甚至大片心肌出血性及溶解性坏死,细小血管内有大量红细胞淤积甚至可见较多的纤维素样血栓。补体片段C4d的免疫荧光或免疫酶组织化学染色可协助确诊。

图3 移植心脏HAR的大体解剖学观察Figure 3 Gross anatomical observation of hyperacute rejection of heart allograft
2.4.2 急性T细胞介导的排斥反应 aTCMR或称ACR多数发生于术后3个月内,但也可见于心脏移植术后长期存活的受者中,尤其是长期存活的受者因药物依从性不佳,自行停用或减量免疫抑制剂,可发生严重的aTCMR。发生aTCMR的移植心脏,其大体标本的肉眼观可见移植心脏肿大、心室壁增厚,严重时出现明显的心室肌因出血而呈花斑状、心室切面可见部分区域因凝固性坏死呈灰白色。移植心脏aTCMR的组织病理学改变最显著的部位位于心室肌,尸体解剖学研究显示两侧心室均可相同程度地被累及,这也是依据EMB对aTCMR进行明确诊断的主要依据。
在EMB活检组织病理学上,不同程度的aTCMR在心肌间淋巴细胞浸润数量及心肌损伤程度上是不同的,借此不仅可对aTCMR予以定性诊断,而且可以予以程度分级。轻微的aTCMR表现为少许单个核炎症细胞(包括淋巴细胞和巨噬细胞等)的微小灶状浸润,心肌间质可无水肿,心肌细胞已基本正常;程度较重的aTCMR可见炎症细胞呈多灶性甚至呈弥漫性浸润,心肌间质水肿甚至心肌细胞坏死,而aTCMR最为特征性的表现为冠状动脉分支出现动脉内膜炎,其病变包括内膜上以单个核细胞为主的炎症细胞浸润、内皮细胞肿胀、内膜水肿增厚甚至泡沫细胞形成,最为严重者导致动脉管壁纤维素样坏死。依据2004年ISHLT标准[7],aTCMR分为0~3级4个级别。
2.4.2.1 0级(无急性排斥反应) 即移植心脏EMB活检组织内,镜下无炎症细胞浸润以及心肌细胞损伤等aTCMR的组织病理学改变。而在实际的情况下,有时心肌内可见极个别散在的炎症细胞浸润而没有其它特征性的组织学表现也应诊断为0级。因为EMB常重复多次进行,在前次活检部位存在的小块瘢痕组织内以及心肌细胞周围脂肪组织内偶尔有极少许的炎症细胞浸润,但心肌组织未见其它异常时也可诊断为0级。
2.4.2.2 1R级(轻度,低级别aTCMR) EMB活检组织内仅有单个的、微小局灶性的炎症细胞浸润,心肌细胞没有或仅有轻微的损伤改变。其中一种表现为微小局灶性浸润的单个核细胞位于小血管旁或围绕小血管周围呈围管状浸润,而此时没有心肌细胞损伤(图4);另一种情况为小灶状的炎症细胞浸润的范围较之前一种情况略大,不仅可以围绕在小血管周围,而且可向小血管周围邻近的心肌组织内扩展,部分文献中将这一特征称为“局灶性的弥漫浸润(focally diffuse in filtration)”,其可以理解为浸润为局限性,但部分炎症细胞有向周围浸润扩展的趋势。这一变化可见于1粒或多粒EMB活检组织中,此时心肌细胞正常或仅表现为心肌细胞肿胀。
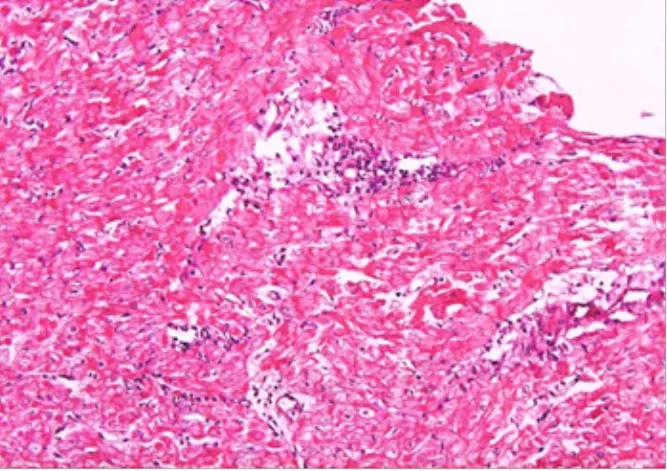
图4 移植心脏1R级aTCMR的病理学表现Figure 4 Pathological findings of grade 1R aTCMR of heart allograft
2.4.2.3 2R级(中度,中间级别aTCMR) EMB活检组织内呈多个局灶性的炎症细胞浸润并出现了明显的心肌细胞损伤改变。即在单独1粒或多粒EMB活检心肌组织内出现多个局灶性的、数量较多的炎症细胞浸润(图5),有时也混有少许嗜酸性粒细胞和中性粒细胞,多个炎症细胞浸润灶之间仍可见正常的心肌组织间隔而尚未形成完全弥漫性的浸润,但可见其中炎症侵蚀至少造成2~3处心肌细胞损伤导致心肌细胞轮廓不清似呈坏死而缺失,有时可见浸润灶内的个别心肌细胞呈凝固性坏死。
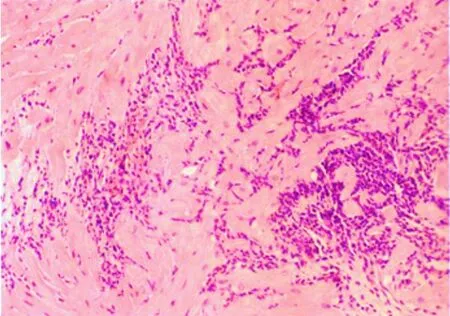
图5 移植心脏2R级aTCMR的病理学表现Figure 5 Pathological findings of grade 2R aTCMR of heart allograft
2.4.2.4 3R级(重度,高级别aTCMR) EMB活检组织内呈弥漫性炎症细胞浸润、心肌细胞损伤甚至出现动脉内膜炎改变。炎症细胞浸润累及所有的活检组织块,每一活检组织块内的炎症细胞浸润密集且广泛(图6A),炎症细胞的种类由单一的单个核细胞转变为包括中性粒细胞和嗜酸性粒细胞等在内的多种细胞;多个心肌组织内的心肌细胞坏死;如果活检组织内能够取得冠状动脉位于心肌间的末梢分支,则可见明显的动脉内膜炎(图6B),甚至动脉内膜水肿以及管壁纤维素样坏死改变,这是移植心脏aTCMR中程度最重的一种类型。

图6 移植心脏3R级aTCMR的病理学表现Figure 6 Pathological findings of grade 3R aTCMR of heart allograft
2.4.3 急性抗体介导的排斥反应
2.4.3.1 移植心脏急性抗体介导的排斥反应概述 移植心脏aAMR最初由Hammond等于1989年在EMB活检组织中发现,其观察到在缺乏明显TCMR特征和缺血损伤改变的心肌组织下,出现心肌间MI、心肌间质显著水肿并可见多种类型的免疫球蛋白(immunoglobin,Ig)的阳性沉积,且更易于进展为CR的动脉血管病。移植心脏aAMR的发生率随诊断标准的不同而差异很大,在活检后依据Ig的免疫荧光染色阳性,其发生率高达28%~52%,采用观察免疫荧光染色联合微血管内皮细胞损伤水肿这一指标时,其发生率为19%,增加心功能异常指标时则为8%~15%,而如果加上C4d染色阳性指标时则仅为3%[8]。
aAMR在1990年ISHLT标准中即予以提出,但由于缺乏AMR的组织病理学诊断标准,既往对EMB活检组织的冰冻切片进行免疫荧光染色,经研究发现IgG、IgM、C1q、C3和纤维素等均缺乏诊断的特异性,直到2003年Banff会议确定了在移植肾活检组织的AMR诊断中应用C4d免疫组织化学染色方法,进而将C4d染色也应用于移植心脏AMR的活检诊断中,促进了其AMR诊断标准的建立。在2004年ISHLT标准中明确将aAMR作为一项与aTCMR同等的病理学诊断类别,并尝试单纯依据组织病理学改变对其予以诊断和程度分级。2015年Banff会议是近年来对移植心脏aAMR进行最全面的讨论和总结的一届Banff会议[9],其明确提出移植心脏aAMR的核心病变为MI,其特征性改变为心肌间毛细血管扩张以及管腔内可见活化的单个核细胞(intravascular activated mononuclear cell,IAMC)淤积浸润(图7A),进而与活检心肌组织的C4d染色(图7B)相结合共同体现了aAMR对微血管的炎症损伤,也据此作为诊断aAMR的组织病理学依据:即>50%的毛细血管内皮呈C4d+(无论是呈多灶性或弥漫性),或者≥10%的毛细血管腔内有CD68+巨噬细胞淤积浸润。同时也为了避免单纯的HE染色的局限,建议采用可以识别血管内皮细胞的CD31或CD34和可识别巨噬细胞的CD68进行双重染色,以准确识别毛细血管内的巨噬细胞。同时对其后续的研究也提出了多种设想,包括:(1)希望借鉴移植肾aAMR诊断中关于肾小管周毛细血管炎(peritubular capillaritis,PTC)的量化评分标准对IAMC予以量化评分,即通过计数毛细血管横截面内浸润的巨噬细胞的数量对aAMR予以程度评分,并希望有更多的多中心研究予以确认;(2)推荐经活检提示aAMR的心脏移植受者均必须进行供者特异性抗体(donor specific antibody,DSA)监测;(3)由于AMR机制的明确,其导致的移植心脏慢性失功的“CR”这一笼统性的术语不足以精确体现AMR的致病机制,应考虑采用“慢性抗体相关性的移植心脏损伤(chronic antibody-associated allograft damage)”这一术语。
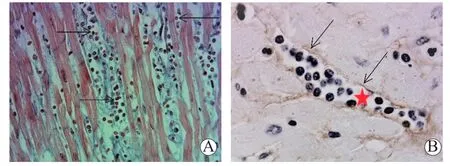
图7 移植心脏aAMR的病理学表现Figure 7 Pathological findings of aAMR of heart allograft
2.4.3.2 移植心脏急性抗体介导的排斥反应的病理学诊断及其分级 1990年、2004年和2013年ISHLT标准中陆续确认了AMR这一病理类型,在2013年ISHLT标准中依据EMB活检的组织病理学表现对aAMR予以诊断和分级(表1)[2],完全基于病理学的诊断(pathology-based AMR,pAMR)和分级,其所依据的核心内容为aAMR所致的MI病变,其病变包括两个方面:(1)心肌间毛细血管内巨噬细胞的淤积浸润,有时可见血管内皮细胞水肿;(2)结合C4d和(或)CD68的免疫荧光或免疫组化染色表现。病理学分级包括:(1)pAMR0,为组织病理学中完全未见MI病变和C4d染色为阴性,即未见任何aAMR损伤表现;(2)pAMR1(H+),可见MI的组织病理学表现但C4d和(或)CD68染色呈阴性;(3)pAMR1(I+),未见MI的组织病理学表现但C4d和(或)CD68染色呈阳性;pAMR1(H+)和pAMR1(I+)均是轻微的aAMR级别;(4)pAMR2,同时具备了MI的组织病理学表现和C4d和(或)CD68染色阳性,是明确的、病理学特征完整的aAMR,是中度的aAMR ;(5)pAMR3,出现了显著的组织病理学损伤表现包括微血管内血栓栓塞、间质出血即间质内包括淋巴细胞以及混合中性粒细胞等多形核细胞浸润和心肌细胞坏死,也具备C4d和(或)CD68染色阳性,是重度aAMR。在应用这一标准对移植心脏EMB活检组织进行病理学诊断时,需要注意,该标准仅是单纯的病理学诊断,仍然必须结合临床心功能检查和DSA监测予以综合诊断。

表1 移植心脏AMR的病理学诊断分级(2013年ISHLT标准)Table 1 Pathological diagnosis classification of AMR of heart allograft (2013 ISHLT working formulation)
2.4.4 慢性排斥反应 既往认为移植心脏的CR仅是细胞免疫所损伤的结果,但是随着AMR损伤机制的明确以及这一机制的作用更为显著,虽然目前仍未有慢性AMR(chronic AMR)这一名称,但应该认识到“CR”这一名词的内涵已经扩展了。
移植心脏CR的核心病变位于冠状动脉尤其是其广泛的末梢分支,形成以TCAD为特征的CR病变。TCAD病变虽然累及冠状动脉,但在EMB活检细小心肌组织中,心肌间的末梢分支亦可观察到这一病变而进行诊断,这也体现出EMB对移植心脏CR也是具有诊断价值的。
2.4.4.1 移植心脏冠状动脉血管病概述 围绕移植心脏CR所致冠状动脉血管病的名称有多种,包括移植心脏血管病(cardiac allograft vasculopathy,CAV)、移植物动脉血管病、加速性移植心脏动脉硬化、移植心脏闭塞性动脉血管病、移植心脏内膜增生性疾病和TCAD等。多数文献倾向于采用CAV或TCAD这一名称[10]。虽然名称略有不同,但其组织病理学表现是相同的。
移植心脏TCAD最突出的形态学表现为移植心脏冠状动脉血管管腔向心性狭窄、局部阻塞甚至完全闭塞,导致移植心脏心肌缺血及功能障碍,是心脏移植后长期存活者的主要致死原因。其致病机制中,免疫损伤因素起到了关键作用,其中也包括移植心脏内冠状动脉血管分支及其毛细血管内皮细胞所携带的移植抗原诱导受者产生针对性的DSA,继而导致补体活化、细胞因子释放、中性粒细胞和巨噬细胞浸润甚至血栓形成等体液免疫因素的损伤,这也是移植心脏的TCAD与普通冠状动脉粥样硬化的主要区别。在平均存活>1年的心脏移植受者中,经EMB证实,其中93%的移植受者存在不同程度的CR表现,86%的移植受者存在明显动脉血管内膜增生的改变,92%的移植受者存在不同程度的心肌组织缺血坏死及修复后微小瘢痕灶,且29%存在持续的急性排斥反应。Loupy等[11]结合40例切除的失功能的移植心脏及其402例次EMB的病理学观察和抗体检测的研究,结果显示在47.5%的失功能的心脏移植受者体内检测到抗体、移植心脏术后均经历过未能明确诊断的亚临床aAMR、切除移植心脏中存在AMR病变者,其MI损伤计分和血管内皮炎计分均显著高于无AMR的移植心脏,而且在62.1%的具备TCAD病变的切除移植心脏中均观察到aAMR病变。这一详细的病理学观察明确提示AMR在移植心脏CR尤其是TCAD中发挥了关键的致病作用,这也是近年来部分研究者提出应将AMR损伤因素进一步予以凸显,而应称为“慢性抗体相关性的移植心脏损伤”的原因所在。
2.4.4.2 移植心脏冠状动脉血管病的病理学 代表移植心脏CR的关键病变即TCAD为移植心脏冠状动脉及其分支因内膜反复的免疫损伤导致内膜增生,进而动脉管腔向心性狭窄,并且这一病变弥漫性地累及几乎所有冠状动脉分支。这一病变与冠状动脉粥样硬化病变有明显的区别, 后者通常表现为仅在冠状动脉管壁一侧,因脂质沉积损伤与修复而增厚,即仅累及冠状动脉的某一局部,而移植心脏TCAD则累及冠脉的所有分支甚至心肌间末梢分支。
2.4.4.2.1 肉眼所见 典型的移植心脏CR时,肉眼可见心脏不同程度的肥大,心脏外观可以有很大差异,有的表现正常,有的表面可见梗死后纤维化形成的瘢痕。心脏切面可见心室等部位有明显的心肌梗死瘢痕,并同时可见新的心肌梗死灶。心脏表面冠状动脉主干分支的横断面检查,可见管壁均匀性增厚及管腔向心性狭窄,沿血管长轴剖开可见内膜常有黄色脂质斑块。移植心脏冠状动脉分支的整个血管树即不同管径的各级动脉均可被累及,其中管径>100 μm的动脉血管可全部累及,部分管径50~100 μm的动脉血管也可被累及,管径<40 μm的、缺乏完整中膜平滑肌的血管也可被累及。
2.4.4.2.2 镜下所见 病变包括冠状动脉血管内膜显著增生,增生血管内膜中的细胞成分主要为大量增生的平滑肌细胞、纤维母细胞、吞噬了大量脂质的巨噬细胞或称为泡沫细胞以及不同程度的淋巴细胞,同时伴有胶原增加及脂质沉积,增厚的血管内膜致管腔狭窄甚至闭塞(图8)。TCAD时,心肌组织由于不同部位、不同程度的缺血呈局灶性梗死,梗死灶部位心肌纤维支架塌陷并有灶状淋巴细胞浸润,随后梗死灶由纤维瘢痕组织取代。严重的TCAD所致的缺血损伤可致心室尤其是右心室心肌组织内大量心肌细胞梗死并逐渐为纤维组织所取代。移植心脏冠状动脉是形成TCAD的主要部位,而各级静脉的分支基本不出现与动脉类似的病变。

图8 移植心脏CR的TCAD病理学表现Figure 8 Pathological findings of TCAD of CR of heart allograft
对于诊断移植心脏急性排斥反应非常有价值的EMB,在TCAD诊断上的作用有限,这是由于EMB取材部位非常表浅而且标本量非常少,无法活检钳取到深部的心肌组织,更难以取得管径略大的冠状动脉血管分支以观察TCAD的血管病变,而且部分心内膜下浅表部位的心肌组织得益于心内膜下滋养血管的血供,可以没有明显的心肌缺血性改变,因而造成EMB未能及时诊断TCAD相应的心肌损伤的现象,因此在EMB的活检组织中仅能通过观察是否存在心肌缺血性损伤以及结合心脏移植术后的存活时间间接提示移植心脏可能存在一定程度的动脉血管病变,并进一步进行移植心脏冠状动脉血管造影等影像学检查以最终明确TCAD的诊断。在CR中,一个值得注意的现象是部分典型的CR病变中常常同时伴有不同程度的甚至严重的aTCMR和(或)aAMR等急性排斥反应,有报道显示有大约27%的移植心脏CR中合并有急性排斥反应,更进一步说明免疫学损伤因素在CR病变中的致病作用。
移植心脏TCAD病变应与非移植心脏的动脉粥样硬化相鉴别,两者鉴别的要点在于移植心脏TCAD为内膜全周的向心性增厚而非动脉粥样硬化的动脉管壁一侧显著增厚;TCAD累及冠状动脉分支全境,大、中、小各级分支均可被累及,而动脉粥样硬化主要累及动脉主干如升主动脉、腹主动脉等;TCAD较之非移植心脏的动脉粥样硬化进展更快速,但通常不合并粥样斑块内的钙化。
2.4.5 移植心脏“Quilty 病变”(心内膜下炎症细胞浸润) 移植心脏“Quilty 病变”或称“Quilty 效应”,也可称为移植心脏心内膜下炎症细胞浸润。“Quilty病变”的定义及其组织病理学特征为位于移植心脏心内膜下部位的、局灶性的、密集的单个核细胞浸润(图9),可伴或不伴有急性排斥反应。在心脏移植术后稍长时间如1个月或数月以后,以及更长期存活者的EMB活检组织内,常可见到心内膜下局灶性或沿心内膜下弥漫性、密集的单个核细胞浸润现象。最初结合其形态学特征称为心内膜下炎症细胞浸润、类淋巴瘤病变或心内膜炎症细胞浸润。其于1981年由美国Stanford大学的Billingham最先报道并以出现该病变的移植受者的姓氏命名为“Quilty病变”或“Quilty损伤”。其在心脏移植受者的EMB活检组织中的出现率约为14%,而Stanford大学医学院的Joshi等对移植心脏“Quilty病变”进行的大样本的EMB研究显示,其总体发生率为51.46%,其中在成人心脏移植受者中的发生率为49.77%,在儿童心脏移植受者中的发生率为68.18%,可见其在心脏移植受者中的发生率较高。“Quilty病变”内浸润的细胞有多种类型,主要包括T淋巴细胞、浆细胞和巨噬细胞,其中以T淋巴细胞为主,其次为浆细胞。T淋巴细胞中又以CD 4+T淋巴细胞为主,其与CD 8+T淋巴细胞的比例为2~3∶1。也有个别的研究显示以B淋巴细胞为主,此外偶尔有少许巨噬细胞、嗜酸性粒细胞和中性粒细胞。其中淋巴细胞可具有不同成熟阶段的不同细胞形态。虽已有大量关于“Quilty病变”产生机制的动物和临床研究,曾经提出与免疫抑制剂环孢素的应用、EB病毒感染、早期急性排斥反应以及移植后淋巴组织异常增生等因素有关,但仍无法明确。“Quilty病变”与急性排斥反应的关系一直存在争议,且因为两者组织病理学表现相似,其鉴别诊断也令人困惑,进一步对EMB活检组织予以不同角度的、连续地、深层的切片,以及全面观察所有的活检组织块,有利于鉴别诊断[12-13]。
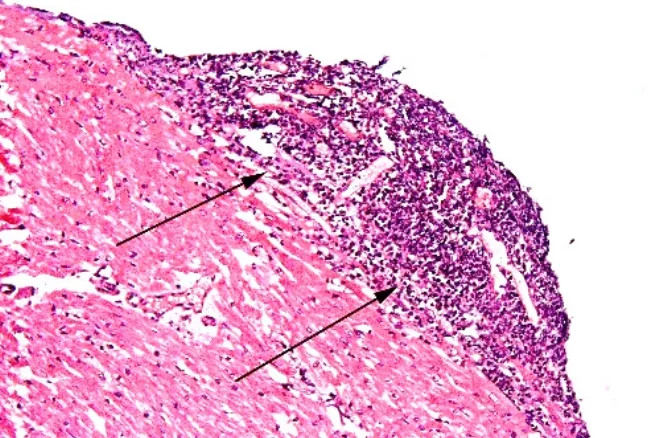
图9 移植心脏“Quilty病变”的病理学表现Figure 9 Pathological findings of Quilty injury of heart allograft
2.4.6 感染性心肌炎 由于术后免疫抑制剂的大量应用,受者机体免疫力明显下降,感染性心肌炎亦是心脏移植术后的并发症之一。心脏移植后最常见的机会性感染为细菌感染,占整个术后感染的50%,其次为病毒感染,占40%,此外真菌感染及寄生虫感染各占5%。而在移植心脏EMB活检组织以及死后尸检组织中最常见的为巨细胞病毒(cytomegalovirus,CMV)和弓形虫感染。器官移植中CMV感染的方式主要为CMV阴性受者接受了CMV阳性供者的心脏或输入了CMV阳性的血液制品[受者(recipient,R)–/供者(donor,D)+],这是最常见也是最重要的CMV感染方式,这种方式称为原发性感染;其次为继发性感染或称再次激活性感染,即受者术前隐性感染CMV病毒而呈CMV阳性,在移植术后因免疫抑制剂的应用,机体免疫功能低下后导致病毒再度活化(R+/D–);最后一种情况即CMV阳性的受者又再次感染不同株的CMV病毒形成的再次感染(R+/D–),有时也称为超感染。Stovin等曾报道,心脏移植受者临床出现明显的CMV活性感染时未见心肌活检组织内浸润淋巴细胞数量的明显增加。
2.4.7 供心的感染 庆幸的是,供心的感染在心脏移植中十分罕见,但移植病理科医师在诊断中应具备警惕性。其中主要为供心的弓形虫感染,因为感染时常常没有明显的临床表现,而且在心内膜活检组织学诊断中很难与轻度的急性排斥反应相鉴别,需要借助活检组织的电镜检查以及血清学检查予以明确。
2.4.8 移植心脏心肌组织内营养不良性钙化 移植心脏心肌组织内有时可见钙化即局部的小灶状钙质沉积称为营养不良性钙化。其形成的原因可能与环孢素、脓毒血症、贫血、低镁血症、糖皮质激素(激素)应用以及酗酒等有关。组织学上可见心肌细胞或心肌间质内有暗蓝色或蓝紫色细小颗粒样钙质沉积,颗粒直径为1.0~2.5 μm,如果钙质较多可覆盖整个心肌细胞甚至多个心肌细胞。
2.4.9 心肌缺血损伤 相对于移植术后近期内出现的缺血改变,在术后长期存活受者中也可能由于TCAD等原因导致心肌缺血,因此ISHLT标准中建议在明确存在缺血损伤的前提下,进一步对其组织病理学改变划分为A级和B级两个级别。其中A级定义为出现在移植术后3周内,主要由于术前或术中的缺血或再灌注损伤所致,称为移植术前损伤;而B级则主要出现于稍晚,常为术后3个月或3个月以上的心肌缺血损伤,称为晚期缺血变化,其原因为TCAD的可能性较大。移植心脏缺血损伤后常没有明显的临床症状,而坏死等损伤的修复可因免疫抑制剂的应用而延迟,也有报道缺血损伤可进展为移植心脏间质纤维化。
2.4.10 EMB活检标本中的脂肪组织 心脏的多数脂肪组织分布于心外膜,心肌内仅有极少许脂肪组织,主要分布于心内膜下以及少许位于心肌组织内(图10)。移植心脏EMB活检标本中如果发现脂肪组织或脂肪细胞应予以仔细鉴别其来源,以明确其来源于心内膜或心外膜。如果脂肪组织表面可检见间皮细胞则表明脂肪组织来源于心外膜,如果在脂肪组织周围发现交感神经组织也提示这一脂肪组织来源于心外膜,提示可能由于活检致心室穿孔。如果活检组织内仅有极少许脂肪细胞夹杂在心肌细胞之间,则提示为正常部位的右心室心肌组织,并且对于较为肥胖以及应用大量激素的移植受者,心肌组织内的少许脂肪细胞应视为正常。此外,在少数前次活检部位的活检组织中,增生的小瘢痕组织内有时也可有少许脂肪细胞。

图10 移植心脏活检标本中脂肪组织的病理学表现Figure 10 Pathological findings of adipose tissue in biopsy specimen of heart allograft
2.4.11 移植心脏的其他病理学变化 移植心脏EMB活检组织中的其他可能出现的组织病理学变化包括人为因素所致改变、组织标本的假象和与前次活检部位重叠所致的改变等3种情况。
2.4.11.1 人为改变 移植心脏EMB活检组织中的人为改变或称为“人为假象”,主要来自于EMB操作和后续病理制片中造成的人为改变两个方面。在EMB操作过程中尤其是在用活检钳口钳夹心肌组织时,由于钳夹及拉扯等机械力作用造成的心肌组织形态改变,如活检心肌组织上出现的钳夹夹痕、或形成“紧箍带”(图11);或者由于活检钳钳口的锋利度不够,在钳夹过程中,不能切断心肌组织而形成明显的活检钳拉扯痕迹。此外,同样原因也可以形成活检组织内的假性出血,这时可见活检组织周围包裹单一的、大量的红细胞而没有其它炎症细胞。如果这时钳夹的活检组织内有细小血管的分支,由于钳口不够锋利,在切割和拉扯过程中拉扯血管内膜和管壁组织,一旦切割完成,经剧烈拉扯的血管内膜或管壁平滑肌弹性回缩而进入血管腔内,可形成小血管栓塞或者内膜增生的假象;由于病理制片过程中心肌组织固定保存不佳,切片过厚等原因,在HE染色切片中造成部分心肌细胞嗜伊红染色过深,局部心肌细胞类似凝固性坏死。此外,由于未进行多角度、多层面的连续切片,未能发现心肌组织块深部的炎症浸润灶,而错失了本应建立的准确诊断等。为克服这一人为因素,应熟练EMB操作技术、选用良好的器械、在活检过程中精细操作,保护活检组织的原始状态,取材完成后不可人为夹捏、挤压或拉扯活检组织,也避免因不同的染色需要而分切活检组织,最大限度地避免对活检组织固有形态的人为破坏。

图11 移植心脏活检组织内人为假象的病理学表现Figure 11 Pathological findings of artificial artifacts in biopsy tissue of heart allograft
2.4.11.2 假象的识别 应用EMB诊断移植心脏排斥反应等并发症时,EMB活检组织内的一些假象可能会造成诊断偏差。这些偏差多数情况下常由于取样标本不足所致。由于程度较轻的急性排斥反应常为微小局灶性病变,应用EMB诊断时很容易发生取样不足所致的偏差,那么,需要钳取多少块活检组织呢?当然对于诊断的病理科医师而言,越多越好,这样可以明显提高样本的代表性和诊断的准确性,而在实际的活检中,活检手术医师尽可能钳取越少越好,这样尽可能地降低活检的风险。结合两方面的因素以及目前的经验,多数中心认为活检时必须选取3块以上的组织,以减少误差。有时活检样本也可能钳取到血栓、凝血块或心内膜下脂肪组织,当采到心内膜下脂肪组织时,常可见到因植入反应所致的少许炎症细胞浸润,尤其是移植术后最初2~3周,应与排斥反应区别。只有当炎症细胞浸润延伸到心肌组织时,方可考虑为急性排斥反应。如果脂肪组织包含有间皮细胞时,应警惕可能发生了心室穿孔。
2.4.11.3 EMB取材部位重叠 活检取材部位重叠即活检取材位于前次活检部位。在常规开展EMB的移植中心以及对于长期存活的心脏移植受者,通常会接受多次的EMB,而且每次EMB均要钳取数块心内膜组织,因而许多活检标本会重叠在以前的活检部位上。有报道术后第1年内大约需要接受15~20次的EMB,在此情况下,其中大约有50% 甚至更多的机会将会取材到以前的活检部位。之所以有如此高的重复活检到同一部位的几率,主要是由于绝大多数EMB均采用经颈静脉的路径、右心室内乳头肌固有的走行方向和心室收缩等原因,均容易引导活检钳进入右心室间隔的相应位置反复钳夹,使得在EMB中难以避免取到前次的活检部位。肉眼观,在心脏移植术后存活数月或1年以上者,如果接受过多次EMB,可见右室间隔壁上有多个直径大约1~2 cm的局灶斑片状增厚区域,组织病理学上可见局部肉芽组织或机化的纤维瘢痕组织,其中有轻微的炎症细胞浸润(图12),周围心肌纤维排列略为紊乱。近期活检者可见心肌间质内轻微出血。

图12 EMB活检组织取材重叠部位的病理学表现Figure 12 Pathological findings of overlapping site of EMB biopsy tissue
3 移植心脏排斥反应诊断研究的最新进展
截止至目前,虽然EMB仍然是诊断移植心脏排斥反应的金标准,但其固有的局限性限制了其更广泛的临床应用,这些局限性包括3个方面:(1)其为有创伤性的检查;(2)检查结果因标本质量或诊断者经验的不同而存在结果的差异;(3)往往由于需要连续多次的活检,部分心脏移植受者在术后第1年大约需要接受十余次的EMB,其医疗费用也是一项较重的负担。由此,在移植心脏排斥反应的诊断中,一直希望探索出一种可以取代EMB的、无创性的、安全、快速、费用低廉且可重复多次应用的诊断方法。近年来,基于最新的分子生物学技术,对移植心脏排斥反应的诊断研究进展很快,部分检测方法已经可以很好地协助临床预测急性排斥反应,从而在很大程度上避免不必要的EMB。
新的诊断方法的研究主要体现在两个方面。其中一方面仍然是基于EMB活检心肌组织的研究,充分利用活检心肌组织这一最能体现移植心脏病理损伤的宝贵标本资源,通过将多种最新的分子生物学检测技术应用于此,研究发生排斥反应等损伤时心肌细胞的病理生理改变、心肌细胞和多种炎症细胞的细胞因子及其信号通路、发现免疫调节药物的相应治疗靶点等[14-16]。这方面的研究中借助的技术主要包括二代测序(next-generation sequencing,NGS)、分子显微镜(molecular microscope)、心脏血管的MRI(cardiac MRI,CMR)和基因表达谱(gene expression profile,GEP)技术等。其中二代测序与逻辑回归分析模型相结合,检测经石蜡包埋的移植心脏EMB活检心肌组织内微小核糖核酸(micro RNA,miRNA),已经可以协助临床区分包括TCMR、AMR和混合性排斥反应在内的3种不同的急性排斥反应类型,进而通过大量研究建立ACR的计分阈值模型,对于高于其阈值的ACR的预测特异度和灵敏度可分别达到0.91和0.68[17],但其局限性在于miRNA分离方法的不同和EMB活检组织中混杂多种不同类型的细胞使得其结果差异很大;分子显微镜技术是检测排斥反应相关的转录组学和蛋白组学,尤其是aAMR时内皮细胞损伤中其转录组学的变化;而CMR是基于急性排斥反应时心肌间质水肿、炎症细胞浸润甚至心肌坏死时导致组织和细胞间的间隙增宽等空间结构改变,通过MRI对心脏收缩期和舒张期内心脏影像的精细观察予以诊断;EMB通过对活检组织内GEP进行研究[18],提示其损伤基因的表达明显早于TCMR发生,且血管炎相关GEP高表达者与预后不良相关[19]。
另一方面则是利用心脏移植受者血液、尿液等多种体液标本展开研究,即液态活检(liquid biopsy)。主要通过基因组学和蛋白质组学技术在受者外周循环血液中寻找和确定与排斥反应等相关的、可用于诊断的生物标志物。这些研究内容包括外周血白细胞中的GEP、细胞游离DNA(cell-free DNA)、心肌肌钙蛋白(cardiac troponins)、miRNA、细胞外囊泡(extracellular vesicle,EV)和DSA等多方面的研究[20-22]。
在ISHLT标准中的重度aTCMR时,外周血内排斥反应损伤相关的GEP表达显著升高,而低于特定阈值者则少有发生严重的aTCMR,其对术后1年内不发生aTCMR者的预测值即阴性预测值可高达99.6%。而且目前已经有商业化的GEP技术平台(ALLOMap®)在欧洲和美国的多个心脏移植中心得到应用,其对心脏移植术后2个月、6个月和1年的受者分别检测其GEP表达水平,低于特定阈值者发生急性排斥反应的风险明显降低,从而可以显著降低EMB的诊断需求[23]。
供者来源性细胞游离DNA(donor-derived cellfree DNA,dd-cfDNA)是来源于供者心脏的心肌细胞,是在缺血或排斥反应等损伤导致心肌细胞凋亡甚至坏死时释放入外周血内的微小DNA片段。最常见的为女性受者接受男性供者心脏移植后,受者外周血中可检测到男性供者的Y染色体,提示移植心脏受到损伤。目前随着dd-cfDNA检测技术的飞速发展,不仅可以检测男女不同性别的、也可以检测供、受者双方的dd-cfDNA,其不仅可以检测ISHLT标准中重度的aTCMR,而且也逐渐扩展到可检测轻度aTCMR,其对中度aTCMR判断的阴性预测值可达100%,其判断的特异度和灵敏度已经分别可以达到0.754 8和1.000 0[24]。
心肌肌钙蛋白是严重心血管疾病所致的心肌细胞损伤的标志物,在中至重度aTCMR时亦可显著升高和释放入血[25]。近来Erbel等[26]在血浆中确立了高敏感性的心肌肌钙蛋白检测阈值为33.55 ng/mL,其灵敏度和特异度分别高达0.909 1和0.709 7,低于此阈值的移植心脏5年存活率显著提高,但其局限性在于其他造成心肌损伤的因素亦可造成其指标水平升高,并非仅见于急性排斥反应。
EV是一种由细胞产生和释放到细胞外基质中的膜性小囊泡(直径30~150 nm),广泛地存在于各种体液和细胞上清液中,其携带重要的生物信号,是特异性的细胞功能性囊泡,参与到细胞通讯、细胞迁移、细胞生长和细胞免疫等多种细胞生物学行为中,其主要包括微囊泡(microvesicle)、外泌体(exosome)和凋亡小体(apoptotic body),在急性和(或)慢性损伤引发的适应性炎症反应等病理生理状态下,常伴有特异性的EV产生及释放,进而可以作为无创性的诊断标志物予以检测,其不仅促进T淋巴细胞免疫活化信号的传导,而且也携带和表达Ⅰ类和Ⅱ类的MHC抗原分子,在T淋巴细胞活化中发挥抗原提呈作用;此外,部分由成熟的树突状细胞产生的外泌体可促进淋巴结中特定区域内的淋巴细胞归巢,从而发挥T淋巴细胞活化和免疫放大效应,借此可通过检测血液中供者MHC特异性EV而诊断T细胞介导的aTCMR[27-28]。
通过上述多方面的研究,希望能够像移植肾的无创性诊断中所初步建立的、通过多中心参与的、大样本量研究确立的类似于iBox模型一样的诊断预测模型,以期可以实际应用于心脏移植排斥反应的预警和诊断,可以最终替代有创性的EMB,使移植心脏排斥反应的诊断更安全、便捷、经济和可重复使用。同时也需要注意,由于新的检测方法技术要求高,方法和结果有待验证和统一以及检测费用仍偏高等多种客观因素,在其尚未能应用于临床时,对于高度提示排斥反应等并发症的心脏移植受者,及时采用EMB活检病理学诊断仍是必不可少的[29]。
4 小 结
对移植心脏排斥反应等并发症及时、准确的诊断,是保障移植心脏和受者长期存活的重要先决条件。通过移植心脏的EMB可对移植心脏的排斥反应、感染性心肌炎、“Quilty病变”等多种并发症予以明确诊断,截止至目前其仍是多种并发症诊断的最有效手段。同时,由于其EMB固有的有创性和近年来无创性分子生物学检测方法的开发与临床应用,EMB已经不作为诊断急性排斥反应的唯一途径,但是对于难以鉴别的急性排斥反应尤其是aAMR的鉴别诊断,借助EMB观察MI病变,对于及时诊断aAMR仍是非常有帮助的。因此,一定程度上,EMB仍是诊断和鉴别移植心脏并发症的有效手段之一。同时,也期待不久的将来,新的更加安全、便捷和经济的检测手段可以常规应用于心脏移植,使更多的心脏移植受者受益,以更好地保障移植心脏和受者的长期存活。
