石榴花游离型和结合型多酚提取物抗氧化活性探究
2021-11-14车一鸣黄斯琦赵立鹏
杨 锟,车一鸣,黄斯琦,赵立鹏,罗 瑜
(云南农业大学食品科学技术学院,云南昆明 650201)
石榴花(Punica granatumL.)属落叶灌木或小乔木石榴科石榴属植物石榴的花,花蕾为红色[1]。在《本草纲目》记有:“榴花主治:阴干为末,和铁丹服,一年变白发如漆”。据相关文献报道[2-6],石榴花含丰富酚类、黄酮、鞣质、糖类、色素和微量元素等成分,其粗提物具有较好的抗氧化、抗衰老、降血糖、降血压、降血脂和抗动脉硬化等药理作用。初夏时节,石榴种植户一般在石榴花刚现蕾时去掉不能结实的钟状花,其后生长过程中大部分不能正常结果的花亦会自然脱落,因此,石榴花的可利用资源非常丰富。
目前国内外的研究主要集中在石榴产品的加工与保健作用,石榴皮、籽、花提取物的抗氧化、抗病毒、抑菌、防癌、降血糖等作用[7-12],也有对石榴花精油抗氧化能力、石榴花红色素的提取分离、石榴花中葡萄糖苷酶抑制剂筛选等的研究[13-14]。目前针对石榴花中游离型和结合型多酚粗提物的提取测定和体外抗氧化活性研究较为少见。因此,本研究采用体外化学试剂法测定石榴花多酚粗提物的抗氧化能力,运用评价简单、灵敏度较高的吸收过氧自由基能力法(oxygen radical absorbance capacity,ORAC)[15],较为前沿、检测迅速且对样品中水溶性和脂溶性成分均能测定的清除过氧自由基能力法(peroxyl radical scavenging capacity,PSC)[16],还有常用的DPPH 自由基清除法(DPPH radical scavenging activity,DRSA)[17]、总氧自由基清除法(trolox equivalent antioxidant capacity,TEAC)[18]和还原力能力法(reducing power,RP),通过测定可对石榴花两种类型多酚粗提物的抗氧化活性进行一定评价,在一定程度上揭示石榴花多酚粗提物的抗氧化能力,对石榴花这一生物资源的开发利用提供一定的理论依据。
1 材料与方法
1.1 材料与仪器
石榴花 来自云南蒙自某石榴种植场,收集自然掉落的完整石榴花,自然通风晾干,磨粉50目过筛,密封后置于-20 ℃冰箱保存,备用。
96孔黑色酶标板 美国Corning公司;水溶性维E(Trolox)标准品、2,7-二氯荧光素二乙酸酯(DCFH-DA)、荧光素钠盐(FL) 美国Sigma试剂公司;没食子酸标准品、水溶性维C标准品、2,2-偶氮二异丁基脒盐酸盐(ABAP)、磷酸盐缓冲溶液固体(PBS)、2,2-联氨-双-3-乙基苯并噻唑啉-6-磺酸(ABTS) 北京索莱宝科技有限公司;1,1-二苯基-2-苦肼基(DPPH) 梯希爱(上海)化成工业发展有限公司;其它试剂 均为国产分析纯。
RE-5205型旋转蒸发器 上海亚荣生化仪器厂;TGL-20M型台式高速冷冻离心机 长沙迈佳森仪器设备有限公司;A360型紫外可见分光光度计翱艺仪器(上海)有限公司;Scientz-I8N型真空冷冻干燥机 上海比朗仪器制造有限公司;Synergy H4型全功能酶标仪 美国伯腾仪器有限公司(BioTek)。
1.2 实验方法
1.2.1 石榴花多酚粗提物的制备 石榴花游离型和结合型多酚粗提物的提取分别采用丙酮提取法和氢氧化钠消化法,参照Adom等[15]、王立峰等[19]方法稍作修改。
1.2.1.1 游离型多酚粗提物的制备 取1 g磨碎的干燥石榴花,加20 mL 70%的丙酮溶液,超声15 min后离心(4000 r/min,10 min)取上清液,残渣用上述方法重复提取3次。收集全部上清液后于40 ℃条件下进行真空浓缩,浓缩液经冷冻干燥得游离型多酚粗提物冻干粉,密封后于-20 ℃条件下保存,备用。
1.2.1.2 结合型多酚粗提物的制备 用游离型多酚粗提物提取后的残渣进行提取。残渣中加入40 mL 4 mol/L氢氧化钠溶液,避光消化4 h,用盐酸调节pH为2,离心(4000 r/min,30 min),取上层清液加入乙醚、乙酸乙酯,以1:1:1比例进行萃取,取上层液保留,下层液重复萃取操作5次。合并所得全部上层萃取液后于40 ℃条件下进行真空浓缩,浓缩液经冷冻干燥得结合型多酚粗提物冻干粉,密封后于-20 ℃条件下保存,备用。
1.2.2 石榴花多酚粗提物多酚含量的测定 参照Adom、Chen等[20-21]的Folin-Ciocalteu法稍作修改。
1.2.2.1 标准曲线的建立 准确量取0.1 mg/mL没食子酸标准溶液0.00、0.25、0.50、0.75、1.00、1.25、1.50 mL于25 mL容量瓶,各加入10 mL去离子水,再加入1.25 mL福林酚试剂,混匀静置5 min,加入6.25 mL 10 %的碳酸钠溶液,用去离子水定容。避光反应2 h,760 nm处测定吸光值,绘制标准曲线。
1.2.2.2 多酚含量的测定 将游离型和结合型多酚粗提物冻干粉分别配制成一定浓度溶液,取适量样品液参照标准曲线方法进行测定。所得多酚含量以每克冻干粉量等同于没食子酸的毫克数(mg GAE/ g多酚干粉)表示。计算公式:
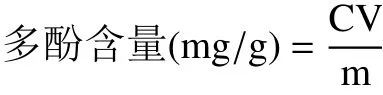
式中:C为带入标准曲线计算得到的没食子酸浓度,mg/mL;V为样品液的体积,mL;m为原料质量,g。
1.2.3 石榴花多酚粗提物体外抗氧化活性的测定
1.2.3.1 吸收过氧自由基能力(ORAC)测定 测定参照张怡一等[22]、李苇舟等[23]提及方法稍作修改。将试剂、标准品、待测样品用(pH7.4,75 mmol/L)磷酸盐缓冲液溶解。于96孔黑色酶标板中分别加入20 μL磷酸缓冲液(空白)、20 μL不同浓度的Trolox标准液和20 μL不同浓度的待测样品液,将96孔黑色酶标板置于酶标仪中设定37 ℃温育10 min,之后每孔加入0.96 μmol/L的荧光素(FL)工作液200 μL,再将酶标板置于酶标仪中设定37 ℃振荡15 min,迅速加入119 mmol/L的ABAP工作液20 μL。设定全功能酶标仪的激发波长485 nm,入射波长535 nm,每5 min进行读数,共2.5 h。采用近似积分法和以下公式计算荧光衰退曲线下荧光面积(area under the curve,AUC):

式中:f1和fn表示第1次和第n次测定的相对荧光强度值;t间隔测定时间。

ORAC值以每克多酚干粉等同于Trolox的微摩尔数表示(μmol Trolox/g多酚干粉)。
1.2.3.2 清除过氧自由基能力(PSC)测定 参照Adom 等[16]、王立峰等[24]方法进行。DCFH反应液制备:取1 mmol/L氢氧化钾溶液900 μL与2.48 mmol/L的DCFH-DA溶液 80 μL,混合避光水解5 min,用(pH7.4,75 mmol/L)磷酸缓冲液定容至6 mL备用。于96孔黑色酶标板中分别加入100 μL磷酸缓冲液(空白),100 μL不同浓度Trolox标准液和100 μL不同浓度样品液,之后加入100 μL DCFH反应液,迅速加入50 μL 200 mmol/L的ABAP反应液。设定全功能酶标仪37 ℃,激发波长485 nm,入射波长538 nm,每2 min进行一次读数,共40 min。
将试验数据进行平均荧光值和荧光积累面积计算后作为计算抗氧化能力的基础。根据公式进行计算:
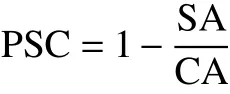
式中:SA为样品或标准品的荧光积累面积;CA为空白对照的荧光积累面积。
PSC单元对应着剂量-反应曲线,可从曲线图中计算半数效应浓度EC50值(concentration for 50% of maximal effect,EC50)。多酚样品抗氧化能力用每毫克多酚干粉等同于Trolox的微克数表示(μg Trolox/mg多酚干粉)。
1.2.3.3 清除DPPH自由基能力(DRSA)测定 参考陈壁等[25]方法稍作调整。将石榴花多酚粗提物溶解稀释成不同浓度,取各样品0.5 mL,加入4 mL浓度约0.075 mmol/L的DPPH-甲醇工作液,混合避光放置30 min,于波长517 nm处测定吸光度;设空白对照。同时以VC标准品作阳性对照。最终计算DPPH自由基清除率和各样品IC50值。
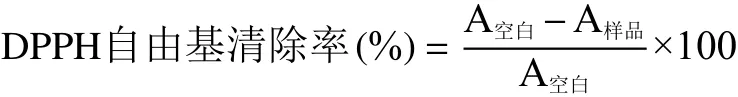
式中:A空白为DPPH乙醇溶液吸光度;A样品为样品溶液吸光度。
1.2.3.4 清除ABTS+自由基能力(TEAC)测定 测定参照张红城等[26]方法稍作调整。ABTS自由基工作液:88 μL 140 mmol/L过硫酸钾溶液 和5 mL 7 mmol/L ABTS溶液混匀避光保存过夜,得ABTS自由基储备液;使用前将ABTS自由基储备液与无水乙醇按一定比例进行稀释使用。将石榴花多酚粗提物溶解稀释成不同浓度,取各待测样品0.25 mL,加入4 mL ABTS自由基工作液,混匀静置6 min,在734 nm处测定吸光度;设定空白对照。同时以VC标准品作为阳性对照。最终计算ABTS+自由基清除率和各样品IC50值。

式中:A空白为ABTS阳离子工作液吸光度;A样品为样品溶液吸光度。
1.2.3.5 还原能力(RP)测定 测定参照文献[25,27]等方法进行。将石榴花多酚粗提物用去离子水溶解并稀释成不同浓度待测样品,准确吸取0.4 mL不同浓度的待测样品,分别加入1 mL磷酸盐缓冲溶液(0.2 mol/L,pH6.6)和1 mL浓度为1%的铁氰化钾溶液,混合均匀后置于50 ℃水浴保温20 min,冷却后加入1 mL浓度10%的三氯乙酸充分混匀后离心(4000 r/min,10 min)。离心后取上清液2 mL,加入1 mL 0.1%三氯化铁溶液,加去离子水定容,混匀静置10 min后于700 nm处测定吸光值;设定空白对照。同时以VC标准品作为阳性对照。
1.3 数据处理
数据以平均值±标准差表示,数据统计主要用SPSS 19.0,GraphPad Prism 5进行统计分析,图表利用Origin 2018进行绘制。
2 结果与分析
2.1 石榴花多酚粗提物多酚含量测定结果
以没食子酸浓度为横坐标,吸光度为纵坐标,绘制标准曲线如图1所示。标准曲线方程Y=156.11X+0.0042,R2=0.9993,说明没食子酸(GAE)在0.000~0.006 mg/mL浓度范围内有良好的线性关系。
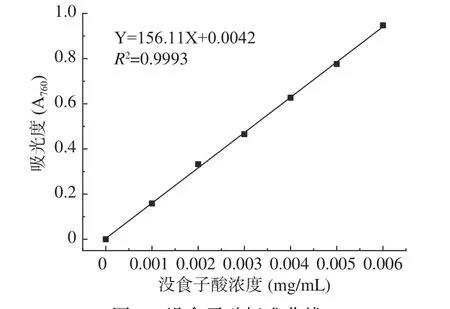
图1 没食子酸标准曲线Fig.1 Standard curve of gallic acid
将石榴花游离型和结合型多酚粗提物冻干粉所测吸光度代入没食子酸标准曲线方程,得到游离型和结合型样品多酚含量分别为244.08±10.41 mg GAE/g游离型干粉,66.50±1.04 mg GAE/ g结合型干粉,游离型多酚含量明显高于结合型。
2.2 石榴花多酚粗提物体外抗氧化测定结果与分析
2.2.1 吸收过氧自由基能力(ORAC)测定结果 在有荧光素探针(FL)存在的条件下,添加ABAP激发产生过氧自由基(ROO·),荧光素探针被破坏,荧光强度减弱,在有抗氧化剂的条件下,可以抑制荧光强度的衰减[21]。通过测定可得不同浓度抗氧化剂Trolox、游离型和结合型多酚粗提物荧光强度随时间衰减的时间动力学与剂量反应曲线图,由图2A可知,Trolox浓度越高,荧光衰减速度越慢,荧光积累量越大。由图2B可知,同一浓度两种多酚粗提物具有不同荧光强度衰减趋势,同一时间游离型样品荧光积累量最大,荧光衰减速度最慢,其次为结合型样品,最后为空白对照。以Trolox浓度为横坐标,荧光衰退曲线下净荧光面积(net AUC)为纵坐标,绘制Trolox系列标准品标准曲线2C,通过换算得两种多酚粗提物ORAC值分别为870.77±14.90 μmol Trolox/g游离型干粉,470.10±39.84 μmol Trolox/g结合型干粉。ORAC值越大说明样品吸收过氧自由基能力越强,游离型多酚粗提物ORAC值高于结合型多酚粗提物ORAC值,表明游离型多酚粗提物吸收过氧自由基能力强于结合型(P<0.05)。
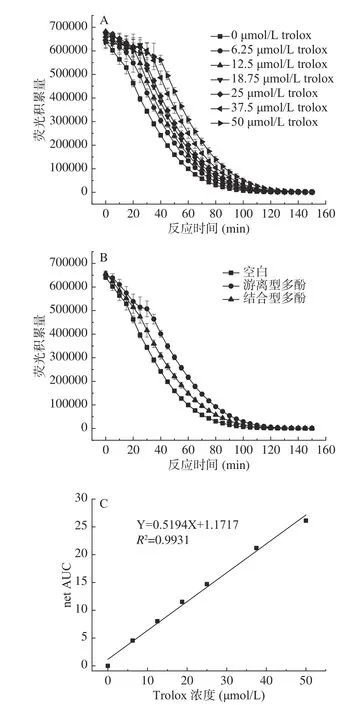
图2 吸收过氧自由基能力测定结果Fig.2 Determination results of oxygen radical absorbance capacity
2.2.2 清除过氧自由基能力(PSC)测定结果 加入ABAP激发产生过氧自由基(ROO·)氧化非荧光二氯荧光素(DCFH)为荧光二氯荧光素(DCF),可对产生的荧光进行测定,通过添加能清除过氧自由基的抗氧化剂对DCFH的氧化进行控制[21]。通过测定可得不同浓度Trolox以及游离型和结合型样品荧光强度随时间递增的时间动力学与剂量反应曲线图3A~图3C。由图可知,不同浓度Trolox以及两种样品总体趋势均随时间推移其荧光积累量均逐渐递增,但低浓度样品荧光积累量递增急剧,高浓度样品荧光积累量递增平缓;从曲线平缓程度可推测样品清除过氧自由基能力,样品浓度越高,曲线斜率越小,清除能力越强;反之,样品浓度越低,曲线斜率越大,清除能力越弱。
通过荧光积累量可换算得PSC值,样品浓度与PSC值构成剂量反应曲线,见图3D~图3F。由图可知不同浓度Trolox和多酚粗提物随浓度变化产生不同PSC值,变化趋势为低浓度样品产生较大的荧光积累面积SA,较低的PSC值,高浓度样品产生较小的荧光积累面积SA,较高的PSC值;但所有样品到一定浓度后PSC值基本稳定。从PSC单元构成的剂量反应曲线进一步计算半数效应浓度EC50值,Trolox的EC50=9.52 μg/mL,游离型和结合型分别为EC50=32.47、83.94 μg/mL,两种多酚粗提物能引起50%抑制所需要的量分别约为VC量的3.4倍和8.8倍,PSC值分别为290 μg trolox/mg游离型干粉,110 μg trolox/mg结合型干粉。EC50值越低,抗氧化能力越强,游离型多酚粗提物样品抗氧化能力高于结合型多酚粗提物(P<0.05)。
2.2.3 清除DPPH自由基和ABTS+自由基能力测定结果 DPPH自由基溶液和ABTS+自由基溶液分别在517 nm和734 nm处有吸光度值,当向自由基溶液中加入待测样品,若其吸光度值下降,则说明自由基浓度降低,待测样品具有清除溶液中自由基的能力[5,13]。不同浓度VC、游离型和结合型多酚粗提物清除DPPH自由基和ABTS+自由基情况如图4A~图4C所示,由图可知不同浓度的不同样品均具有一定的DPPH自由基和ABTS+自由基清除能力,样品浓度越高,清除率越强,清除率与样品浓度呈良好的线性关系;但随样品浓度增加,自由基清除率先明显上升后趋于平缓。
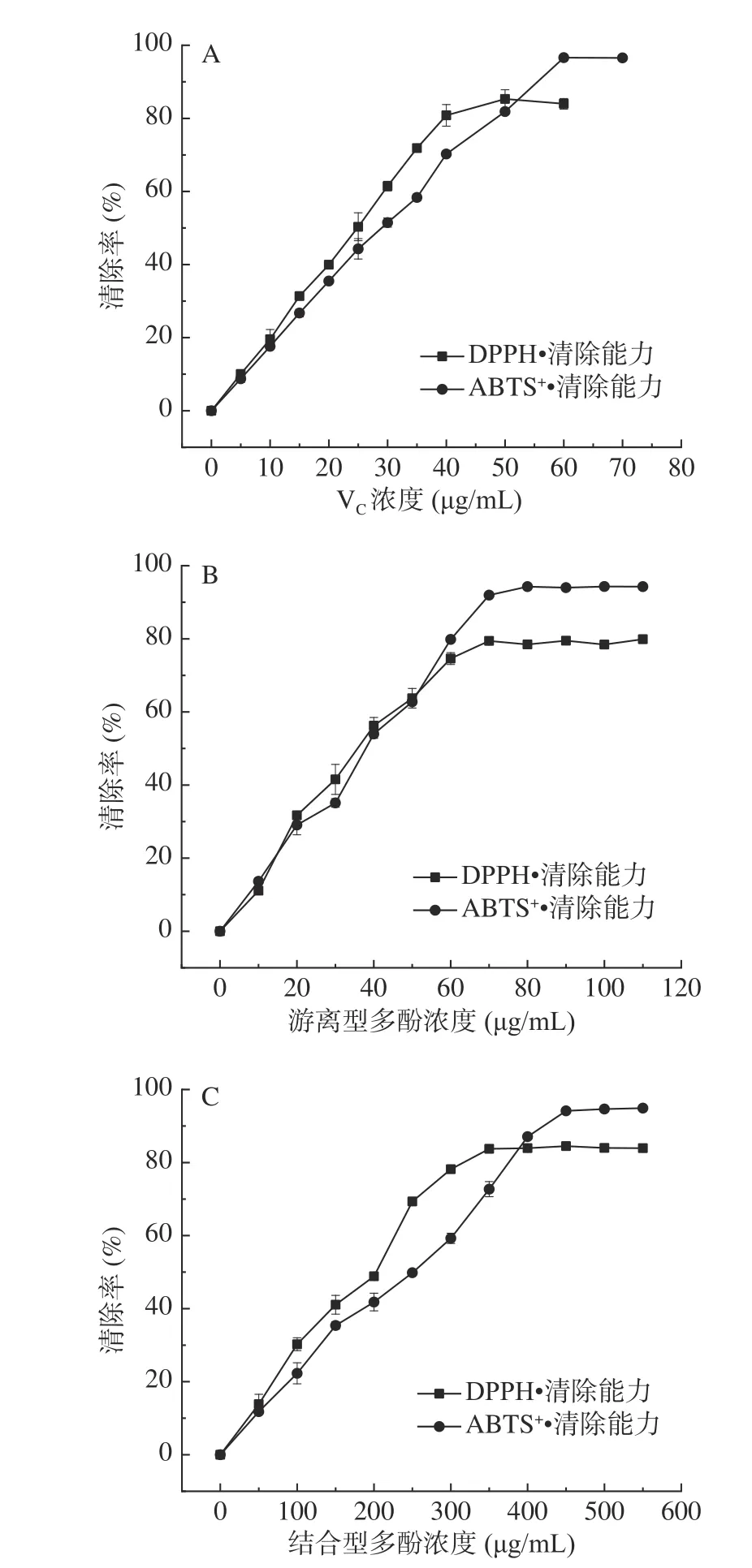
图4 清除DPPH自由基和ABTS+自由基能力测定结果Fig.4 Determination results of DPPH and ABTS+ free radical scavenging ability
在清除DPPH自由基测定中,当VC、游离型和结合型多酚粗提物分别达到40、70、350 μg/mL左右浓度时,清除率基本稳定在80%左右;Kaur等将石榴花的乙醇提取物进行DPPH自由基清除能力测定,发现在100 μg/mL浓度下清除率达81.6%[5]。通过曲线拟合得各样品清除DPPH自由基的IC50值大小依次为:VC(IC50=22.75 μg/mL)>游离型(IC50=34.56 μg/mL)>结合型(IC50=170.1 μg/mL),游离型和结合型样品抗氧化能力相当于VC的66%和13%。在清除ABTS+自由基测定中,当VC、游离型和结合型多酚粗提物浓度分别达到60、80、450 μg/mL时,清除率达到95%左右并趋于稳定;通过曲线拟合得各样品清除ABTS+自由基的IC50值大小依次为:VC(IC50=26.33 μg/mL)>游离型(IC50=34.89 μg/mL)>结合型(IC50=214.2 μg/mL),游离型和结合型样品抗氧化能力相当于VC的75%和12%。总的来说,样品无论对DPPH自由基还是ABTS+自由基均具有一定的清除作用,且清除效果与浓度在一定范围内呈正相关。
2.2.4 还原力测定结果 样品与还原力测定的试剂反应后,在700 nm处有吸光度值。若样品抗氧化能力越强,则反应后溶液吸光度越大,可用吸光度来表示样品的还原能力[27]。由图5可知,不同浓度的VC、游离型和结合型多酚粗提物还原力在实验浓度范围内都随浓度增加而增强,线性拟合方程分别为:Y(VC)=0.0074X+0.013(R2=0.9987),Y(游离型)=0.0031X-0.0215(R2=0.9960),Y(结合型)=0.0004X+0.0024(R2=0.9978),有明显的剂量效应关系。从图5可知同一浓度VC、游离型和结合型样品吸光度值差别显著(P<0.05),游离型和结合型样品还原力显著低于VC(P<0.05),总体还原力大小为:VC>游离型>结合型。
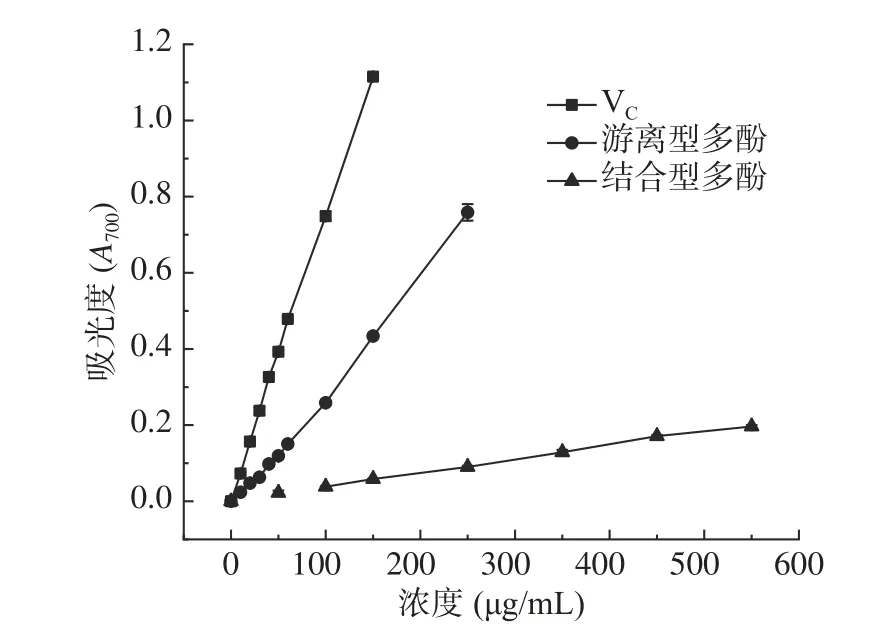
图5 还原能力测定结果Fig.5 Determination results of reducing capacity
3 结论
对石榴花中游离型和结合型多酚粗提物进行提取并进行多酚含量测定和抗氧化能力评价发现,游离型多酚粗提物多酚含量(244.08±10.41 mg GAE/g游离型干粉)显著高于结合型多酚粗提物(66.50±1.04 mg GAE/g结合型干粉)(P<0.05);两种多酚提取物吸收过氧自由基能力(ORAC)测定中,以Trolox作为阳性对照,Trolox和两种多酚粗提物有明显的荧光衰减动力学与剂量反应趋势,ORAC值分别为870.77±14.90 μmol Trolox/g游离型干粉,470.10±39.84 μmol Trolox/g结合型干粉;清除过氧自由基能力(PSC)测定中,以Trolox作为阳性对照,Trolox和两种多酚粗提物有明显的荧光递增动力学与剂量反应趋势,有明显的PSC单元反应剂量趋势,EC50值分别为32.47和83.94 μg/mL,PSC值分别为290 μg Trolox/mg游离型干粉,110 μg Trolox /mg结合型干粉。清除DPPH自由基的IC50值分别为34.56和170.1 μg/mL,以VC作为阳性对照,其抗氧化能力相当于VC的66%和13%;清除ABTS+自由基的IC50值分别为34.89和214.2 μg/mL,以VC作为阳性对照,其抗氧化能力相当于VC的75%和12%;还原力表现均为样品在一定浓度范围内随浓度的增加而增强。5项抗氧化活性指标测定中游离型多酚粗提物抗氧化能力均高于结合型(P<0.05)。
本研究表明石榴花游离型和结合型多酚粗提物均具有一定抗氧化作用,游离型抗氧化能力优于结合型,与抗氧化剂Trolox和VC比较,抗氧化性稍弱,但作为天然抗氧化剂,具有一定研究价值,可为石榴花的深加工和应用提供新思路,也可为天然抗氧化剂的研究与开发奠定一定理论基础。
