大孔树脂吸附桦褐孔菌多糖色素的机理及工艺优化
2021-11-14信传鑫杨金涛戴晓婧
信传鑫,杨金涛,戴晓婧,苏 玲, ,王 琦,
(1.吉林农业大学,食药用菌教育部工程研究中心,吉林长春 130118;2.吉林农业大学植物保护学院,吉林长春 130118;3.吉林农业大学中药材学院,吉林长春 130118)
桦褐孔菌(Inonotus obliquus(Ach. ex Pers.)Pilat)别名白桦茸,隶属于担子菌门(Basidiomycota),伞菌纲(Agaricomycetes),锈革孔菌目(Hymenochaetales),锈革孔菌科(Hymenochaetaceae),纤孔菌属(Inonotus)[1]。早在16世纪,俄罗斯人便使用桦褐孔菌预防及治疗各种疑难杂症[2],在芬兰、波兰等欧洲国家也被广泛使用[3]。现代学者研究表明,桦褐孔菌多糖同时具有抗肿瘤[4]、抗氧化[5]、免疫调节[6-7]等生物活性,作为纯天然药物多糖无/或具有较低的毒副作用,具有较高研究价值。而在桦褐孔菌多糖提取过程中,会有大量色素混于其中,使得提取的桦褐孔菌多糖纯度不高,后续分离纯化难度大、效率低,影响高纯度多糖的制备、结构分析、药理活性研究[8]。因此,采用适当的方法对桦褐孔菌多糖色素进行脱色处理是其分离纯化中必要的工艺步骤。
目前,常用的多糖脱色方法有活性炭吸附、过氧化氢、聚酰胺柱层析、大孔树脂等[9],其中活性炭吸附法在吸附色素的同时也将多糖一同吸附,多糖的损失较大,回收率低[10];利用过氧化氢脱色时,多糖易发生水解,从而改变多糖结果及生物活性[11];而聚酰胺预处理耗时较长且耗费大量试剂;大孔树脂是兼具筛选与吸附功能的高分子材料,与上述两种脱色方法相比,具有清洗简单方便、容易再生、反应温和、吸附力强、不改变多糖原有结构与生物活性的优点[12],并且在吸附色素时,还可同步去除蛋白等杂质[13]。但是,大孔树脂种类繁多,包括极性、中极性、弱极性等不同类型,而且同一类型的大孔树脂还有多种不同型号[14]。因此,在利用大孔树脂吸附色素时,需根据被吸附物质的性质,选择适宜的大孔树脂。目前,大孔树脂已被广泛应用于吸附多糖中色素[15-16],也有研究者利用S-8、D101等大孔树脂对桦褐孔菌脱色[17-18],但是其对大孔树脂去除桦褐孔菌色素的机理尚不清楚,使吸附操作及大规模生产缺乏理论基础,限制了桦褐孔菌多糖的实际应用。因此,本文对17种不同型号的大孔树脂吸附桦褐孔菌多糖色素的吸附率及多糖保留率进行了比较,确定最适宜大孔树脂型号,并对其吸附色素的动力学及热力学进行探究,在此基础上,优化其动态洗脱条件,确定最佳洗脱工艺,为桦褐孔菌多糖的分离纯化提供了理论及实验基础。
1 材料与方法
1.1 材料与仪器
桦褐孔菌菌核 吉林省长春市健龙生物科技有限公司;无水乙醇、苯酚、浓硫酸、氯仿、正丁醇 均为国产分析纯,北京化工厂;17个不同型号大孔树脂型号包括NKA-9、HPD-500、LSA-700B、LSA-10、LX-T5、DM130、LX-68、LX-8、LX-10G、LX-19、LX-300C、LX-68G、AB-8、LX-T28、XDA-7、LX-60、D101 北京鼎国生物科技有限公司。
RE-5210A旋转蒸发仪 上海亚荣生化仪器厂;ST16高速冷冻离心机 赛默飞世尔科技中国有限公司;BSA224S电子天平 北京赛多利斯仪器系统有限公司;YC-370冰箱 澳柯玛集团;TU-1810紫外可见分光光度计 北京普析通用仪器有限责任公司。
1.2 实验方法
1.2.1 桦褐孔菌多糖提取 桦褐孔菌菌核经中药粉碎机粉碎,过60目筛,获得的菌粉备用。称取500 g干燥菌粉,置于烧杯中,按料液比1:41(g/mL)加入蒸馏水,于水浴锅80 ℃提取2 h。冷却后8000 r/min离心10 min去除菌渣,收集提取液加热浓缩至原有体积的1/5。放凉,按体积比1:4加无水乙醇,4 ℃静置过夜醇沉12 h。第2 d,8000 r/min离心10 min,取沉淀,烘干。溶解并加入等体积Sevag试剂(三氯甲烷:正丁醇=4:1)除蛋白,透析去除小分子杂质,冻干得桦褐孔菌多糖。
1.2.2 大孔树脂预处理 将17种大孔树脂分别浸泡于95%乙醇中24 h,充分溶胀,24 h后用95%乙醇清洗大孔树脂直至无白色浑浊,再用去离子水洗至完全去除醇味,备用。
1.2.3 大孔树脂筛选 称取500 mg桦褐孔菌多糖,溶解于500 mL去离子水中配成1 mg/mL桦褐孔菌多糖溶液。分别称取不同型号预处理后的大孔树脂3.0 g于50 mL三角瓶中,再加入1 mg/mL多糖溶液10 mL,设置3组平行对照。将三角瓶置于恒温振荡培养箱中,30 ℃吸附24 h后,取桦褐孔菌多糖溶液。450 nm测定色素吸光度,苯酚硫酸法于490 nm检测糖含量。色素吸附率及多糖保留率计算公式如下[19]:

将吸附饱和后的大孔树脂使用蒸馏水洗涤过滤,加入70%乙醇10 mL于恒温振荡培养箱中,30 ℃解吸24 h,取上层液体450 nm测定色素吸光度。
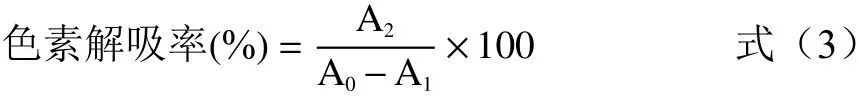
式中:A0为溶液初始色素吸光度;A1为溶液去除色素后的吸光度;A2为溶液解吸后的吸光度;M0为溶液初始多糖含量,mg/mL;M1为去除色素后溶液中的多糖含量,mg/mL。
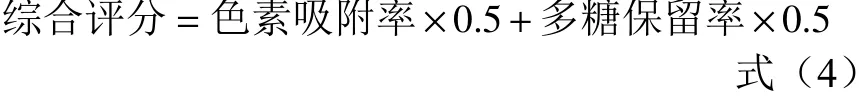
1.2.4 大孔树脂吸附动力学分析 称取9份9 g HPD-500大孔树脂,分别装入9个三角瓶。称取270 mg桦褐孔菌多糖,以蒸馏水溶为1 mg/mL多糖溶液,每个三角瓶中放入30 mL多糖溶液。分别在25、35、45 ℃以170 r/min恒温震荡300 min,在10、20、30、45、60、90、120、150、180、210、240、300 min时进行取样,每个温度设置三组对照。
色素吸附量计算方程如下[20]:

式中:Qt为t时刻的色素吸附量,1/g树脂;A0为溶液初始色素吸光度;At为t时刻吸光度;m为树脂的质量,g。
1.2.5 大孔树脂吸附热力学分析 分别称取9份HPD-500大孔树脂1、2、3、4、5、6 g放入三角瓶中,每瓶加入10 mL的1 mg/mL桦褐孔菌多糖。分别在25、35、45 ℃下,以170 r/min恒温震荡150 min。测定多糖溶液在450 nm下吸光度。

式中:qe为 平衡吸附量,mmol/mL;Ce为吸附平衡时的溶质浓度,mg/mL;A0为溶液初始色素吸光度;A为脱色后溶液吸光度。
1.2.6 动态吸附实验
1.2.6.1 泄露曲线的绘制 大孔树脂HPD-500装入层析柱,平衡。10 mg/mL桦褐孔菌多糖溶液上样,洗脱流速1.0 mL/min,每40 s收集一支试管,当洗脱液中有样品泄露停止。以蒸馏水为空白对照,在450 nm波长处测定吸光度,绘制泄露曲线。树脂吸附量=泄露点前上柱样品体积×样品浓度
1.2.6.2 径高比优化 层析柱分别按径高比1:8、1:10、1:12装柱,平衡。10 mg/mL桦褐孔菌多糖溶液上样于3个层析柱,每个柱中1 mL,吸附1 h,蒸馏水以流速1.5 mL/min洗脱,收集洗脱液,浓缩定容[21]。计算色素吸附率、多糖保留率,进行综合评分。
1.2.6.3 吸附时间优化 层析柱按径高比1:8装柱,平衡。10 mg/mL桦褐孔菌多糖溶液上样于3个层析柱,每个柱中1 mL,分别吸附1、2、4 h,蒸馏水以流速1.5 mL/min洗脱,收集洗脱液,浓缩定容。计算色素吸附率、多糖保留率,进行综合评分。
1.2.6.4 上样量优化 层析柱按径高比1:8装柱,平衡。分别配制10、20、40 mg/mL多糖溶液,上样于层析柱中,吸附1 h,蒸馏水以流速1.5 mL/min洗脱,收集洗脱液,浓缩定容。计算色素吸附率、多糖保留率,进行综合评分。
1.2.6.5 洗脱流速优化 层析柱按径高比1:8装柱,平衡。10 mg/mL桦褐孔菌多糖溶液上样于3个层析柱,每个柱中1 mL,吸附1 h,蒸馏水洗脱,3个层析柱的洗脱流速分别为1.0、1.5、2 mL/min,收集洗脱液,浓缩定容。计算色素吸附率、多糖保留率,进行综合评分。
1.2.7 桦褐孔菌多糖纯度测定 取未纯化10 mg/mL多糖溶液1 mL,测定多糖含量。层析柱分别按径高比1:10装柱,平衡。10 mg/mL桦褐孔菌多糖溶液1 mL上样于层析柱,吸附1 h,蒸馏水以流速1.5 mL/min洗脱,收集洗脱液,测定多糖含量,并烘干称重。
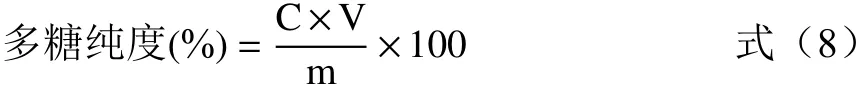
式中:C为桦褐孔菌多糖含量,mg/mL;V为溶液体积,mL;m为多糖质量,mg。
1.2.8 树脂重复使用周期 层析柱分别按径高比1:10装柱,平衡。10 mg/mL桦褐孔菌多糖溶液1 mL上样于层析柱,吸附1 h,蒸馏水以流速1.5 mL/min洗脱,收集洗脱液,浓缩定容,脱色完成后,70%乙醇进行解吸,蒸馏水平衡后再次上样,上样8次。分别测定并计算8次色素吸附率、多糖保留率,进行综合评分。
1.3 数据处理
数据处理采用Excel2016、Origin9.1进行数据整理拟合与绘图,SPSS21进行显著性分析。
2 结果与分析
2.1 大孔树脂筛选
不同型号大孔树脂对桦褐孔菌多糖色素吸附及多糖保留的结果见表1。实验所选17种不同型号的大孔树脂吸附桦褐孔菌多糖色素的能力差异明显,其中对色素吸附率最高的大孔树脂为LSA-700B,其色素吸附率为48.56%;而对色素吸附率最低的大孔树脂为LX-68,其色素吸附率仅为4.64%。17种不同型号的大孔树脂对桦褐孔菌多糖的保留率也有所差异,LSA-10保留率最高为99.35%,LX-300C保留率最低仅为17.16%。
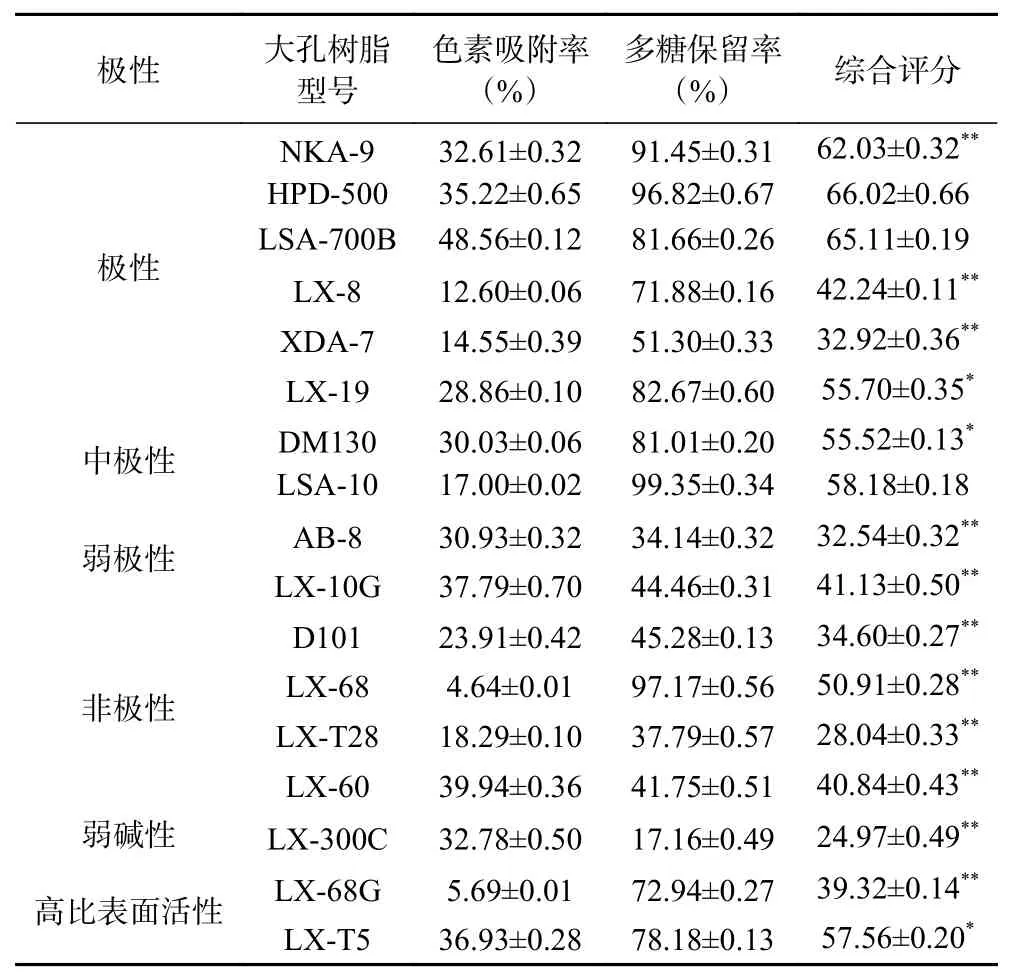
表1 树脂静态吸附实验结果Table 1 Results of resin static adsorption
但作为纯化桦褐孔菌多糖的大孔树脂,多糖的保留率与色素的吸附率都应是选择其型号的条件。故综合色素吸附率和多糖保留率2项指标进行评分,大孔树脂HPD-500在吸附桦褐孔菌多糖色素时,效果最佳,因此选择HPD-500树脂进行后续实验研究。
大孔树脂吸附色素后,70%酒精进行色素静态解除吸附。解吸效果如表2所示,各大孔树脂解吸效果有所差异,其中LSA-10、HPD-500、NKA-9解吸效果最佳,而LX-300C大孔树脂仅解吸30.33%。作为色素吸附率与多糖保留率综合评分最高的HPD-500大孔树脂,其同样具有较好的色素解吸率,达到了89.64%,可进行重复使用,且色素可进行回收。
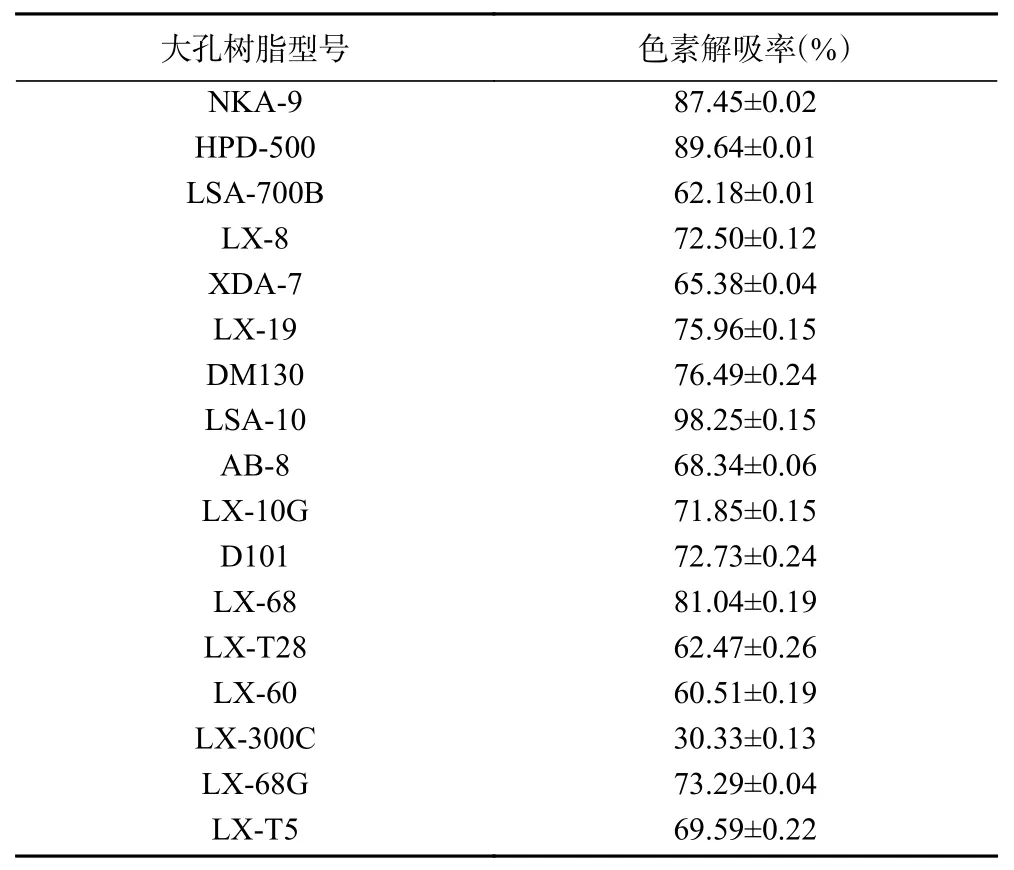
表2 树脂解吸实验结果Table 2 Results of resin static desorption
2.2 动力学曲线
在不同温度下,大孔树脂HPD-500对桦褐孔菌多糖色素静态吸附动力学曲线如图1。在前50 min吸附量较大,为快速吸附阶段,此阶段反应推动力可能为固液两相中吸附质的浓度差以及吸附剂表面大量的空余吸附位点;50 min后吸附速率有所降低,为慢速吸附阶段,固液相中吸附质浓度差降低且吸附剂表面位点趋于饱和,直至130 min达到吸附平衡,吸附速率减小到零。
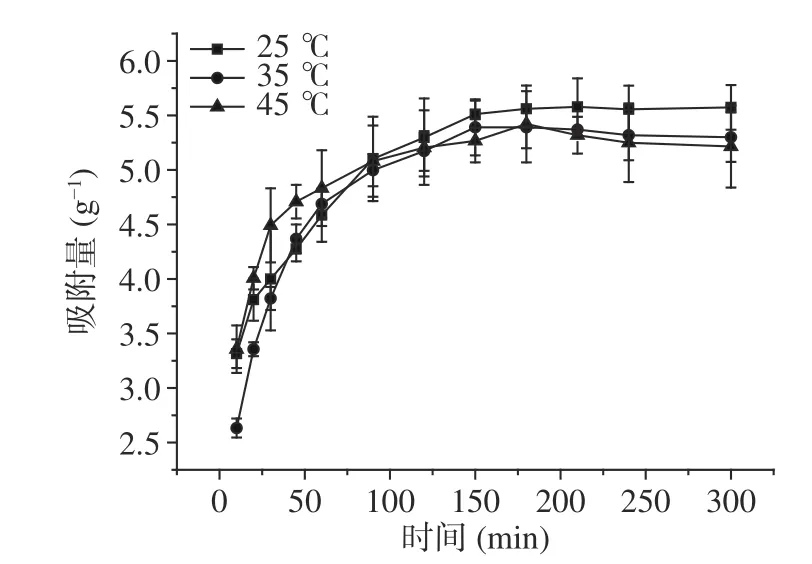
图1 桦褐孔菌色素在HPD-500树脂上的吸附动力学曲线Fig.1 Adsorption kinetic curves of flavonoids of HPD-500 resinto Inonotus obliquus polysaccharide pigment
2.3 吸附动力学模型
分别使用Lagergren即准一级动力学模型、准二级动力学模型、颗粒内扩散模型来拟合大孔树脂在25、35、45 ℃时的吸附过程[22]。
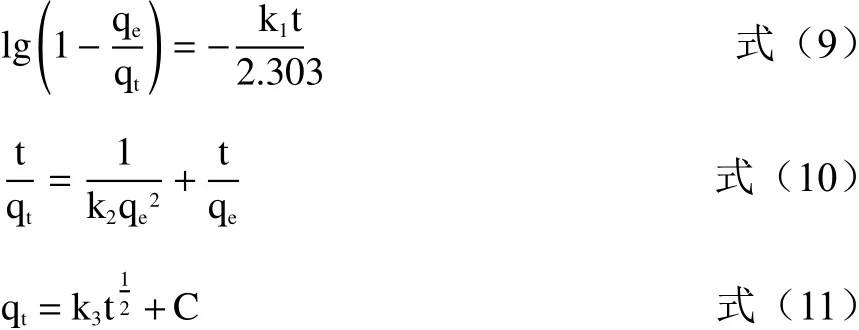
式中:k1为 准一级吸附速率常数,min-1;k2为准二级吸附速率常数,mg/(g·min);k3为粒内扩散方程常数,mg/(g·min);C为常数;qt为单位树脂在t时刻的吸附量,g-1;qe为单位树脂的饱和吸附量,即130 min时的吸附量,g-1;t为时间,min。
以时间t横坐标,分别以lg(1-F)(F=qe/qt) 、t/qt为纵坐标绘制准一级动力学曲线、准二级动力学曲线。各温度下动力学模型相关系数如表3,其中准二级动力学模型相关系数均达到了0.999,表明准二级模型能更好地描述其吸附过程[23]。准二级动力学模型速率控制步骤为树脂内的化学吸附,作用力来自被吸附物与树脂之间的电子共用或电子转移[24],且准二级吸附速率常数k2随温度升高而增大,表明反应为吸热反应。
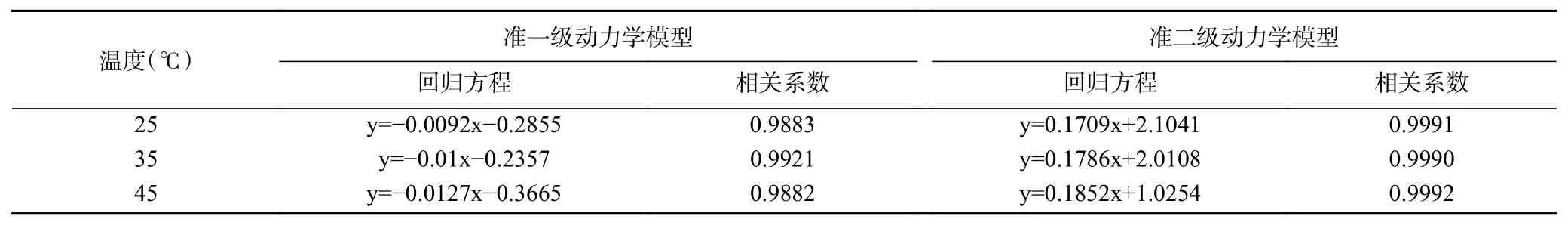
表3 HPD-500树脂对桦褐孔菌多糖色素吸附动力学模型拟合Table 3 Kinetic parameters of adsorption of Inonotus obliquus polysaccharide pigment adsorption on HPD-500 resin
普遍认为树脂的吸附过程分为三步,即液膜扩散、颗粒内扩散以及吸附反应,而吸附反应速度非常快故液膜扩散及颗粒内扩散是控制反应的主要过程[25]。如表4所示颗粒内扩散动力学曲线在25~45 ℃均未经过原点,表明在25~45 ℃下控制吸附速率是由颗粒内扩散与液膜扩散共同影响,但颗粒内扩散仍是控制反应速率的主要因素。

表4 HPD-500树脂对桦褐孔菌多糖色素颗粒内扩散模型拟合Table 4 Weber & Morris of adsorption of Inonotus obliquus polysaccharide pigment adsorption on HPD-500 resin
2.4 静态吸附等温线
以Ce横 坐标,qe为 纵坐标绘制静态吸附等温线,如图2所示为HPD-500大孔树脂在25、35、45 ℃下的吸附等温线。随温度的升高,平衡吸附量逐渐增加,表明反应为吸热反应。

图2 不同温度下HPD-500树脂对桦褐孔菌多糖色素吸附等温线Fig.2 Adsorption isotherms of HPD-500 resinon Inonotus obliquus polysaccharide pigment at different temperatures
分别采用Freundlich与Langmuir模型[26-27]对以上数据进行模拟:
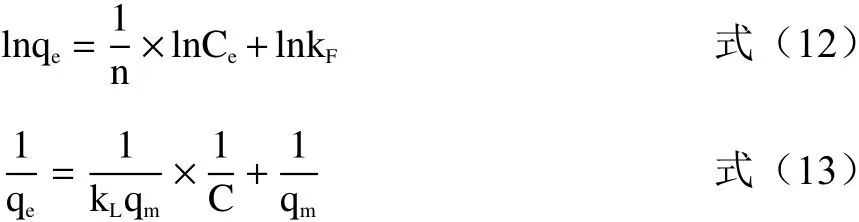
式中:qe为 单位树脂的平衡吸附量,g-1;qm为最大吸附量,g-1;Ce为 吸附质的平衡浓度,mg/mL;kF为平衡吸附常数;n为特征常数;kL为吸附平衡时的解离常数。
根据Freundlich、Langmuir方程分别以lnCe、1/C为横坐标,lnqe、 1/qe作为纵坐标进行拟合。结果如表5所示,Freundlich模型相较Langmuir模型有更高的拟合度,表明吸附为多分子层,被吸附的分子发生再次吸附且吸附可逆。在35 ℃时拟合度最高,表明HPD-500大孔树脂在35 ℃下对桦褐孔菌多糖的等温吸附过程更符合Freundlich模型。

表5 Freundlich和Langmuir等温吸附方程及参数Table 5 Equations and parameters of Freundlich and Langmuir model
2.5 吸附热力学参数
任选6个平衡吸附量qe如表6所示,代入Freundlich方程,分别算出三个温度下的Ce值,以1/T作为横坐标,lnCe为纵坐标作图并进行线性拟合,由斜率得吸附焓变ΔH如表6所示[28-30]。

表6 HPD-500树脂对桦褐孔菌多糖溶液色素的吸附热力学性质Table 6 Adsorption thermodynamic property of Inonotus obliquus polysaccharide solution on HPD-500

式中:k0为常数;R为气体常数(8.314×10-3kJ/(mol·K))。
吸附自由能由公式(12)得如表6所示。

式中:n为Freundlich方程中的表观常数。
大孔吸附树脂吸附桦褐孔菌多糖的吸附熵变ΔS根据Gibbs-Helmholtz方程即公式(13)计算,结果见表6。

式中:ΔH为 计算所得吸附焓变,kJ/mol;ΔG为计算所得吸附自由能,kJ/mol。
由表可知ΔH均>0,表明反应为吸热反应,升高温度有利于反应的进行。ΔH随吸附量的增加而降低,可能由于已吸附质中偶极矩的存在和吸附剂表面吸附中心能量不同[31]。ΔG<0表明反应为自发反应,且温度越高∣ΔG∣ 越大,表明自发趋势越大。ΔS>0表明反应为熵增过程,在吸附过程中伴随着溶剂的置换,色素分子被固定于吸附质上且水分子被解吸,而色素分子量大于水的分子量,所以有更多的水分子解吸,溶液系统的混乱度增加,为熵增过程。
2.6 动态吸附实验
2.6.1 泄露曲线的绘制 泄露曲线如图3,样品从第3管开始发生泄漏,因此,最大上样量为每毫升大孔树脂上样3.96 mg桦褐孔菌多糖。
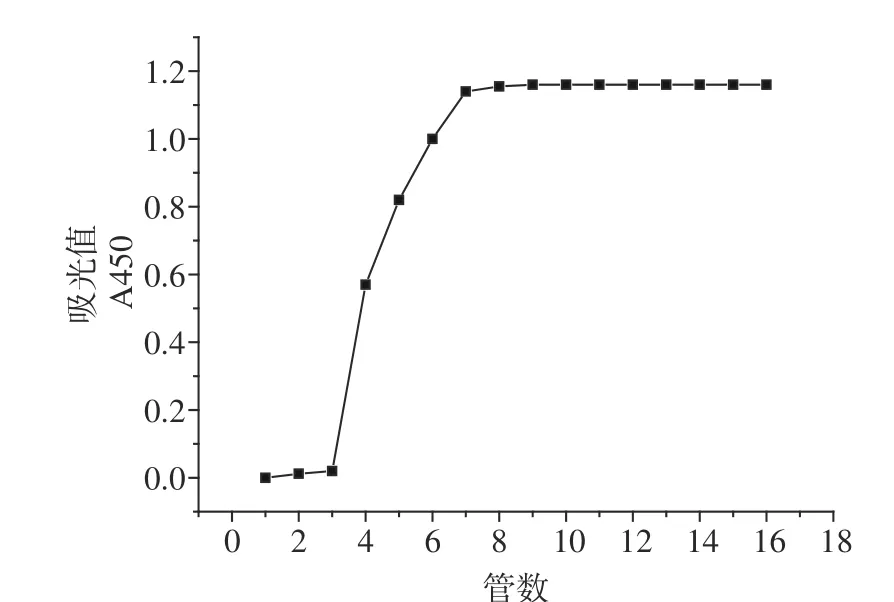
图3 泄露曲线Fig.3 Leakage curve
2.6.2 径高比优化 径高比对桦褐孔菌多糖纯化效果的影响如图4所示。HPD-500层析柱的径高比对吸附桦褐孔菌多糖色素的影响不大,平均在75%,而随着径高比降低多糖保留率先增加后减少,在径高比1:10时达到峰值78.3%。综合色素吸附率与多糖保留率进行评分,径高比在1:8、1:10、1:12时综合评分先升高再下降,在1:10时评分最高。因此,径高比为1:10时综合评分最高,为最优条件。

图4 径高比对桦褐孔菌多糖纯化效果的影响Fig.4 Effect of aspect ratio on purification of Inonotus obliquus polysaccharide
2.6.3 吸附时间优化 如图5所示,当吸附时间从1 h增加到4 h,色素吸附率较为一致,平均约为80%,与静态吸附动力学曲线达到吸附饱和时间相同。当达到吸附饱和后,色素吸附率只发生小幅度变化。而随着吸附时间增加多糖通过吸附作用逐渐进入大孔树脂内部,多糖保留率逐渐减少[11]。综合色素吸附率与多糖保留率进行评分,在吸附时间为1 h时最高,随后逐渐降低,故选择吸附时间1 h为最佳吸附时间。
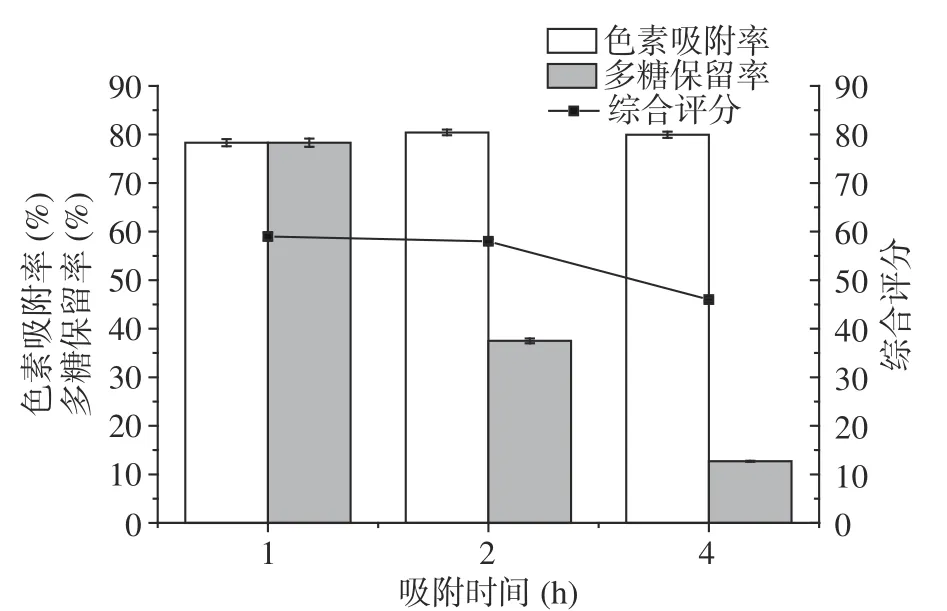
图5 吸附时间对桦褐孔菌多糖纯化效果的影响Fig.5 Effect of adsorption time on purification of Inonotus obliquus polysaccharide
2.6.4 上样量优化 由图6可以看出,当上样量从10 mg增加到40 mg,色素吸附率逐渐降低,多糖保留率在上样量为10、20 mg时无差异,40 mg时下降。上样量低于10 mg时影响吸附色素效率。当大孔树脂吸附位点不变时,上样量的增加会使吸附位点饱和,导致大量色素未被吸附,色素吸附率呈下降趋势。而随着上样量的进一步加大,溶液中多糖含量同样增加,会与色素竞争吸附位点造成色素吸附率及多糖保留率均下降[16]。故综合色素吸附率与多糖保留率进行评分,在上样量为10 mg时综合评分最高,随后逐渐降低。所以选择10 mg为最佳上样量。
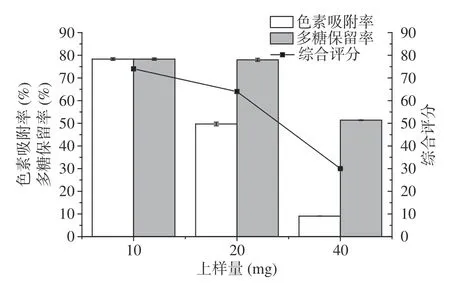
图6 上样量对桦褐孔菌多糖纯化效果的影响Fig.6 Effect of sample weight on purification of Inonotus obliquus polysaccharide
2.6.5 洗脱流速优化 洗脱流速对桦褐孔菌多糖纯化效果的影响如图7所示。洗脱流速由1.0 mL/min升高为2.0 mL/min时,HPD-500对桦褐孔菌多糖色素吸附及多糖保留均呈先升后降的趋势。多糖溶液进入大孔树脂孔内需要一定的压力差,当流速过低时,多糖溶液在孔内吸附减少。而流速过快时,会导致大孔树脂来不及进行吸附,色素吸附率随之降低[32]。在1.5 mL/min流速洗脱时,色素吸附率与多糖保留率分别为83.15%和78.89%,综合评分为81,高于另外2组,因此确定1.5 mL/min为最佳洗脱流速。
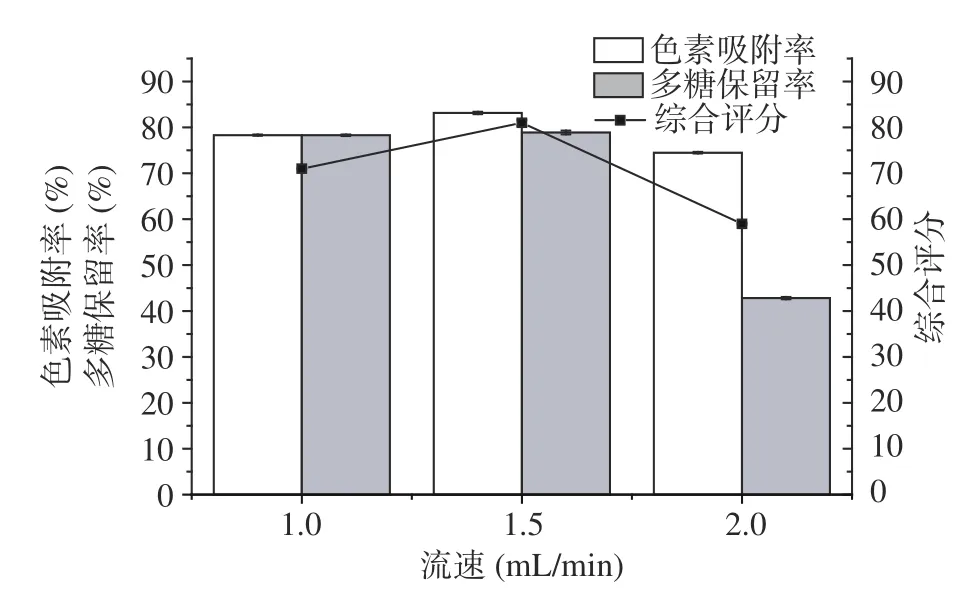
图7 洗脱流速对桦褐孔菌多糖纯化效果的影响Fig.7 Effect of elution flow rate on purification of Inonotus obliquus polysaccharide
2.7 桦褐孔菌多糖纯度
依据上述实验所选出的最佳动态洗脱条件对桦褐孔菌多糖进行纯化并进行多糖纯度计算:选用筛选所得HPD-500大孔树脂,将预处理后HPD-500大孔树脂装柱于径高比为1:10层析柱中,取1.2.1中提取多糖上样10 mg,吸附时间1 h,流速1.5 mL/min下进行洗脱,设置三个平行,收集洗脱液并浓缩定容,分别计算未纯化多糖与纯化多糖纯度。经过HPD-500树脂纯化后,桦褐孔菌多糖纯度由20.40%±0.11%提高至56.52%±0.31%。结果表明,在此工艺下,HPD-500树脂具有纯化桦褐孔菌多糖能力。
2.8 树脂重复使用周期
大孔树脂HPD-500重复使用情况如表7所示,树脂在重复使用8次后色素吸附率与多糖保留率未下降。说明HPD-500大孔树脂重复使用8次,对桦褐孔菌多糖中色素吸附影响不大,且脱色后树脂易解吸,表明HPD-500适于桦褐孔菌多糖中色素的吸附。

表7 HPD-500树脂使用8次性能变化Table 7 Performance changes by HPD-500 resin after 8 times
3 讨论与结论
本实验通过对17种大孔树脂吸附桦褐孔菌多糖中色素的吸附率及多糖保留率进行综合评分,发现极性大孔树脂,如NKA-9、LSA-700B、HPD-500具有较高的色素吸附率,原因可能为极性基团可以降低聚合物表面与样品之间的界面张力,从而增加多糖与聚合物吸附剂之间的接触,增强吸附效力。同时也说明桦褐孔菌多糖中色素可能为极性分子,其中去除色素效果最佳大孔树脂为HPD-500,其对桦褐孔菌多糖的保留率达到了96.82%;已有研究对活性炭法、过氧化氢法、壳聚糖法及聚酰胺层析柱法等4种方法去除桦褐孔菌多糖色素的效果进行比较,发现聚酰胺层析柱法具有最好的效果,色素吸附率为93.39%,多糖保留率为81.68%[33],此结果与本研究中大孔树脂HPD-500去除色素效果相比,多糖损失高,但色素吸附率占优。在去除色素过程中大孔树脂法相较聚酰胺层析柱法预处理更简便,试剂消耗量少,更适用于中量及大量样品的纯化。
吸附动力学结果表明HPD-500大孔树脂在前50 min为快速吸附阶段,动态吸附条件优化实验同样说明吸附时间1 h左右为最佳脱色时间,吸附过程与准二级吸附动力学曲线更为拟合,说明吸附过程为化学吸附;并且反应同时受到颗粒内扩散与液膜扩散的影响,提示适当增加大孔树脂比表面积可以提高其吸附桦褐孔菌多糖色素的速率。吸附热力学实验表明,在25~45 ℃吸附曲线均更为符合Freundlich模型,表明吸附为多分子层的;吸附焓变ΔH>0,吸附自由能ΔG< 0,吸附熵变ΔS>0,表明吸附过程是放热的、可自发进行的熵增反应,结果提示在实际操作及生产中升高温度可以提升吸附速率。在明确吸附机理的基础上,优化动态洗脱条件,确定径高比1:10,上样量10 mg,吸附时间1 h,洗脱流速1.5 mL/min为最佳吸附条件,此条件下色素吸附率与多糖保留率分别为83.15%和78.89%。本实验对桦褐孔菌多糖纯化过程提供了实验基础,为桦褐孔菌多糖开发与利用提供技术支持。
