电子束辐照抑制几种常见食源性致病菌生长的研究
2021-11-12王海宏颜伟强戚文元陈志军包英姿孔秋莲
王海宏,郑 琦,颜伟强,岳 玲,戚文元,陈志军,包英姿,孔秋莲*
(1.上海市农业科学院,上海201106;2.上海束能辐照技术有限公司,上海201401)
食源性致病菌可导致食源性疾病和食物中毒,是影响食品安全的最主要原因。据世界卫生组织统计,全球腹泻病例每年高达1.5亿,其中70%与食品污染致病微生物有关,我国致病性微生物污染导致的疾病在食源性疾病中占比高达46.4%[1]。食源性致病菌多达几十种,在我国食源性致病菌监测中常见的有蜡样芽孢杆菌、副溶血性弧菌、单核细胞增生李斯特氏菌、沙门氏菌、金黄色葡萄球菌、大肠杆菌、创伤弧菌、阪崎肠杆菌等,在熟肉制品、即食豆制品、焙烤食品、中式凉拌菜、牛乳、盒饭等方便即食类食品中多有检出[2-7]。
为保障食品安全,必须对食源性致病菌进行控制。我国2013年发布的《食品安全国家标准食品中致病菌限量(GB 29921—2013)》中规定了肉制品、水产制品、粮食制品、豆类制品、果蔬制品、饮料及冷冻饮品、即食调味品共8大类即食食品的致病菌的限量标准。除金黄色葡萄球菌和副溶血性弧菌按三级采样方案允许有一定检出外,沙门氏菌、单核细胞增生李斯特氏菌、大肠埃希氏菌O157:H7均要求无检出[8]。方便即食类食品的安全性是第一需求,杀菌除虫是食品安全的关键技术环节,是延长食品保质期、保证食品食用安全的必不可少的措施。传统热杀菌是保持食品安全和货架期的主要技术,但热加工易导致食品过度熟化和维生素等营养物质损失。非热加工技术是一种相对新兴的技术,在加工中产品温升很低,对食品的感官和营养品质影响小,可避免食品色、香、味、质构的改变及营养损失。电子束辐照作为一种安全卫生、低碳高效的非热杀菌除虫技术,在控制食源性疾病、杀灭有害昆虫方面具有独特优势,还可降低一些食品γ-射线加工的不良反应,能最大限度保持其原有的色、香、味,是不适于高温灭菌的冷冻、冷藏类食品加工的理想灭菌除虫技术。
研究证明,电子束能杀灭0157:H7大肠埃希氏菌、沙门氏菌属、李斯特氏菌属等食源性致病菌以及食物致腐微生物,在食品安全领域有良好应用前景[9]。1.5 kGy电子束辐照可杀灭鲜切哈密瓜接种的沙门氏菌[10];2 kGy电子束辐照可杀灭牛肉香肠中接种的沙门氏菌,产品感官特性未受到显著影响[11];3 kGy电子束辐照后,方便曲奇面团中接种大肠杆菌O157:H7、沙门氏菌、沙门氏菌、单核细胞增生李斯特菌均无检出,面团的色泽和质构较未辐照处理未出现显著差异[12];6 kGy电子束辐照可有效杀灭散装即食酱卤牛肉的大肠菌群和金黄色葡萄球菌[13]。辐照杀灭微生物的有效性受微生物辐射耐受性和微生物数量的影响,微生物的耐受性越强、数量越多,杀灭微生物需要的辐照剂量越高。鲜切果蔬等食品因品质保持需求,对辐照剂量有一定的限制要求,实际生产中辐照剂量较低。而亚致死的低剂量辐照作为一种外加的逆境刺激,可能引起微生物的应激反应,从而影响辐照效果。目前关于低剂量电子束处理对食源性致病菌生长影响还少见报道,作者以常见食源性致病菌大肠埃希氏菌、沙门氏菌、单核细胞增生李斯特氏菌、蜡样芽孢杆菌为对象,研究亚致死剂量电子束辐照对微生物生长的影响,以期为电子束辐照在食源性疾病控制中的应用提供参考。
1 材料与方法
1.1 材料
鼠伤寒沙门氏菌ATCC 14028、大肠埃希氏菌ATCC25922:购自广东环凯微生物科技有限公司;单核细胞增生李斯特氏菌BNCC336877:购自商城北纳创联生物科技有限公司;蜡样芽孢杆菌B10:购自上海市工业微生物研究所菌种保藏中心;培养基:购自北京陆桥技术股份有限公司。
1.2 供试菌液制备
鼠伤寒沙门氏菌、单核细胞增生李斯特氏菌、大肠埃希氏菌、蜡样芽孢杆菌冷冻甘油保藏菌种复苏,TSB培养基35℃培养过夜,PCA培养基划线接种,35℃培养48 h得到单菌落,挑取单菌落再次在TSB培养基于35℃培养过夜增菌,控制菌量在107水平,得到供试菌液。
1.3 辐照处理
1.3.1 致病菌辐照D10值 设定剂量为 0、0.4、0.8、1.2、1.6、2 kGy共6个水平,每个剂量水平设置3次重复。供试菌液加入无菌的一次性平板,每个平板10 mL菌液,加盖后用封口膜缠绕封口,电子束单面辐照,根据菌液可培养菌落数量计算D10值。
1.3.2 多次辐照的致病菌辐照D10值 供试菌液加入无菌的一次性平板,每个平板10 mL菌液,加盖后用封口膜缠绕封口,电子束单面辐照,辐照剂量设定 0、0.4、0.8、1.2、1.6、2 kGy 共 6 个水平,每个剂量水平设置3次重复。同样操作重复3次,得到多次亚致死剂量辐照的病原菌供试菌液,根据菌液可培养菌落数量分别计算每次辐照的D10值。
1.3.3 亚致死剂量辐照对致病菌生长曲线和生物被膜形成的影响 供试菌液加入无菌的一次性平板,每个平板10 mL菌液,加盖后用封口膜缠绕封口。根据致病菌D10值,选择亚致死的剂量辐照供试菌液,电子束单面辐照,辐照剂量设定0、2 kGy,每个剂量水平设置3次重复,每个重复10个平板。
1.3.4 亚致死剂量辐照对病原菌混合菌中百分比的影响 将大肠埃希氏菌、鼠伤寒沙门氏菌、单核细胞增生李斯特氏菌、蜡样芽孢杆菌供试菌液等比例混合,制备混合供试菌液。混合供试菌液加入无菌的一次性平板,每个平板10 mL菌液,加盖后用封口膜缠绕封口。根据致病菌D10值,选择亚致死的剂量辐照供试菌液,电子束单面辐照,辐照剂量设定0、2 kGy,每个剂量水平设置3次重复。
以上所有辐照利用清华同方威视IS1020电子加速器(10 MeV、20 kW)进行,使用重铬酸银液体化学剂量计对实际辐照剂量进行监测[14],剂量计的校准按照GB/T 16640—2008进行[15]。
1.4 方法
1.4.1 致病菌辐照D10值的计算 D10值是指将微生物总数降低一个数量级的辐照剂量,通过不同辐照剂量对应的致病菌可培养数量的对数值,建立线性拟合方程y=ax+b,D10值即为a的倒数的绝对值,其中:y为辐照剂量;x为致病菌可培养数量的对数值;a、b 为常数。
1.4.2 生长曲线测定方法 参考王蒙蒙方法稍做改动[16]。供试菌液5 000 r/min离心5 min,得到微生物菌体沉淀,用无菌生理盐水清洗沉淀后再离心,重复一次,将菌体沉淀用TSB培养基悬浮,控制菌量为102mL-1水平。采用12孔板测定,每个孔板加入菌液4 mL,35℃下静置培养,定期监测A600nm值,同时进行PCA平板菌落计数。
1.4.3 生物被膜测定方法 供试菌液于5 000 r/min离心5 min,得到微生物菌体沉淀,用无菌生理盐水清洗沉淀后再离心,重复一次,将菌体沉淀用TSB培养基悬浮,控制菌量为102CFU/mL水平。采用12孔板测定,每个孔板加入菌液4 mL,35℃下静置培养7 d,使用结晶紫染色法[17]测定生物被膜。
1.4.4 混合菌百分比分析方法 将处理后的混合供试菌液立即进行PCA平板菌落计数,同时将混合供试菌液5 000 r/min离心5 min,得到微生物菌体沉淀,用无菌生理盐水清洗沉淀后再离心,重复一次,将菌体沉淀用原体积的TSB培养基悬浮,再用TSB培养基适当稀释,调整菌量为102CFU/mL水平,35℃培养过夜后平板计数检测。大肠埃希氏菌、鼠伤寒沙门氏菌、单核细胞增生李斯特氏菌、蜡样芽孢杆菌分别采用伊红美蓝琼脂、亚硫酸铋琼脂、改良Mc Bride琼脂培养基、甘露醇卵黄多粘菌素琼脂基础平板计数,分析各菌种百分比。
1.5 统计分析
实验数据采用SPSS 13.0软件进行分析。
2 结果与分析
2.1 电子束辐照几种食源性致病菌的致死剂量分析
D10值是指将微生物总数降低一个数量级的辐照剂量,数值大小可反映微生物对射线的耐受能力,是辐照加工工艺中选择适宜灭菌剂量的重要参数[18]。从表1以看出,蜡样芽孢杆菌的D10值最高,其后依次是单核细胞增生李斯特氏菌和鼠伤寒沙门氏菌,大肠埃希氏菌的D10值最低,表明同样含量水平条件下,电子束辐照食源性致病菌的致死剂量要求由高到低依次为蜡样芽孢杆菌、单核细胞增生李斯特氏菌、鼠伤寒沙门氏菌、大肠埃希氏菌。
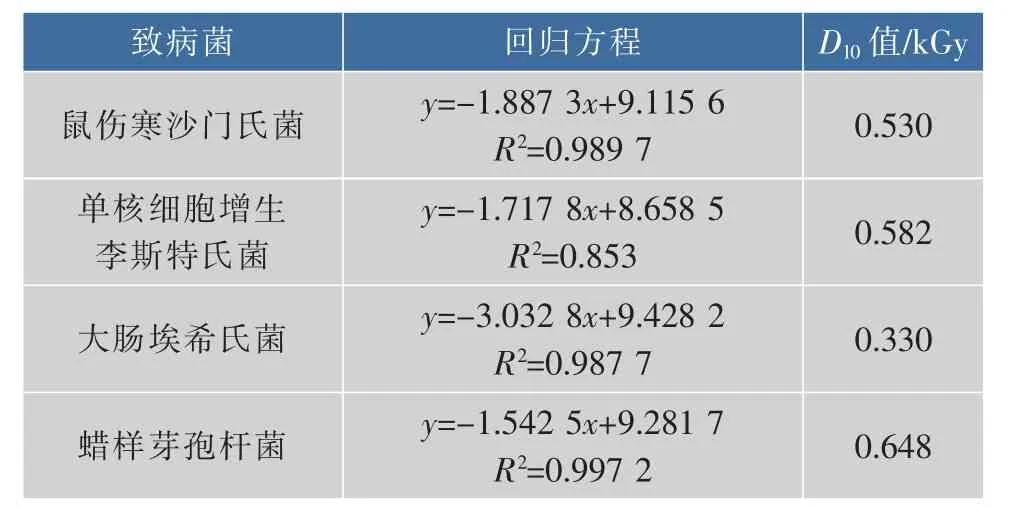
表1 4种食源性致病菌电子束辐照D10值Table 1 D10values of four foodborne pathogens irradiated by electron beam
2.2 多次辐照对食源性致病菌致死剂量的影响
辐照可杀灭微生物,引起可培养微生物数量大幅下降,同时作为一种逆境刺激,辐照可导致未被杀死的微生物产生损伤修复。研究表明,微生物主要通过快速修复受损的DNA片段、形成芽孢减缓新陈代谢速率、产生超氧化物歧化酶清除自由基等途径来降低辐照损伤[19]。辐照损伤修复可影响微生物对辐照的耐受特性。由图1可以看出,食源性病原菌电子束辐照的D10值随辐照次数增加而降低,降低幅度因病原菌种类和辐照次数不同而不同,其中第二次辐照时D10值下降幅度最大,不同病原菌之间以蜡样芽孢杆菌下降幅度最大,大肠埃希氏菌下降幅度最小。第三次辐照时不同种类病原菌的D10值趋于一致,菌间差异大幅减小。

图1 多次辐照对4种食源性病原菌D10值的影响Fig.1 Effect of multiple irradiation on D10values of four foodborne pathogens
2.3 亚致死剂量电子束辐照对4种致病菌生长曲线的影响
生长曲线的测定有助于了解菌株的生长及代谢情况。由图2可以看出,35℃下食源性致病菌生长曲线表现为接种后至4 h时 处于延迟期,4~12 h处于对数生长期,12~32 h处于稳定期,菌落的数量最高到108~109CFU/mL水平。电子束亚致死剂量辐照影响食源性致病菌的对数生长期的开始阶段,在同样2 kGy剂量处理下,大肠埃希氏菌的对数生长期明显滞后于对照处理,原因可能在于其较低的D10值。亚致死剂量辐照还影响食源性致病菌稳定期的菌落数量级水平,2 kGy剂量处理下,食源性致病菌稳定期的菌落数量级水平低于对照,其中沙门氏菌与对照的差别最大,蜡样芽孢杆菌与对照的差别最小。在25℃和15℃较低温度下培养时,食源性致病菌的生长呈缓慢增加趋势,25℃下60 h、15℃下84 h时对照处理的菌落数量级与35℃培养时的水平接近,2 kGy辐照处理的菌落数量级水平低于对照,其中15℃下2 kGy处理的菌落数量级明显低于未辐照处理,见图3~4。另外,5℃下培养时所有处理基本都无生长。

图2 35℃下亚致死剂量的食源性致病菌生长曲线Fig.2 Growth curve of foodborne pathogens irradiated by sublethal dose at 35℃
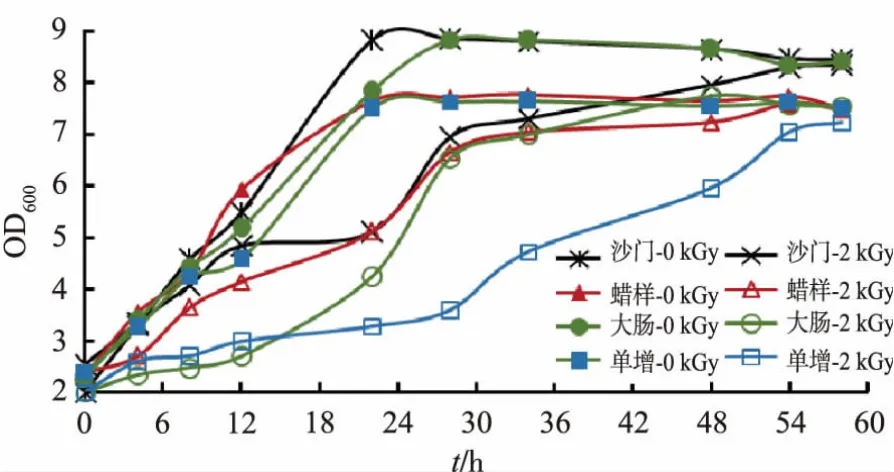
图3 25℃下亚致死剂量的食源性致病菌生长曲线Fig.3 Growth curve of foodborne pathogens irradiated by sublethal dose at 25℃

图4 15℃下亚致死剂量的食源性致病菌生长曲线Fig.4 Growth curve of foodborne pathogens irradiated by sublethal dose at 15℃
2.4 亚致死剂量电子束辐照对4种致病菌生物被膜形成的影响
生物被膜是致病菌控制中较难解决的问题,生长环境条件的变化对生物被膜的形成有着重要影响[17]。由图5可知,4种致病菌的生物被膜形成能力有较大差异,单核细胞增生李斯特菌成膜能力最强,其次是大肠埃希氏菌和蜡样芽孢杆菌,鼠伤寒沙门氏菌成膜能力最低。亚致死剂量电子束辐照对4种致病菌的生物被膜形成有明显影响,但其效果因致病菌种类而异,大肠埃希氏菌和蜡样芽孢杆菌的生物被膜形成量在亚致死剂量电子束辐照后有所增加,而单核细胞增生李斯特菌和鼠伤寒沙门氏菌则表现为降低。统计分析结果表明,电子束辐照对4种致病菌生物被膜形成的影响均为极显著水平,见表2。

图5 辐照对4种食源性致病菌生物被膜形成的影响Fig.5 Effect of irradiation on biofilm formation of four foodborne pathogens

表2 电子束辐照后4种食源性致病菌生物被膜形成量的差异分析Table 2 Difference analysis of biofilm formation of four foodborne pathogens after electron beam irradiation
2.5 亚致死剂量电子束辐照对4种致病菌数量比的影响
为探讨不同食源性致病菌共存时的竞争,研究了鼠伤寒沙门氏菌、单核细胞增生李斯特氏菌、大肠埃希氏菌和蜡样芽孢杆菌混合菌液的菌种数量比,见图6。首先通过稀释度控制和添加量控制保持菌混合液中各食源性致病菌占比基本一致,即0 kGy-0 h处理各菌数量比控制在23%~26%。混合菌液经2 kGy亚致死剂量辐照后,2 kGy-0 h处理的各菌数量比有较大变化,蜡样芽孢杆菌最高,其后依次是单核细胞增生李斯特氏菌和鼠伤寒沙门氏菌,大肠埃希氏菌最低,与其辐照D10值表现一致。经过35℃、18 h培养后,各食源性致病菌的占比发生变化,未辐照处理0 kGy-18 h各菌数量比差别不大,由高到低依次为鼠伤寒沙门氏菌、单核细胞增生李斯特氏菌、大肠埃希氏菌、蜡样芽孢杆菌;2 kGy辐照处理2 kGy-18 h表现为大肠埃希氏菌最低,其次是蜡样芽孢杆菌,其中亚致死剂量处理的蜡样芽孢杆菌占比从培养前的33.49%下降至25.06%,其他3种致病菌百分比都较培养前有所增加,表明辐照后的蜡样芽孢杆菌在混合菌液中生长受到抑制。
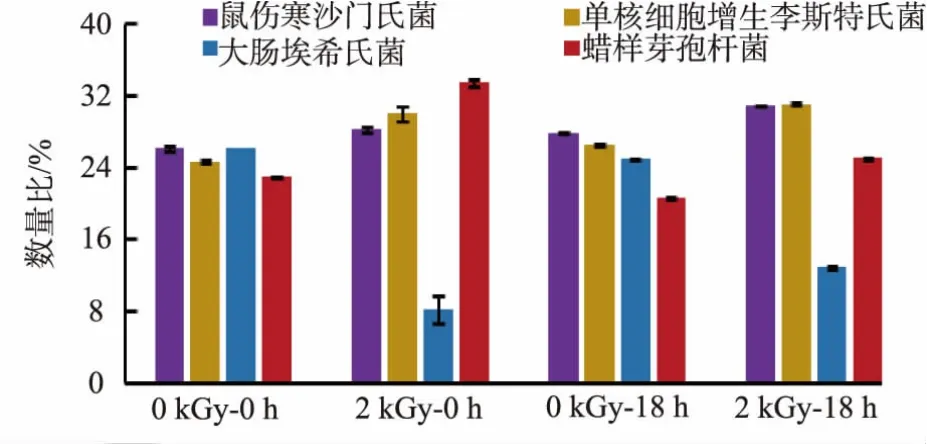
图6 辐照对4种食源性致病菌的数量比例的影响Fig.6 Effect of irradiation on the percentage of four foodborne pathogens
3 结 语
辐照作为一种逆境处理,对食源性致病菌的杀灭作用受到病原菌自身辐射耐受特性和环境条件的影响,D10值是反映微生物对射线耐受能力的指标[18],是辐照加工中剂量确定的主要参数,在产品微生物污染水平确定的条件下,D10值越高,微生物辐射耐受性越强,杀灭微生物的剂量要求就越高[18]。D10值在食品辐照加工业研究报道较多[20-21],为实现工艺目的,食品辐照加工中允许将所需的全部吸收剂量分多次进行照射[22],而有关多次电子束辐照处理条件下D10值的变化少见报道。本研究表明,4种食源性致病菌中,蜡样芽孢杆菌D10值最高,大肠埃希氏菌D10值最低,但不同致病菌D10值的差异在多次辐照条件下减小。多次辐照可引起致病菌的D10值下降,但其下降幅度并未随辐照次数增加而增加,不同致病菌的下降幅度也有所不同,随着辐照次数增加,各致病菌的D10值逐渐趋于接近。陈晓明等研究枯草芽孢杆菌辐射耐受性,从不同剂量1次中子辐照后的存活平板中随机挑取菌落,扩大培养后再次进行不同剂量的中子和γ射线辐照,发现中子1次辐照后,能显著提高中子和γ射线2次辐照杀死芽孢的能力[23],与本文结果一致。
微生物的生长繁殖有一定规律性,可分为延迟期、对数期、稳定期和衰亡期4个阶段,其中延迟期在食品工业中具有重要的实际应用价值,人们可以根据控制外界环境条件来延长延迟期的时间,一旦度过延迟期,即标志着食品保质期的结束[24-25]。本研究表明,2 kGy辐照处理可延长致病菌的延迟期时间,其中15℃下2 kGy处理的菌落数量级明显低于未辐照处理。研究也表明,加热和辐照均可延长蜡样芽孢杆菌生长延迟期,但加热不影响存活细胞的比生长速率,而辐照降低了最大生长速率,且其降低幅度与剂量相关[9],表明辐照处理的食品货架期比热处理长,对大肠菌群等食品中允许检出的病原菌控制方面意义重大。
细菌生物被膜是细菌黏附于物体表面,因自身分泌多糖蛋白复合物等物质形成的聚集膜,对细菌菌体具有强烈的保护作用,因其特殊的立体多层结构导致可到达被膜内层细菌的抗菌剂浓度低、渗透时间长,耐药性明显大于浮游细菌[17]。研究表明,李斯特菌、沙门氏菌等常见致病菌均易形成生物被膜,多见于食品加工厂房的地板、天花板及加工设备、工业管道的内外表面,不仅损害设备,而且会污染食品,传播食源性疾病[26]。不同种类致病菌的生物被膜形成能力有所差异,本研究条件下,单核细胞增生李斯特氏菌最强,鼠伤寒沙门氏菌最低。低剂量电子束辐照对4种食源性致病菌的生物被膜形成有极显著影响,鼠伤寒沙门氏菌、单核细胞增生李斯特氏菌成膜能力减弱,而大肠埃希氏菌、蜡样芽孢杆菌辐照后成膜能力增强,其机理和影响因子控制技术有待进一步研究。因此在食品原料和配料等产品的辐照加工中,剂量设定应该充分考虑相关因素。
辐照作为一种物理冷杀菌技术,已广泛应用于食品及其配料产品的消毒灭菌,其对生鲜食品的食源性致病菌控制方面前景良好。已有研究表明,冷却猪肉经0.5、1、2 kGy辐照后,肠杆菌科均受明显抑制,其中0.5、1 kGy处理显著低于对照,2 kGy处理极显著低于对照,同时假单胞菌水平也显著低于对照[27]。小麦粉3 kGy辐照时,蜡样芽孢杆菌从55 CFU/g 下降至未检出(<10 CFU/g)[28]。 0.68~2.32 kGy剂量范围内的辐照可有效控制鲜切圆生菜中的微生物而不影响其食用和感官品质,大肠菌群对数值为3.36时,1.46 kGy辐照处理4℃冷藏3 d时无检出,4 d时低于15 CFU/g,可有效控制圆生菜的大肠菌群[29]。本研究从微生物生长抑制方面证明,电子束辐照处理对食源性致病菌具有良好的杀灭作用,低剂量处理即可有效抑制致病菌生长繁殖,对鼠伤寒沙门氏菌、单核细胞增生李斯特氏菌的生物被膜形成还有极显著抑制作用。因此,可考虑适宜剂量电子束辐照结合低温等品质保持技术控制致病菌生长繁殖,降低致病菌的数量级水平,可有效延长产品货架期、保障食品卫生安全。
