血管紧张素II通过PI3K/Akt/FOXO1信号通路诱导骨骼肌细胞萎缩
2021-11-11李文雄丁凡付勇芳施杞张岩
李文雄 丁凡 付勇芳 施杞,3 张岩,3*
1. 上海中医药大学附属龙华医院,上海 200032 2. 陕西中医药大学,陕西 咸阳 712000 3. 教育部筋骨理论与治法重点实验室,上海 200032
肌肉是一种可塑性组织,能根据内外刺激而不断调整自身的形态、大小以及功能。局部肌肉萎缩常发生在制动或是神经缺失的肌肉中,如骨折后石膏固定的肢体、脊髓损伤后失去神经支配的肌肉等。老年、禁食或是营养不良的人群常会出现全身性的肌肉萎缩,这是机体的一种生理应答;同时,全身性肌肉萎缩还是对多种疾病的病理性应答,包括败血症[1]、艾滋病、肾功能衰竭[2]、心力衰竭、慢性阻塞性肺疾病[3]、糖皮质激素过多[4-5]和肿瘤恶病质[6-7]等。但目前对于肌肉萎缩的致病机制还不甚清晰,肌肉萎缩的治疗多局限于物理康复训练和少部分激素类药物的治疗。因此,深入探究肌肉萎缩的致病机制,对于采取有针对性的干预措施,研发抗骨骼肌萎缩药物,提高生活质量至关重要[8]。
血管紧张素II(angiotensin II, Ang II)是肾素-血管紧张素系统(renin angiotensin system, RAS)中的主要活性肽,通过与靶器官细胞膜上的特异性受体结合而发挥生理和病理效应。除了传统循环中的RAS以外,在骨骼肌中检测到血管紧张素转换酶活性和Ang II 1型受体(AT1R)的表达[9-10],提示Ang II在骨骼肌中也发挥着一定的调控作用。PI3K/Akt信号通路是调控肌肉生长活动的重要信号通路[11-12]。在大多数细胞中,该途径控制着细胞分裂,但在不分裂的肌肉细胞中,它会刺激机体蛋白质合成并抑制蛋白质降解[13]。在肌肉中,PI3K/Akt信号的磷酸化能够通过促进FOXO的磷酸化[14]来促进净蛋白积累,非磷酸化的FOXO位于细胞核中,通过促进肌萎缩基因(MURF1和MAFbx等)的表达,加剧肌萎缩;当FOXO被Akt磷酸化后,会向细胞质中转位,失去对肌萎缩基因的调控作用[15]。
因此,本文拟使用Ang II及其AT1R拮抗剂(AT1R blocker, ARB)奥美沙坦干预骨骼肌细胞,以探究Ang II是否在骨骼肌萎缩中发挥着一定的调控作用及其可能的作用机制。
1 材料和方法
1.1 试剂
血管紧张素II(Ang II)(日本PEPTIDE Institute公司,4001-V);奥美沙坦(美国Sigma公司,SML-1394);细胞用血清(上海博升生物,019BS0623);胰酶(0.25 %-EDTA,法国Biosera公司,11566);双抗(penicillin-streptomycin solution)(法国Biosera公司100X,12189);RIPA裂解液(强)(碧云天生物,P0013B);BCA蛋白浓度测定试剂盒(碧云天生物,P0012 S);MHC一抗(ab91506和ab51263)、MAFbx一抗(ab168372)和GAPDH一抗(ab181602)均购自英国Abcam公司;MyoD一抗(sc-37460)、MURF1一抗(sc-398608)均购自美国Santa Cruz Biotechnology公司;山羊抗兔IgG(H+L)(A0208)、山羊抗小鼠IgG(H+L)(A0216)均购自碧云天生物;抗兔的荧光二抗IgG (H+L)(美国,Cell Signaling Technology,4412)。
1.2 仪器
纯水仪(德国Think-Lab,W3T262974);高速冷冻离心机(美国Thermo Fisher Scientific,75002445);酶标仪(美国Bio Tek,Cytation3);蛋白印迹电泳系统(美国Bio-Rad,731BR01657);凝胶成像系统(美国Bio-Rad,ChemicDoc);全片扫描仪(日本Olympus,VS120-SL);细胞培养箱(德国Think-Lab,W3T262974)。
1.3 细胞
小鼠骨骼肌来源的C2C12成肌细胞,购自中国科学院典型培养物保藏委员会细胞库。
1.4 方法
1.4.1C2C12细胞的培养、分化和分组:购买的C2C12成肌细胞使用生长培养基(DMEM培养基+10 %胎牛血清+1 %双抗)培养,隔天换液1次,观察细胞生长状态,待细胞生长至70 %~80%融合时,按1∶3传代。待细胞生长稳定后,使用2 %的马血清诱导分化为肌管细胞。
C2C12细胞生长稳定后,待细把生长至80 %左右融合后,更换生长培养基为分化培养基(DMEM培养基+2 %马血清+1 %双抗),诱导细胞分化,隔天换液,5 d后可见成肌细胞融合分化为肌管细胞。
细胞分组:3组。对照组(Control):溶剂干预;模型组(Ang II):Ang II(10-7mol/L)干预48 h;奥美沙坦组(Ang II +ARB):先用奥美沙坦(10-6mol/L)干预30 min后,使用Ang II(10-7mol/L)干预48 h。
1.4.2免疫荧光染色:细胞铺板于12孔板细胞爬片上,分化5 d后形成肌管细胞,4 %多聚甲醛固定爬片15 min,PBS浸洗;0.2 % Triton X-100室温通透20 min,PBS浸洗,吸水纸吸干,滴加5 % BSA,室温封闭30 min;吸水纸吸掉封闭液,滴加足量的1 % BSA稀释好的一抗(MHC 1∶200),湿盒中4 ℃孵育过夜。第二天回收一抗,PBS浸洗爬片,吸水纸吸干爬片上多余的液体,滴加1 % BSA稀释好的荧光二抗(山羊抗小鼠 1∶200),室温湿盒中孵育1 h,PBS浸洗后,用含DAPI封片液封片,VS120全片扫描仪下观察采集图像。
1.4.3Western blot实验:药物干预48 h后的细胞倒掉培养液,从待测样本中提取细胞,BCA法检测蛋白浓度,煮沸变性,-20 ℃冰箱保存。用SDS-PAGE凝胶电泳分离等量的蛋白样品,然后将蛋白转移到PVDF膜上,用5 %的BSA于室温中封闭1 h后,使用不同的一抗(包括:MHC、MyoD、MURF1和MAFbx)于4 ℃摇床上孵育过夜。第二天使用山羊抗兔或小鼠 IgG-辣根过氧化物酶的二抗孵育1 h后,于凝胶成像系统检测目的蛋白含量的变化。采用Image J图像分析软件进行灰度值分析,目的蛋白的表达水平与GADPH灰度值比较得出。
1.5 统计学处理
2 结果
2.1 Ang II干预能够使肌管细胞面积减小
如图1所示,肌管细胞免疫荧光染色显示,与Control组对比,Ang II干预后,肌管细胞的平均直径和面积减小(P<0.001);与Ang II组相比,使用奥美沙坦干预后,肌管细胞平均直径和面积明显增大(P<0.01)。
2.2 Ang II能够促进肌管细胞泛素连接酶蛋白的表达
如图2所示,肌管细胞蛋白Western blot结果显示,与Control组对比,Ang II干预后,肌管细胞MURF1(P<0.05)和MAFbx(P<0.001)蛋白表达明显升高;使用奥美沙坦干预后,MURF1(P<0.01)和MAFbx(P<0.01)蛋白表达降低。
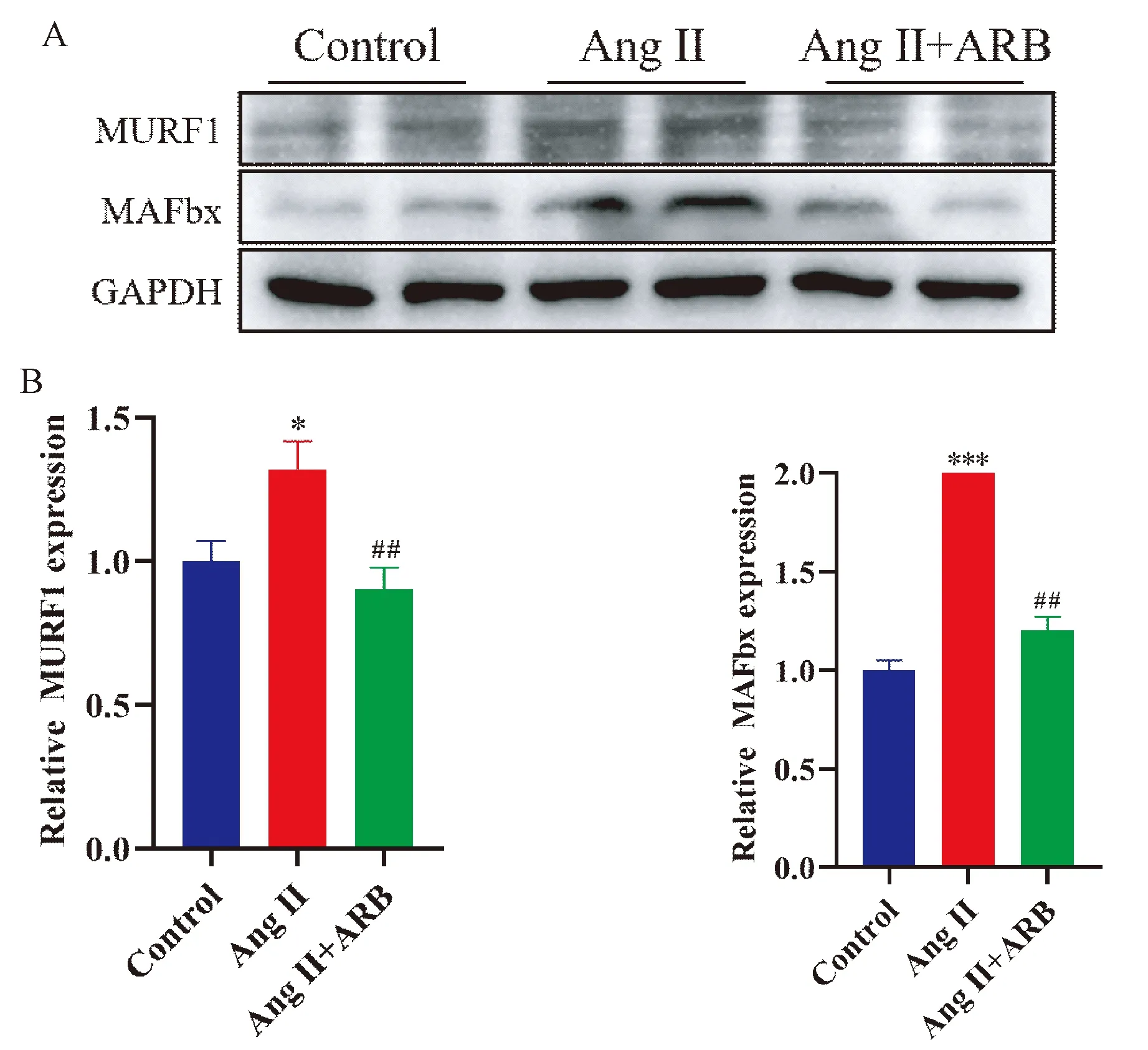
注:A 为肌管细胞泛素连接酶蛋白MAFbx和MURF1的WB条带图;B为A中蛋白的定量结果。与 Control组相比,*P<0.05,*** P<0.001;与Ang II组相比,## P<0.01。图2 WB 检测肌管细胞泛素连接酶蛋白的表达Fig.2 The expression of myotubule ubiquitin ligase was detected by WB
2.3 Ang II能够抑制肌管细胞生肌调节因子(MRFs)蛋白的表达
如图3所示,肌管细胞蛋白Western blot结果显示,与Control组对比,Ang II干预后,肌管细胞MHC(P<0.01)和MyoD(P<0.05)蛋白表达明显降低;使用奥美沙坦干预后,MHC(P<0.001)和MyoD(P<0.001)蛋白表达升高。
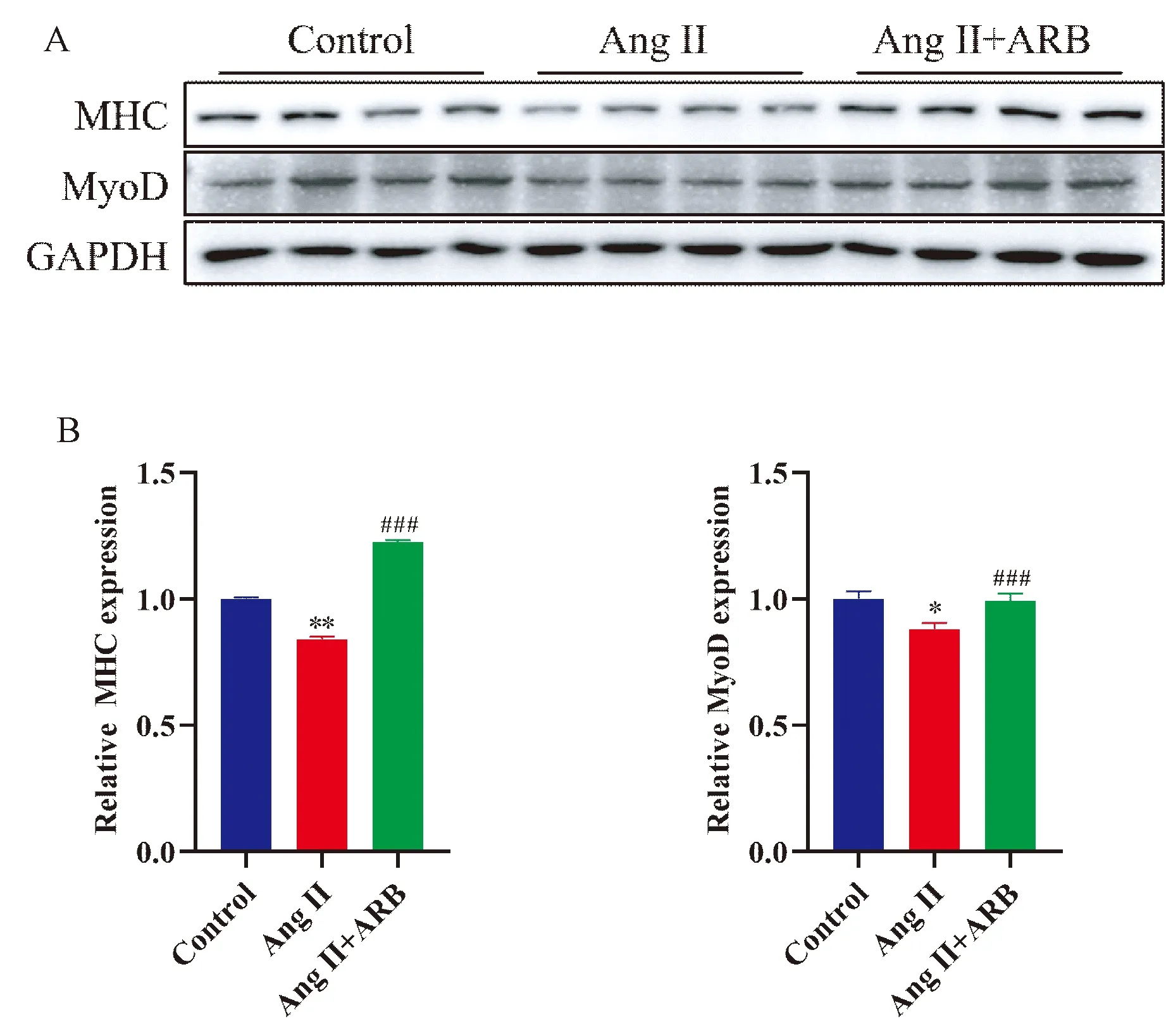
注:A 为肌管细胞MRFs蛋白MHC和MyoD的WB条带图;B 为A中蛋白的定量结果。与 Control组相比,*P<0.05,**P<0.01;与Ang II组相比,###P<0.001。图3 WB 检测肌管细胞MRFs蛋白的表达Fig.3 The expression of MRFs was detected by WB
2.4 Ang II能够抑制PI3K/Akt信号通路的磷酸化
如图4所示,肌管细胞蛋白Western blot结果显示,与Control组对比,Ang II干预后,肌管细胞PI3K(P<0.01)、Akt(P<0.001)和FOXO1(P<0.01)蛋白磷酸化降低;使用奥美沙坦干预后,PI3K(P<0.01)、Akt(P<0.001)和FOXO1(P<0.01)蛋白磷酸化较Ang II组升高。

注:A 为肌管细胞蛋白p-PI3K、PI3K、p-Akt、Akt、p-FOXO1和FOXO1的WB条带图;B 为A中p-PI3K/PI3K、p-Akt/Akt和p-FOXO1/FOXO1的定量结果。与 Control组相比,**P<0.01,***P<0.001;与Ang II组相比,##P<0.01,###P<0.001。图4 WB 检测肌管细胞PI3K/Akt/ FOXO1信号通路蛋白的表达Fig.4 WB detected the expression of PI3K/Akt/ FOXO1 signaling pathway in myotube
3 讨论
肌肉萎缩是一个受到严格程序控制的过程,涉及许多信号通路和效应蛋白,最终引起机体的合成和分解代谢平衡失衡,蛋白质降解大于蛋白质的合成,引起肌肉质量的降低。MURF1和MAFbx是两种肌肉特异性E3泛素连接酶,能够诱导蛋白的泛素化,以靶向26 S蛋白酶体进行蛋白水解,在多种肌萎缩诱导条件下均可见到这两种蛋白表达增加[16-17];更重要的是,抑制或是敲除这两种蛋白,能够改善,甚至是逆转多种肌萎缩模型条件下的肌肉损失;在固定或去神经支配后,MAFbx缺失的小鼠对去神经支配诱导的骨骼肌萎缩有抗性[18],MURF1基因的敲除能拮抗地塞米松诱导的骨骼肌和骨骼肌细胞萎缩[19-20]。因此,MURF1和MAFbx被广泛的应用为肌肉萎缩的标记蛋白。本文实验结果证实,Ang II干预后,C2C12细胞MURF1和MAFbx蛋白表达升高,而使用ARB干预后,MURF1和MAFbx蛋白表达明显降低,说明Ang II能够结合AT1R促进骨骼肌细胞蛋白的降解。
MyoD基因是生肌调节因子(myogenic regulatory factors, MRFs)[21]家族中调节成肌细胞分化方向的关键转录因子,是脊椎动物胚胎期肌肉发育的主导调控基因之一,对骨骼肌的形成和分化起主要作用,其缺失可导致成肌细胞的增殖和分化无法进行[18,22]。Tintignac等[23]研究发现,在C2C12成肌细胞中,MAFbx能与MyoD结合;过表达MAFbx,能够介导MyoD的蛋白水解,并且抑制成肌细胞的分化以及肌管细胞的形成;相反,使用shRNA沉默肌管细胞的MAFbx基因后,能够抑制的MyoD蛋白水解。同时,过表达MyoD突变基因,使MyoD不能与MAFbx结合,明显改善了饥饿诱导的小鼠肌肉萎缩[18],证实MyoD是MAFbx的泛素化底物之一。肌球蛋白广泛存在于肌细胞中并作为一种细胞骨架组成成分存在于非肌细胞中,是肌肉中重要的结构和功能型蛋白,主要功能是为肌肉的收缩提供动力。肌球蛋白重链(myosin heavy chain, MHC)是肌球蛋白的分子主干。研究发现,MURF1能够泛素化结合MHC等多种蛋白,在地塞米松诱导的骨骼肌萎缩模型中,MURF1基因的敲除,能够减少MHC蛋白的降解,改善骨骼肌萎缩;在体外C2C12细胞中,沉默MURF1基因能够减轻地塞米松诱导的骨骼肌细胞的萎缩[19]。Bowen等[20]筛选出抑制MURF1基因的小分子化合物干预野百合碱诱导的肌萎缩模型,发现小分子化合物能够改善肌肉萎缩和肌肉收缩功能障碍,提示MHC是MURF1的泛素化底物之一。文中研究结果证实,在Ang II干预后,肌管细胞平均直径和面积明显减小,随着MURF1和MAFbx蛋白表达升高,MHC和MyoD蛋白表达降低,而是用ARB干预后,肌管细胞平均直径和面积较Ang II增大,随着MURF1和MAFbx蛋白表达的降低,MHC和MyoD蛋白表达升高,说明Ang II能够抑制骨骼肌细胞蛋白的合成。
PI3K/Akt信号通路主要参与细胞增殖、分化等多种细胞功能的调节,研究发现,PI3K/Akt信号通路活性降低可导致肌肉萎缩[24-25],抑制PI3K和Akt的表达可降低肌管大小[26],缺乏Akt1和Akt2基因的的小鼠肌肉明显减小[27]。相反,在大鼠肌肉中激活Akt基因可以防止因去神经支配而诱导的肌萎缩[28]。PI3K抑制剂能够抑制地塞米松诱导的肌管细胞肌萎缩基因的表达和蛋白的降解[29-30]。提示激活PI3K/Akt信号通路能够抑制肌原纤维蛋白的降解和肌萎缩基因的表达。FOXO转录因子是PI3K/Akt信号通路的一个下游靶点,在肌肉中具有三种亚型,FOXO1、FOXO3和FOXO4;当磷酸化时,这三种亚型都驻留在细胞质中,需要去磷酸化后才能进入细胞核中发挥转录作用[15,31]。Akt已经被证明可以磷酸化FOXO家族成员,从而阻止FOXO蛋白转运到细胞核[24,32]。研究发现,FOXO家族转录因子也是MAFbx和MURF1基因表达的重要调控因子,多种肌萎缩模型都能促进FOXO转录因子的去磷酸化,促进肌萎缩基因MAFbx或MURF1等表达[24,33-34]。而当FOXO信号通路的缺失时,则抑制肌纤维表达MAFbx或MURF1的能力,改善肌萎缩[35]。实验结果证实,Ang II干预后,能够抑制PI3K、Akt和FOXO1的磷酸化,促使FOXO1从胞质转位入核,促进肌萎缩基因MAFbx或MURF1蛋白的表达,而使用ARB预处理后,能够拮抗Ang II对肌细胞的作用。
综上可知,Ang II能够通过结合AT1R抑制骨骼肌细胞PI3K/Akt/FOXO1信号通路的磷酸化,促进骨骼肌细胞蛋白的降解,抑制蛋白的合成。本文通过探究Ang II在骨骼肌萎缩中的作用机制,加深了人们对骨骼肌萎缩机制的认识,有助于研发干预、甚至是靶向治疗骨骼肌萎缩的药物。但目前仅基于体外实验研究的结果证据力度仍较单薄,后期将继续进行动物实验,并在基础实验探究正确的情况下,进一步进行相应的临床试验,加强证据力度。
