miR-214通过对BMP-2和Smad4的靶向调控作用对骨质疏松的影响
2021-11-11肖锐周芳丽万春虎华水生李韶辉
肖锐 周芳丽 万春虎 华水生 李韶辉
江西中医药大学附属洪都中医院,江西 南昌 330000
骨质疏松症(osteoporosis,OP)属于低骨量且骨微结构被损伤导致的骨折风险系数上升的骨代谢病,其发病原因呈现多样化,根据发病原因的不同分为原发性和继发性。OP临床发病人数正逐年上升,因此受到医学界的重点关注[1]。骨代谢紊乱是导致骨质疏松等骨代谢疾病的主要原因,许多研究[2-3]表明,microRNA(miRNA)在骨代谢的各个过程中都起到一定的作用。其中miR-214近年来被发现在骨代谢中起着重要的作用[4],与老年性骨质疏松以及绝经后骨质骨质疏松密切相关[4-5]。miRNA通过靶向作用于骨吸收因子、成骨因子及其他骨代谢调控因子,参加BMSCs、OB、破骨细胞(osteoclast,OC)的增殖和分化过程,对骨代谢过程进行调控。BMP-2/Smad通路是骨髓间充质干细胞(BMSCs)向成骨细胞(osteoblast,OB)诱导分化的主要信号通路之一。BMP-2和其他骨形态形成蛋白(bone morphogenetic protein,BMPs)家族成员在骨和软骨的发育过程中起着重要作用,同时Smad4是骨形态发生中重要的介导因子之一,并且在BMPs信号转导途径中具有重要作用[6]。因此我们推测,miR-214可能通过靶向调控Smad4和BMP2对骨质疏松产生一定的影响,为了验证我们的推测,我们进行了以下实验。
1 材料和方法
1.1 实验动物
SPF级SD大鼠。雌性,2~3月龄,体重200±20 g,购于南方医科大学实验动物中心,动物许可证号SCXK(粤)2018-0085,实验动物合格证号:44002100012977。环境:2只/笼,温度:20±2 ℃,空气湿度:50 %~60 %,12 h明暗交替光照,饲料由南方医科大学实验动物中心提供,大鼠自由饮水和进食。
1.2 主要试剂及仪器
DMEM(L)培养液(上海恒斐生物科技有限公司 货号:31600),BMP-2抗体、SMAD4抗体、GAPDH抗体(美国 BIOYK 货号:YKA-AP51012、YKA-AP51526、YKA-AP50864),SYBR qPCR试剂盒(RT-PCR两步法试剂盒)EzOmicsTM SYBR qPCR Kit(百奥迈科生物技术有限公司 货号:BK2200-2203),Lipofectamine 2000(美国 Invitrogen 货号:11668019),miR-214 mimics(miR-214模拟物)及anti-miR-214(miR-214抑制剂)由上海吉玛生物技术有限公司合成,ROS1728/大鼠成骨细胞购于广州弗尔博生物科技有限公司(货号:FB624),FACSCalibur流式细胞仪(美国BD公司),MK3酶标仪(美国Thermo公司)。
1.3 模型制备
参照张春丽等[7]建模方法建立大鼠骨质疏松模型。在大鼠适应性饲养1周后,将大鼠随机分为2组,每组10只,分为假手术和双侧卵巢结扎摘除术(手术)组。2组大鼠使用1 %戊巴比妥钠(4 mL/kg)麻醉后,对大鼠进行背侧切口,位于腋中线、最末肋下、距脊柱外侧2 cm左右处,使用碘伏进行切口及周边消毒,逐层切开脂肪肌肉组织,分离脂肪团,能够看到粉红或黄红色的卵巢器官,手术组结扎输卵管并进行卵巢摘除,最后缝合肌肉、皮肤,再次使用碘伏进行消毒,术后给予青霉素肌肉注射预防感染。同法摘除另一卵巢。假手术仅切除卵巢旁边相同大小脂肪组织。术后定量喂食,自由饮水。在术后第8周,处死大鼠,各组大鼠取静脉血分离血清,用BK-800全自动生化分析仪进行检测,采用上海纪宁实业有限公司提供的Ca2+、P、ALP试剂盒测定血清骨代谢指标:血清中钙离子、磷及碱性磷酸酶(ALP)水平;血Ca2+、P、ALP水平可作为临床上的骨质疏松症有效监测指标,既可观测绝经后骨质疏松症的预防、严重程度、预后以及观察疗效血清骨代谢指标。取大鼠双侧股骨进行病理切片观察股骨组织形态学结构,分离并检测胫骨骨密度(BMD)。
1.4 大鼠骨髓间充质干细胞(BMSCs)培养
在术后处死各组大鼠后,在无菌条件下分离出双侧股骨、胫骨,去除附着于骨表面的软组织,浸泡于L-DMEM培养液中。剪切除两端骨骺,显露骨髓腔,L-DMEM培养液反复冲洗骨髓腔,以冲出骨髓,直至骨髓腔变白后停止。收集骨髓悬液于离心管中,1 000 r/min室温下离心3~5 min;去上清,用含10 %胎牛血清的L-DMEM完全培养液重悬细胞,制成单细胞悬液,转移至培养瓶中,置于37 ℃、5%的CO2培养箱中进行培养。约3 h后首次换液,以后每48 h换液1次,显微镜下观察细胞形态与生长情况。待细胞密度达到80 %~90 %时,进行传代,吸去培养液,以预热的PBS轻轻冲洗后,去掉PBS。加入适量胰蛋白酶消化后,于培养箱中温育1~2 min,在显微镜下观察细胞形态变化,待细胞之间突起消失、变圆后,加入含10 %胎牛血清的DMEM培养液终止消化,用吸管反复吹打3~5次后转移至离心管,1 000 r/min室温下离心5 min,弃上清,用含10 %胎牛血清的DMEM培养液重悬细胞,用吸管吹打成细胞悬液3~5次,接种于新的培养瓶中,置于37 ℃、5 %的CO2培养箱中继续培养。每48 h换液1次,此时细胞初代细胞。细胞传代至第3代时,取各组 BMSCs细胞,将细胞浓度调整为1×105个/mL,将细胞接种至96孔板,每孔100 μL细胞悬液、每组设置6个复孔。在接种后,每48 h换液一次,并在第 0、2、4、6 天使用CCK8法检测各组细胞在450 nm波长处的吸光度值,同时检测细胞的增殖能力。在接种培养后第4天时,取部分细胞移除培养基,裂解细胞后通过全自动生化分析仪测定每组细胞的 ALP 水平。
1.5 qPCR检测各组大鼠BMSCs中miR-214表达情况
将第3代各组BMSCs使用Trizol法提取总RNA,并检测总RNA的纯度,再以400 ng的RNA为模板使用SYBR qPCR试剂盒将RNA反转录为cDNA,将反转录的cDNA样品适当比例稀释后,进行荧光定量PCR,按照qPCR扩增反应试剂盒进行操作。反应体系为20 μL:SYBR RT-PCR Master Mix 10 μL,Plus solution 2 μL,H2O 6 μL,上下游引物各0.5 μL,cDNA 1 μL。反应程序:95 ℃ 1 min,95 ℃ 15 s,60 ℃ 15 s,72 ℃ 45 s,共循环40次。以GAPDH作为内参,扩增结果用2-ΔΔCq法进行分析。扩增相关引物见表1。

表1 扩增相关引物Table 1 Amplification related primers
1.6 Western blot检测各组大鼠BMSCs中BMP-2、Smad4表达情况
收集第3代各组大鼠BMSCs,提取细胞总蛋白,用考马斯亮蓝法测定蛋白浓度。定量好的蛋白经SDS-PAGE分离后转至PVDF膜上,室温封闭2 h,加入Smad4、BPM-2和GAPDH一抗(1∶1000),4 ℃孵育过夜。TBST重复洗膜3次,加入二抗(1∶1000),室温孵育1 h。TBST洗膜后,ECL发光液曝光显影,凝胶图像分析系统采集图像,Image J2x软件分析条带的灰度值,实验重复 3 次后进行统计分析。
1.7 ROS1728/大鼠成骨细胞的转染与检测
将ROS1728/大鼠成骨细胞分为3组,对照组、过表达组和抑制组。采用脂质体Lipofectamine 2000转染法将miR-214 mimics(miR-214模拟物)及anti-miR-214(miR-214抑制剂)分别转入表达组和抑制组,转染48 h后,提取总RNA检测转染是否成功。在检测转染成功后将细胞计数并接种于96孔板中,之后每48 h使用CCK8法检测细胞增殖能力,同时检测使用流式细胞仪检测细胞凋亡程度。使用1.5,1.6的方法提取细胞总RNA和总蛋白,检测相关RNA及蛋白表达水平。
1.8 统计学处理

2 结果
2.1 各组大鼠血清中钙离子、磷、ALP水平及骨密度情况
检测结果发现,与假手术组相比,手术组大鼠血钙、ALP水平及BMD明显下降,组间差异具有统计学意义(P<0.05)。同时手术组大鼠与假手术组相比血磷水平明显上升,组间差异具有统计学意义(P<0.05), 提示造模成功。见表2。

表2 各组大鼠血清中钙离子、磷、ALP浓度及骨密度情况Table 2 Serum calcium ion, phosphorus, ALP concentration and bone mineral density of rats in each group
2.2 大鼠股骨病理切片
从大鼠股骨病理切片可以看出,假手术组股骨近段骺板软骨细胞呈柱状,同时增值层、静止层级肥大层软骨细胞分界清晰,与假手术组相比,手术组股骨近段骺板软骨层变狭窄,软骨细胞数量明显减少且排列无规则。见图1。

注:A 假手术组;B 手术组;40×。图1 两组大鼠股骨病理切片Fig.1 Pathological sections of femurs of two groups of rats
2.3 大鼠BMSCs相关检测结果
对体外培养的大鼠BMSCs进行检测发现,两组大鼠的BMSCs增长速率相比差异无统计学意义(P>0.05),见图2。同时对BMSCs中ALP水平进行检测,发现假手术组大鼠ALP水平显著高于手术组,差异具有统计学意义(P<0.05),见图3。与假手术组(0.98±0.21)相比较,手术组(3.36±1.17)miR-214表达量明显上升,差异具有统计学意义(P<0.05)。同时假手术组大鼠BMSCs中BMP-2及Smad4表达水平都高于手术组,组间差异具有统计学意义(P<0.05),见图4、表3。

表3 各组大鼠BMSCs中Smad4和BMP2相关蛋白表达灰度值比较

图2 大鼠BMSCs体外培养细胞增殖能力检测结果Fig.2 Test results of cell proliferation ability of rat BMSCs cultured in vitro

注:与假手术组比较,*P<0.05。图3 大鼠BMSCs中ALP水平检测结果Fig.3 The detection results of ALP concentration in rat BMSCs

图4 各组大鼠BMSCs中Smad4和BMP-2相关蛋白表达情况Fig.4 The expression of Smad4 and BMP-2 related proteins in BMSCs of rats in each group
2.4 ROS1728/大鼠成骨细胞细胞转染效率
在对转染后的ROS1728/大鼠成骨细胞中miR-214进行检测后,结果显示,对照组(0.82±0.14)及过表达组(4.46±1.29)均有miR-214表达,抑制组(0.126±0.028)中miR-214表达显著降低,同时过表达组miR-214表达水平显著高于对照组,组间差异具有统计学意义(P<0.05),转染率大于95 %,说明RNA转染成功。
2.5 ROS1728/大鼠成骨细胞增殖能力和细胞凋亡程度检测结果
通过对体外培养的ROS1728/大鼠成骨细胞增殖能力进行检测后发现,在4 d后,过表达组与对照组相比,细胞增殖能力明显下降,组间差异具有统计学意义(P<0.05)。同时抑制组细胞增殖情况在8 d后显著高于对照组及过表达组,组间差异具有统计学意义(P<0.05),见图5。使用流式细胞仪对ROS1728/大鼠成骨细胞的细胞凋亡情况进行检测后发现,过表达组细胞凋亡情况显著高于对照组和抑制组,组间差异具有统计学意义(P<0.05)。同时过表达组与对照组相比较,过表达组细胞凋亡程度低于对照组,差异具有统计学意义(P<0.05),见图6。
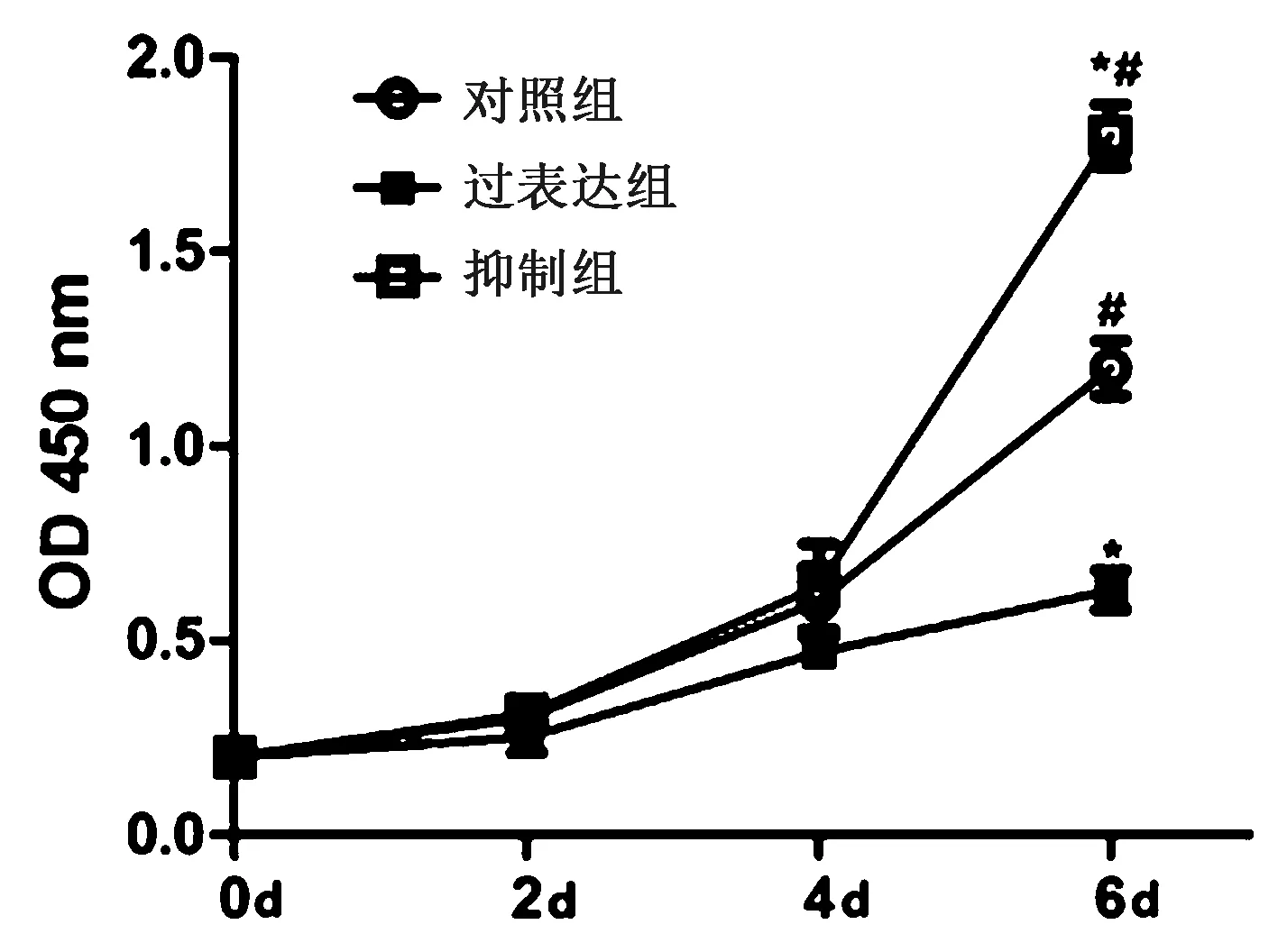
注:与对照组比较,*P<0.05;与过表达组比较,#P<0.05。图5 ROS1728/大鼠成骨细胞增殖情况Fig.5 Proliferation of ROS1728/rat osteoblasts

图6 ROS1728/大鼠成骨细胞细胞凋亡情况Fig.6 Apoptosis of ROS1728/rat osteoblasts
2.6 ROS1728/大鼠成骨细胞相关蛋白表达情况
ROS1728/大鼠成骨细胞各组,对照组和抑制组BMP-2及Smad4表达水平均高于过表达组,组间差异具有统计学意义(P<0.05)。对照组与抑制组相比较,抑制组中BMP-2及Smad4表达水平高于对照组,差异具有统计学意义(P<0.05),见图7、表4。
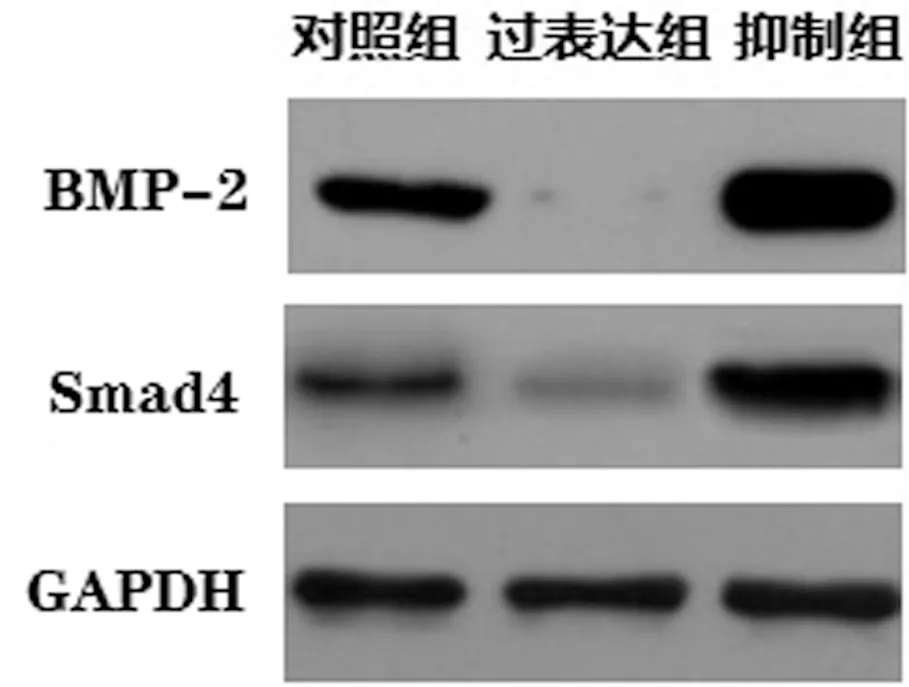
图7 各组大鼠成骨细胞中Smad4和BMP-2相关蛋白表达情况Fig.7 The expression of Smad4 and BMP-2 related proteins in rat osteoblasts in each group

表4 各组大鼠成骨细胞中Smad4和BMP-2相关蛋白表达灰度值比较
3 讨论
成骨细胞由间质干细胞(mesenchymal stem cell,MSC)分化而来,成骨细胞经过增殖、分化、成熟和矿化等阶段逐渐凋亡或成为骨细胞(osteocyte)、骨衬细胞(bone lining cell)。成骨细胞的分化在不同的阶段受到不同的调节因子的调控,并表达不同的产物。成骨细胞直接参与骨的形成,在生物体中起至关重要的作用[7]。有大量的实验[8-10]证实,miRNA参与骨代谢的各个过程,miRNA能够与其靶基因进行特异性结合,控制下游的蛋白翻译或者剪切降解特定的mRNA序列从而调控靶基因的后续表达。miRNA能够靶向对骨吸收因子、成骨因子及其他因子进行调控,参加BMSCs、OB、破骨细胞(osteoclast,OC)的增殖和分化过程,对骨代谢过程进行调控。
近年来,miR-214发现在骨代谢过程中起关键作用。有研究[11]发现,miR-214能通过结合转录激活因子(activating transcription factor 4,ATF4)抑制其蛋白的表达进而抑制骨的生成,同时miR-214能靶向作用于Osterix,使骨分化过程被抑制[4]。在BMSCs分化为成骨细胞及胞外基质过程中,BMP-2/Smad信号通路发挥了极其重要的作用。Smad家族是TGF-β信号介导成员之一,能将TGF-β信号从细胞膜转导至细胞核内。Smads被磷酸化后,与通常介导分子Smad4相互作用形成三聚体,转入细胞核内进而影响靶基因的转录[12]。实验表明,BMPs在OB分化过程中至关重要,BMPs通过抑制BMSCs分化成为肌肉细胞和脂肪细胞,达到促进成骨细胞分化和骨形成的结果[13]。BMP-2是公认的成骨细胞转化促进因子,BMP-2与细胞膜上的受体结合后激活细胞内相关因子磷酸化,与Smad4相结合由细胞质转入细胞核。在本研究中,与手术组相比较,假手术组BMSCs细胞中miR-214表达明显上升;同时假手术组大鼠BMSCs中BMP-2及Smad4表达水平都高于手术组。这一结果提示,在BMSCs向成骨细胞分化过程,过表达的miR-214会抑制骨分化过程,反之能促进骨分化过程的进行,与此前研究[14]相符。有学者[15]通过运用miR-214激活剂和拮抗剂转染小鼠成骨细胞系MC3T3-E1,研究表明,高表达miR-214组与空白对照组、拮抗miR-214组相比能够一定程度降低骨钙素和ALP水平的同时下调相应的蛋白质浓度,降低ALP的染色效果,并阻止钙化结节生成,而且发现此抑制效应会持续地存在于成骨细胞基质矿化过程当中。本研究中,通过对大鼠成骨细胞转染miR-214 mimics及anti-miR-214后,过表达组较对照组细胞增殖能力显著降低、细胞凋亡数量明显上调,同时抑制组细胞增殖情况在8 d后显著高于对照组及过表达组,也佐证了此前研究结果。对大鼠成骨细胞中BMP-2和Smad4相关蛋白检测后发现,对照组和抑制组BMP-2及Smad4表达水平均高于过表达组,对照组与抑制组相比较,抑制组中BMP-2及Smad4表达水平高于对照组。
综上所述,miR-214能靶向抑制BMP-2与Smad4进而抑制成骨细胞的增殖,从而发生或发展成骨质疏松症。骨质疏松症发病机制复杂,本研究为miR-214对骨代谢影响的进一步研究提高了一定参考依据。
