基于网络药理学预测补阳还五汤治疗动脉粥样硬化的药效物质与作用机制
2021-11-11王玮玮姜丽李冰涛翟兴英刘玉晖徐国良江西中医药大学中医基础理论分化发展研究中心南昌0004江西省中医病因生物学重点实验室南昌0004江西省中药药理重点实验室南昌0004
★ 王玮玮 姜丽,2, 李冰涛,2, 翟兴英 刘玉晖 徐国良,2,(.江西中医药大学中医基础理论分化发展研究中心 南昌 0004;2.江西省中医病因生物学重点实验室 南昌 0004;.江西省中药药理重点实验室 南昌 0004)
[关键字]补阳还五汤;动脉粥样硬化;网络药理学;药效物质基础;作用机制
中医认为动脉粥样硬化(atherosclerosis,AS)证候要素主要有血瘀、痰浊、气虚,为本虚标实之病,标实为血瘀、痰浊,本虚为气虚,初期以气滞血瘀为主,中期以气血虚弱是关键,后期则出现气虚痰瘀闭阻之象,故临床上常以补气、活血药物治疗[1]。补阳还五汤为益气活血之名方,出自清代王清任所注《医林改错》,全方由黄芪、当归尾、川芎、赤芍、桃仁、红花、地龙组成,将大剂量补气药和活血化瘀药配伍使用,既能提高活血化瘀的能力以祛邪,又能促使旧血排出、新血生成而扶正,继承并丰富了中医学的扶正祛邪、标本兼治治疗方法[2]。实验研究表明,补阳还五汤可调控动脉粥样硬化模型炎症因子[3],抑制同型半胱氨酸所致Apo E-/-小鼠AS病变与提高紧密连接蛋白表达量[4],下调主动脉组织血管细胞黏附分子1 mRNA的表达与降低血脂[5]。临床相关报道补阳还五汤可降低颈动脉粥样硬化患者的血管阻力、颈动脉内膜中层厚度,动脉粥样硬化的患者实施治疗的临床效果非常明显[6-7]。但是,补阳还五汤治疗AS的药效物质以及作用机制仍然显得模糊不清。Hopkins最早提出将网络药理学用于中药药理学研究[8],网络药理学从系统的角度展现中药多成分多靶点间的相互联系和作用,在不拆分中药各成分的前提下对中药可能的作用机制进行分析研究,这与传统中药通过多重靶点对病患机体进行整体调节的观点相一致[9-10]。目前,基于网络药理学预测补阳还五汤抗动脉粥样硬化药效物质基础与作用机制相关报道较少,主要集中在基于网络药理学预测分析补阳还五汤抗脑梗死、脑缺血等疾病的药效物质及作用机制[11-14]。因此,本研究借助网络药理学方法对补阳还五汤抗动脉粥样硬化药效成分以及作用机制进行了预测与分析,为下一步实验验证研究提供思路与方向。
1 材料
TCMSP(http://tcmspw.com/tcmsp.php)数据库、Pubmed(https://www.ncbi.nlm.nih.gov/pubmed)数据库、Swiss Target Prediction(http://www.swisstargetprediction.ch/)在线分析平台、DisGeNET(http://www.disgenet.org/web/DisGeNET/menu)数 据 库、Cytoscape 3.7.1,DAVID(the database for annotation visualization and integrated discovery)在线分析平台以及Omicshare在线作图工具。
2 方法
2.1 补阳还五汤潜在活性成分的获取 分别以“桃仁”“红花”“赤芍”“川芎”“当归”“黄芪”“地龙”为检索词,以OB(口服生物利用度)≥30 %,Lipinski五 规 则:(1)分 子 量(molecular weight,MW)<500 Da;(2)氢键受体(H-bond acceptor,HAcc)≤10;(3)氢 键 供 体(H-bond donor,HDon)≤5;(4)脂水分配系数的对数值(Alog P,即由软件ACD测出的log P),-2≤Alog P≤5;(5)可旋转键(RBN)≤10为过滤条件[15]。从TCMSP数据库中筛选出7味中药的潜在活性成分。
2.2 补阳还五汤潜在活性成分药物靶点的收集 利用pubmed数据库将上一步筛选出的补阳还五汤各潜在活性成分都转化为标准的SMILES格式(canonical SMILES),将SMILES格式文件导入Swiss Target Prediction在线分析平台,设置属性为“Homo sapiens”,预测潜在活性成分靶点并以csv格式文件导出作用靶点。
2.3 动脉粥样硬化疾病靶点的收集 在疾病数据库DisGeNET中输入关键词“atherosclerosis”,设置属性为“homo sapiens”,获得与动脉粥样硬化相关靶点59个。
2.4 动脉粥样硬化疾病靶点与补阳还五汤潜在活性成分靶点的映射 通过比较补阳还五汤潜在活性成分作用靶点与动脉粥样硬化疾病靶点的共同部分,得到该汤剂治疗动脉粥样硬化的活性靶标。
2.5 网络的构建和分析 将“2.1”“2.3”项下获得的药材活性成分及活性靶标,利用Cytoscape 3.7.1该软件中的network analyzer插件进行网络拓扑性分析,如:度(degree)、介数中心度(betweenness centrality)和紧密中心度(closeness centrality)等。
2.6 GO富集分析和KEGG通路富集分析 采用在线分析工具DAVID对“2.4”项下的结果中的活性靶点基因进行GO通路分析和KEGG生物过程分析,其中GO分析中包括生物过程(BP)、细胞组成(CC)和分子功能(MF)3个部分,在分析结果选择P<0.01的项目,认为在该条件下,结果具有统计学意义。
3 结果
3.1 补阳还五汤潜在活性成分的获取结果 以“OB(口服生物利用度)≥30 %,Lipinski五规则”为筛选条件。198个成分满足条件,可被作为的潜在活性成分用于后续研究。除地龙外,红花、桃仁、赤芍、川芎、当归、黄芪6味药材各筛选获得潜在活性成分33、13、16、88、59、21个,6味药材中的潜在活性成分有重合部分。
3.2 动脉粥样硬化疾病靶点与补阳还五汤潜在活性成分靶点的映射 将“2.2”项下中的药材潜在活性成分靶标与动脉粥样硬化疾病靶标交集,获得30个相互作用靶标。靶标具体信息见表1。
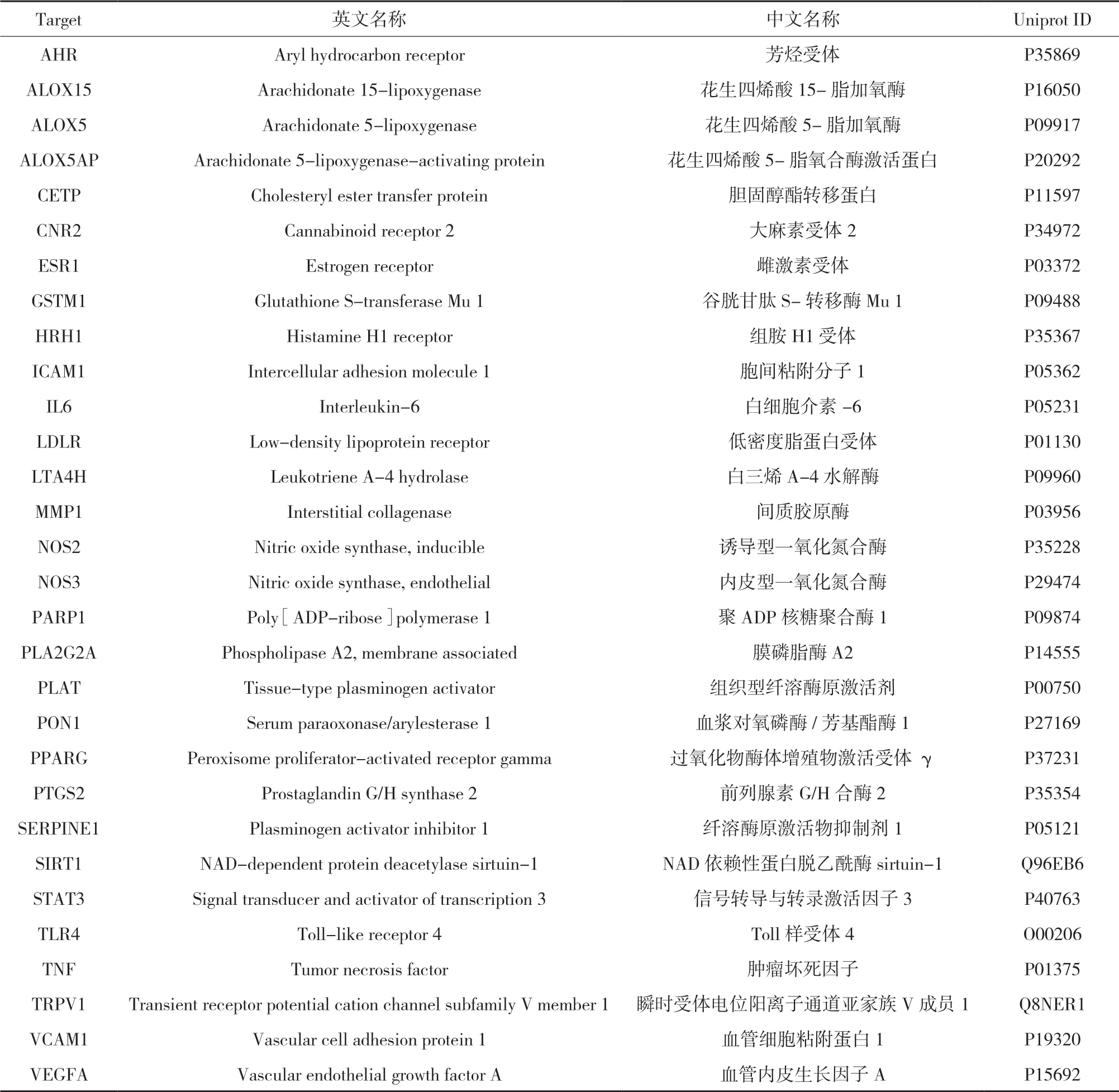
表1 补阳还五汤治疗AS靶点信息
3.3 网络的构建与分析 利用Cytoscape 3.7.1软件中的network analyzer插件对“3.1”“3.2”项下的198个药材潜在活性成分与30个抗动脉粥样硬化靶标进行网络拓扑性分析,以度、介数中心度和紧密中心度为依据,对活性成分和靶标分别进行筛选,得到3项数值均在平均值以上的关键活性成分66个和关键靶标8个,拓扑分析结果见表2-3。各药材中的关键活性成分与关键作用靶标有一定重合。同时利用Cytoscape 3.7.1软件构建“药材-关键活性成分-靶标”网络关系图,见图1。
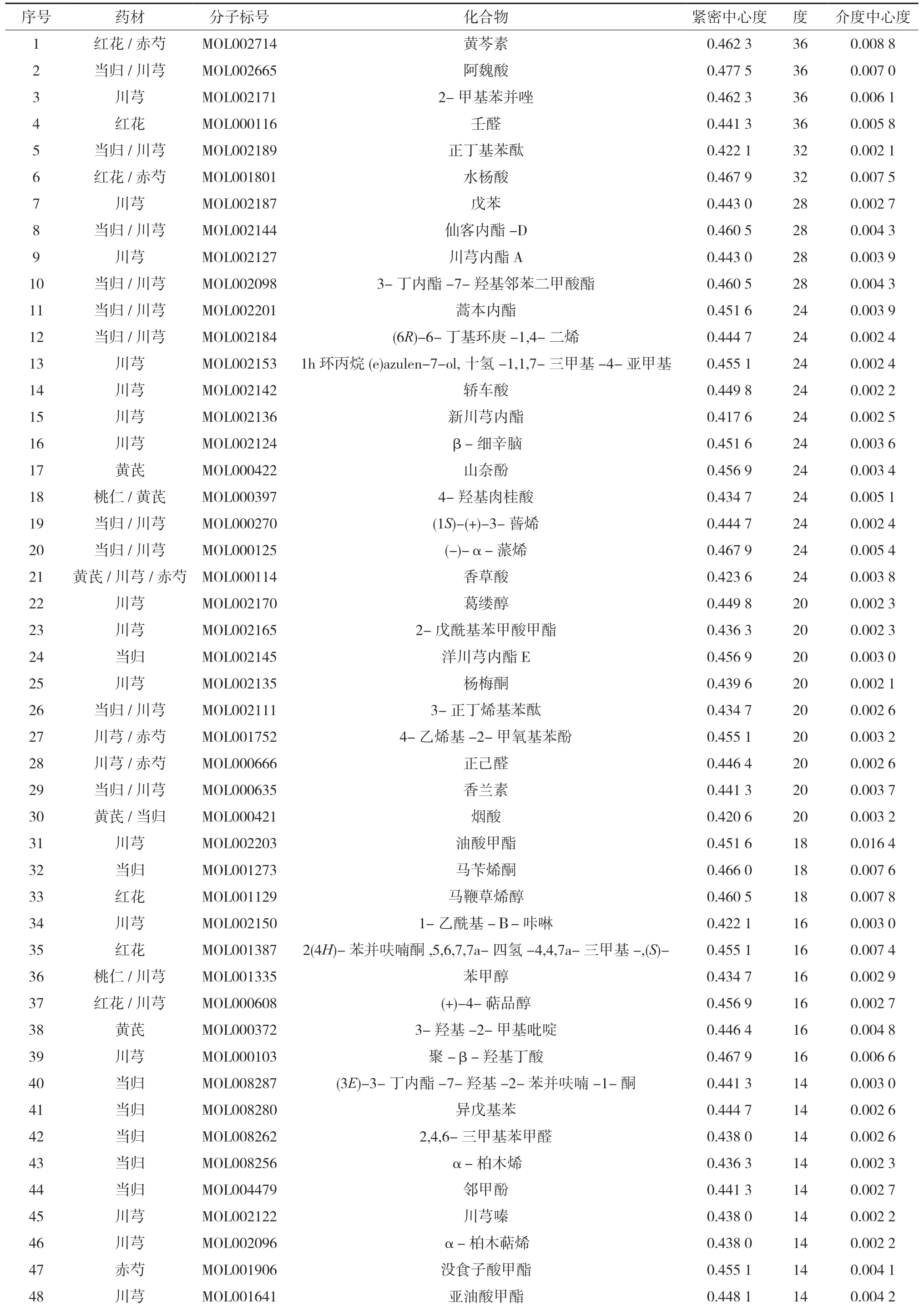
表2 补阳还五汤抗动脉粥样硬化的关键活性成分的网络分析结果
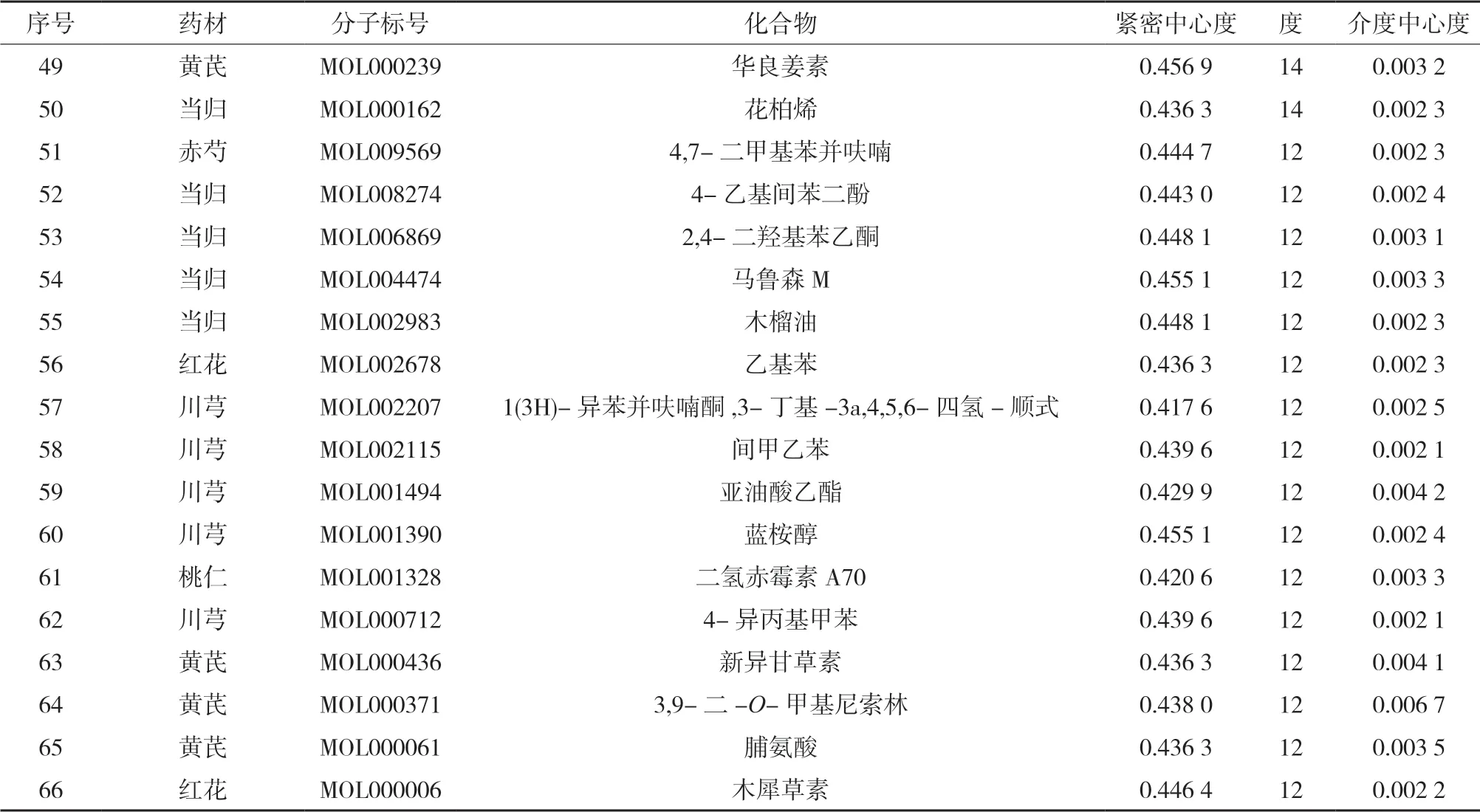
(续表)
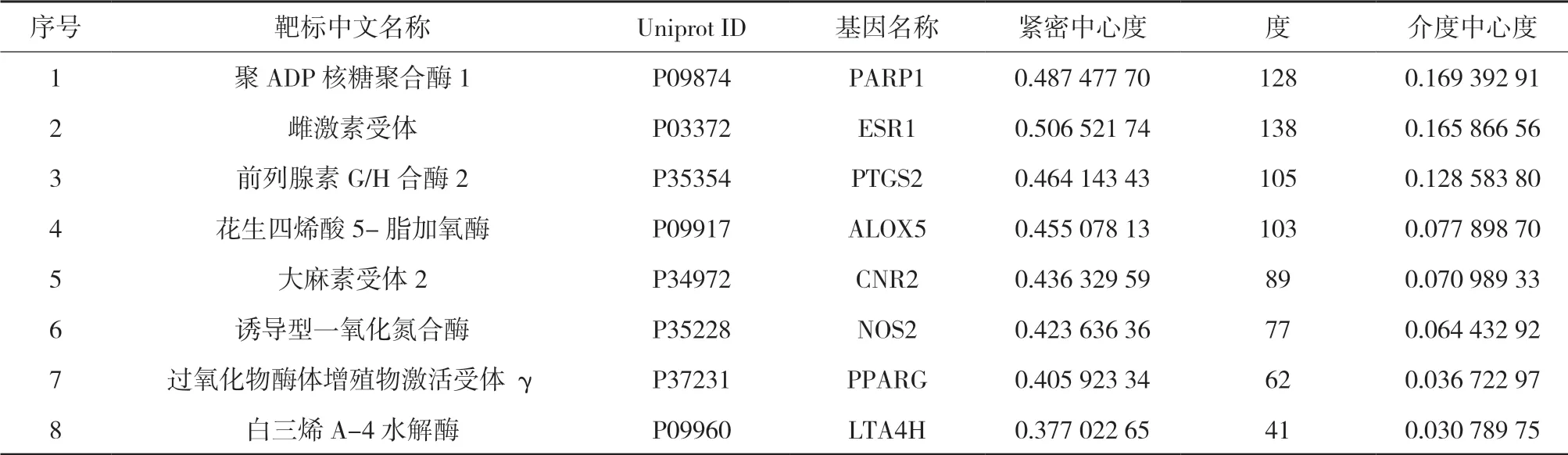
表3 补阳还五汤抗动脉粥样硬化的关键靶标信息及网络分析结果
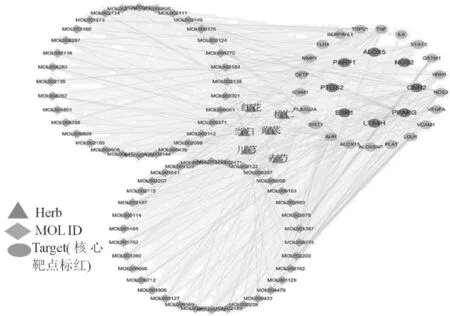
图1 补阳还五汤抗动脉粥样硬化的“药材-关键活性成分-靶点”网络关系图
3.4 GO富集分析和KEGG通路富集分析 为研究补阳还五汤抗动脉粥样硬化的具体作用机制,利用DAVID数据库对“3.2”项结果中的30个活性靶点进行了GO分析和KEGG分析,结果如图2和表4-5所示。

表4 GO分析结果及各项目关联的基因
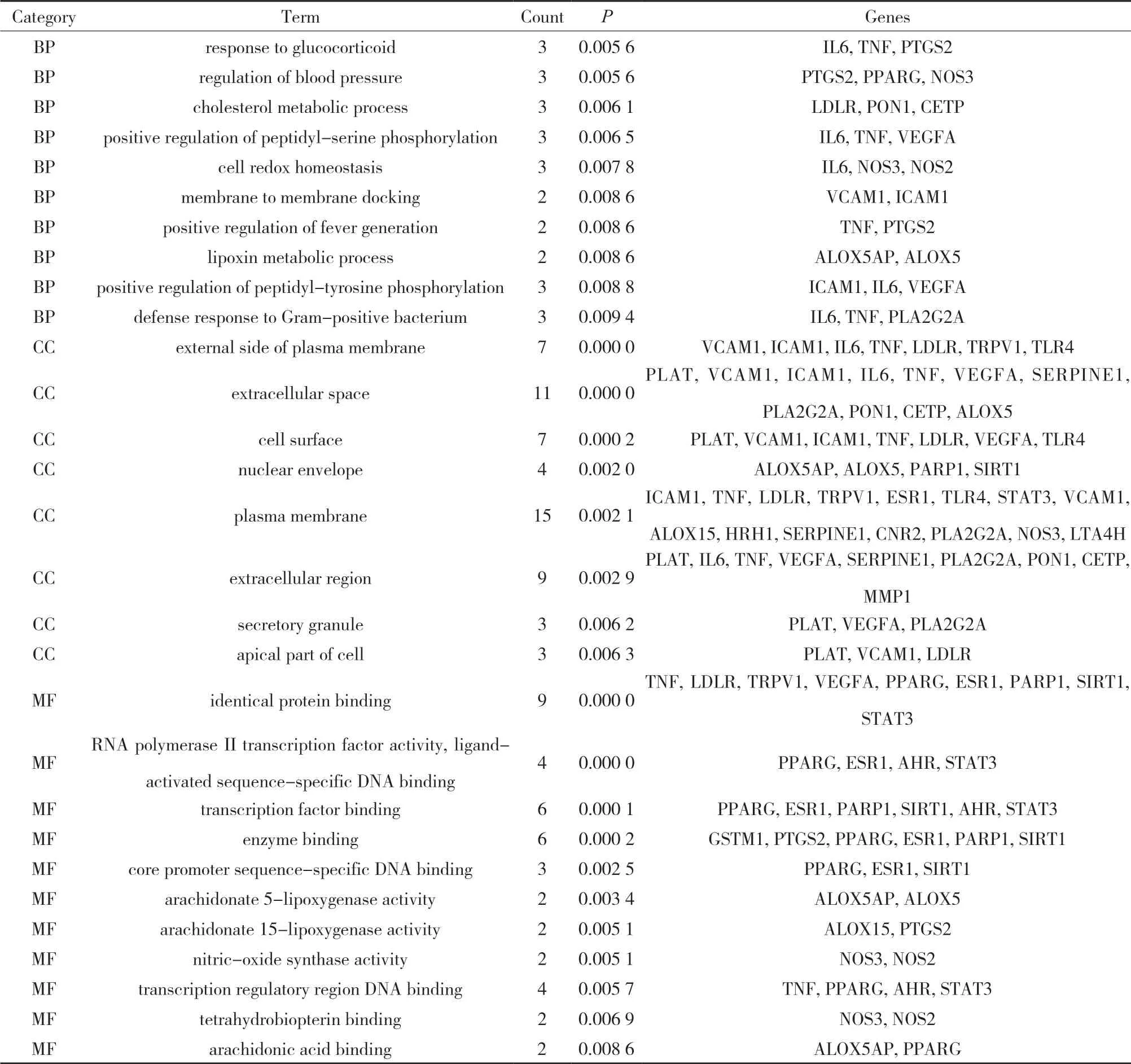
(续表)
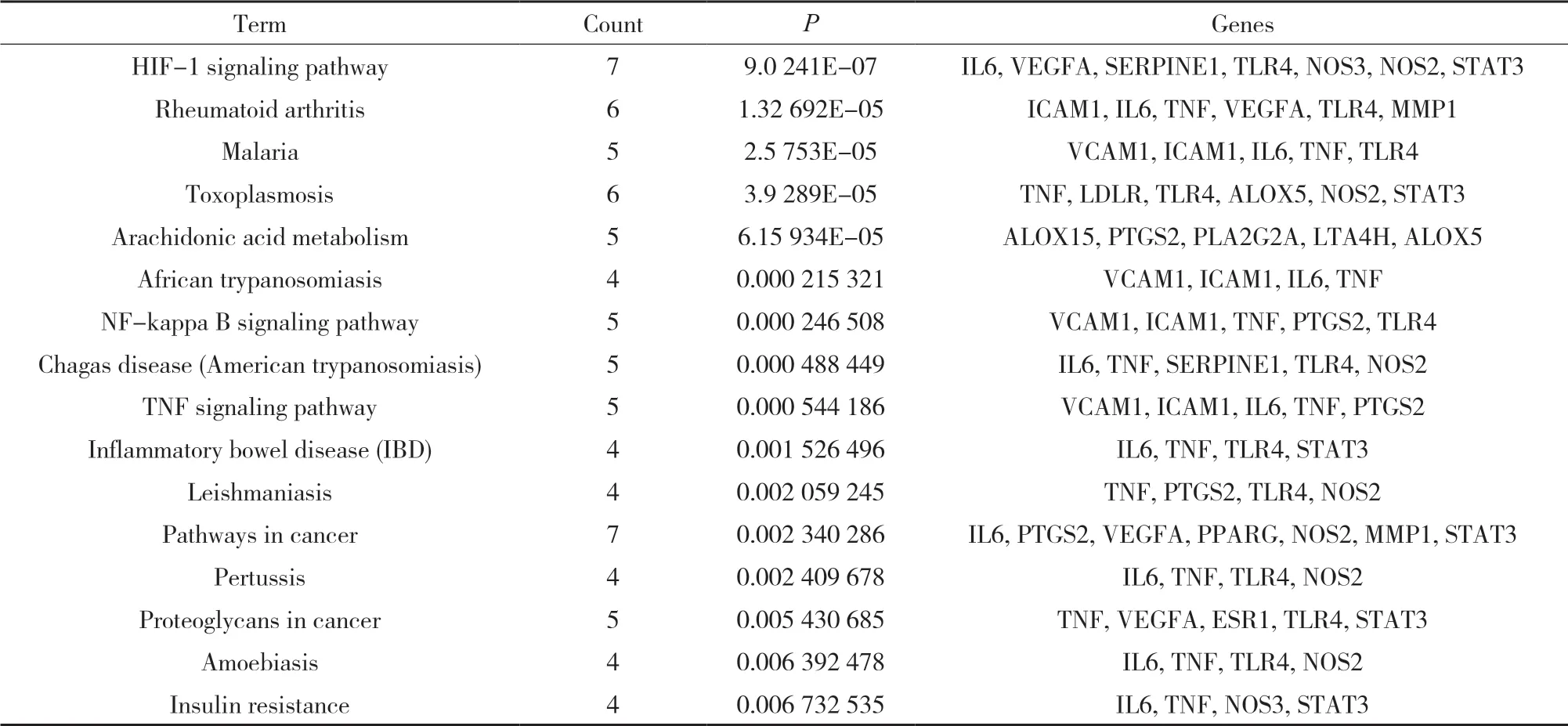
表5 KEGG通路分析结果及各项目关联的基因
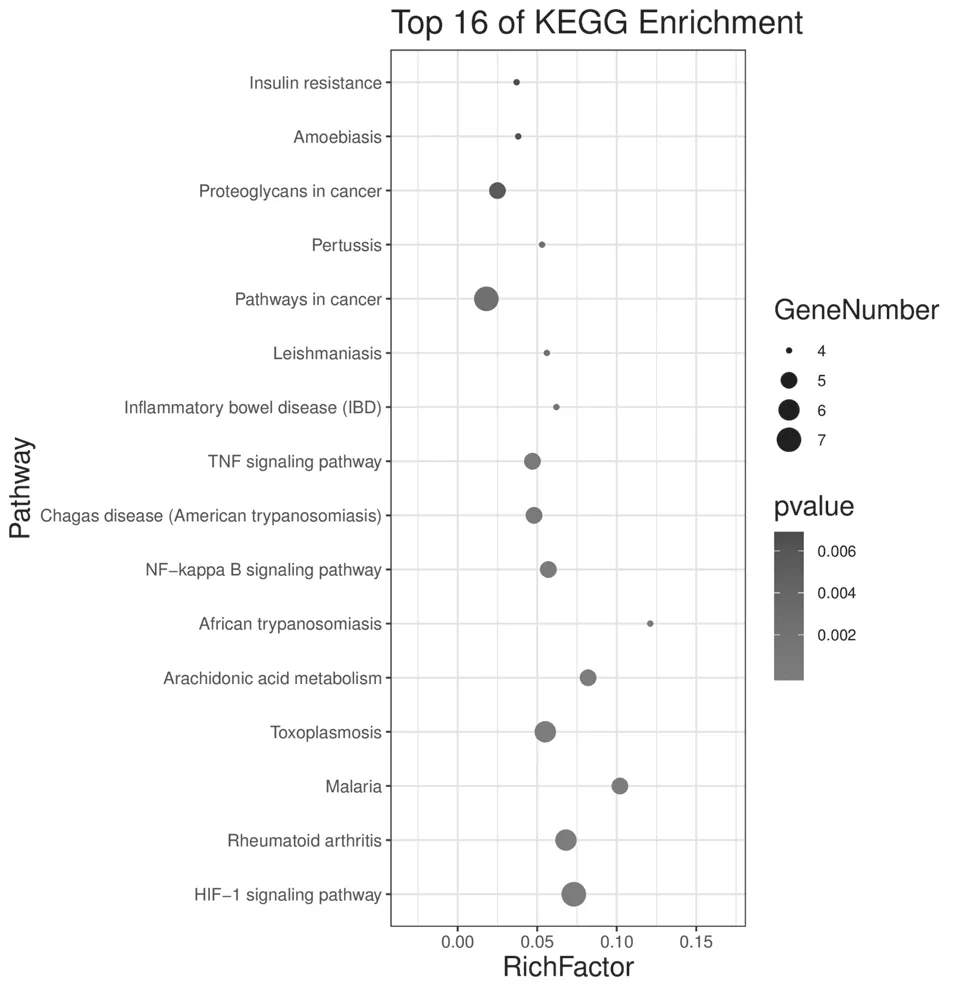
图2 KEGG分析富集结果高级气泡图
4 讨论
本研究通过分析补阳还五汤活性成分靶点与动脉粥样硬化疾病相关靶点进行映射,发现补阳还五汤中的单个活性成分可以作用于多个靶点,多个活性成分也可以作用于同一靶点,这符合中药治疗的系统性特点。对补阳还五汤药材中30个的活性靶点进行通路分析和黄芩素、阿魏酸等为代表的多个成分的GO富集分析,补阳还五汤活性成分可能作用于动脉粥样硬化疾病靶点影响多个生物过程,如影响一氧化氮生物合成过程的正调控、ERK1和ERK2级联的正调控、脂氧合酶途径、细胞对脂多糖的反应、白三烯代谢过程、RNA聚合酶II启动子转录的正调控、细胞对肿瘤坏死因子的反应都与已报道的AS发病机制一致,因此,该富集结果是可信的。
KEGG富集结果显示,活性靶点涉及16条代谢通路,其中HIF-1信号通路、TNF信号通路、NF-κB信号通路、花生四烯酸代谢等4条代谢通路与动脉粥样硬化及其相关疾病有关。将结果用Omicshare高级气泡图进行可视化处理,Rich factor指差异表达基因中位于该pathway条目的基因数目与所有注释基因中位于该pathway条目的基因总数的比值,Rich factor越大,表示富集的程度越大。P value的取值范围为0~1,且越接近于0,表示富集越显著。在图中,点的大小表示富集的基因数目多少,点越大表示富集的基因数目越多;点越接近红色表示P value越小。结果显示,缺氧诱导因子-1(hypoxia inducible factor-1,HIF-1)的富集程度最高,富集最为显著,该通路可能是补阳还五汤抗动脉粥样硬化的关键通路。已有研究表明本研究富集的4条信号通路均与动脉粥样硬化的发生发展具有紧密联系。如:HIF是由缺氧诱导因子-1α(hypoxia inducible factor-1α,HIF-1α)和缺氧诱导 因 子-1β(hypoxia inducible factor-1β,HIF-1β)组成的异源二聚体,HIF-1β在体内可正常表达,而HIF-1α在氧含量正常的细胞中并不表达,低氧情况下才被诱导表达,促进血管内皮生长因子(vascular endothelial growth factor,VEGF)的转录和表达上调,刺激血管内皮细胞活化、增殖,形成新的血管,促进AS斑块内炎性反应浸润和平滑肌细胞增殖、迁移,亦能够促进巨噬细胞的泡沫化[16]。肿 瘤 坏 死 因 子-α(tumor necrosis factor-α,TNF-α)信号通路是重要的炎症信号通路之一,调控炎性细胞释放炎症性介质、细胞因子、趋化因子[17],可加速AS进程。核因子κB(nuclearfactor kappa B,NF-κB)信号通路激活后可调控其下游靶基因如促炎细胞因子(IL-1,TNF-α等)、粘附因子、趋化因子、生长因子等的表达,参与炎症反应[18];参与调控5-脂氧化激酶、12-脂氧化激酶、磷酸激酶A2、环氧化酶2等促进LDL氧化修饰和炎性介质产生;同时能够激活下游HIF-1α基因的转录与表达[19],可见NF-κB信号通路可通过多环节干预动脉粥样硬化进程。花生四烯酸代谢通路主要包括环氧化酶(cyclooxygenase,COX)、脂氧合酶(lipoxygenase,LOX)、细胞色素P450酶(cytochrome P450,CYP)三条代谢途径,花生四烯酸在COX代谢途径中其代谢物TXA2/PGI2水平若失衡,会导致多种炎症因子释放,损伤血管壁、诱发血小板聚集,启动AS的形成[20];在其5-LOX途径中花生四烯酸被代谢为白三烯,尤其是LTB4,可增强细胞间黏附分子-1(ICAM-1)和血管内皮细胞黏附分子-1与单核/巨噬细胞膜的亲和力,促使单核细胞更易黏附于血管内皮,其次可强烈诱导单核细胞趋化蛋白-1的表达,使其趋化效应放大,同时能够上调单核/巨噬细胞膜表面氧化低密度脂蛋白受体CD36的表达,促进单核/巨噬细胞转化为泡沫细胞,促进脂质堆积,参与了AS斑块的形成,增加了AS斑块的不稳定性[21];近来也有较多研究发现在花生四烯酸CYP代谢途径中产生的20-HETE可以激活NF-κB通路,上调ICAM-1、白介素-8和氧化应激水平,促进血管内皮的炎症反应,同时还可促进血管内皮细胞增殖、血管新生,促进AS生成[22]。
近年也有研究表明黄芩素对动脉粥样硬化中的炎症因子有着良好调节作用,通过上调G蛋白信号通路调节蛋白5(Regulator of G protein signaling 5,RGS5)信号通路,经过信号转导,抑制PPARδ和NF-κB表达,在一定程度上减少了MCP-1的产生,从而阻断MCP-1/CCR2表达,减少炎症因子的表达,对血管内皮细胞起到了保护作用,延缓了AS的进程[23]。阿魏酸可通过抑制Ox-LDL对NF-κB的活化而抑制炎症因子的表达,从而起到对内皮细胞的保护作用,延缓AS发展[24]。综合已有研究成果可以部分地验证本研究对补阳还五汤抗动脉粥样硬化药效物质与作用机制预测结果的正确性。充分体现了中药复方多成分、多靶标、多通路的作用特点,为补阳还五汤抗动脉粥样硬化的药效物质及潜在作用机制研究提供了一种新的研究思路。
