抗菌肽的绿色制备及在粮食贮藏方面的应用研究
2021-11-10赵云淼何静张丽君吴倩倩张进孙静
赵云淼 何静 张丽君 吴倩倩 张进 孙静


摘要:本研究旨在对解淀粉芽孢杆菌fmbj所产抗菌肽的提取条件进行优化,通过米糠提取抗菌肽以提高发酵液中抗菌肽的效价。通过单因素试验对发酵条件如米糠添加比例、吸附时间、温度、pH进行了优化,优化后的提取工艺为米糠添加比例100 g/L、吸附时间30 min、温度为65℃、pH为4,期望将抗菌肽产品应用于粮食贮藏,提高粮食保鲜率。
关键词:抗菌肽;制备;粮食贮藏
抗菌肽是一类具有抑菌活性的多肽类物质。它具有抑菌谱广、稳定性好以及安全性高等特点[1]。截止目前,抗菌肽数据库收录种类高达3180种。其中,动物来源占74.09%;植物来源占11.07%;微生物来源占12.20%。与动物源抗菌肽相比,微生物源抗菌肽具有发酵周期短、成本低、可大规模生产的优点,因此,其具有良好的工业化生产前景[2]。
米糠为稻谷和粟米等的加工副产物,主要由种皮、外胚乳、糊粉层和胚组成。我国米糠资源产量巨大,居世界之首。米糠富含油脂、蛋白质、矿物质、维生素等多种营养素和生育酚、脂多糖、谷维素、二十八烷醇、α-硫酸锌、角鲨烯、神经酰胺等多种天然抗氧化及生理活性物质[3]。然而,我国的米糠主要用于动物饲料,仅有少量用于食用产品制备,资源利用率相比美国、日本等国家偏低。因此,米糠作为一种廉价但是营养丰富的稻谷加工副产物就具有广阔的利用前景[4]。
本研究优化了用米糠提取抗菌肽的条件,并对不同处理进行多重比较,以探究米糠绿色制备抗菌肽的最佳工艺,提高资源的利用率,并将抗菌肽产品用于粮食的贮藏,提高粮食保鲜率,使粮食贮藏更加安全环保。
1 材料与方法
1.1 材料
1.1.1 生产菌株
解淀粉芽孢杆菌fmbj(CGMCC 0943),保藏于南京农业大学食品科学技术学院酶工程实验室。
1.1.2 培养基
LB培养基:胰蛋白10 g、酵母提取物5 g、氯化钠10 g,采用蒸馏水定容至1000 mL,调节pH至7.0,121℃灭菌20 min,备用。
发酵培养基:葡萄糖20 g、L-谷氨酸5 g、酵母浸膏1 g、磷酸二氫钾0.5 g、硫酸镁0.5 g、氯化钾0.5 g、硫酸铜0.15 mg、硫酸铁1.2 mg、硫酸锰5 mg,采用蒸馏水定容至1000 mL,调pH至7.0,121℃灭菌20 min,备用。
种子培养基:牛肉浸膏3 g、胰蛋白胨10 g、氯化钠5 g,采用蒸馏水定容至1000 mL,调pH至7.0,121℃灭菌20 min,备用。
1.1.3 试剂
胰蛋白胨(上海必优生物科技有限公司)、酵母提取物(上海麦克林生化科技有限公司)、葡萄糖(国药集团化学试剂有限公司)、L-谷氨酸(上海阿拉丁生化科技股份有限公司)、牛肉浸膏(国药集团化学试剂有限公司)、甲醇(上海泰坦科技股份有限公司)等。
1.1.4 主要实验仪器
高压蒸汽灭菌锅(冰山松洋生物科技有限公司)、pH计(奥豪斯仪器有限公司)、低温冷冻离心机(上海耐圣卡兰实业有限公司)、高效液相色谱仪(安捷伦科技有限公司)、电热恒温水浴锅(国华仪器制造有限公司)、振荡培养箱(南京赛百傲生物科技有限公司)、电热恒温培养箱(南京赛百傲生物科技有限公司)等。
1.2 方法
1.2.1 解淀粉芽孢杆菌fmbj的培养
将解淀粉芽孢杆菌fmbj在LB平板上进行划线,放入37℃培养箱中培养12 h。挑取活化好的单菌落,接入到种子培养基中,37℃、180 rpm摇床振荡培养24 h。将种子液接种到发酵培养基中,接种量为5%,置于33℃、180 rpm振荡培养72 h,发酵后的菌液8000 rpm离心20 min得发酵液上清。
1.2.2 抗菌肽的提取与检测
准确量取20 mL发酵液上清,用1 mol/L HCl溶液将pH调至2.0,置于4℃冰箱中过夜;将过夜后的发酵液在8000 rpm、4℃条件下离心20 min,弃上清取沉淀;取1 mL的甲醇溶解沉淀物进行萃取,4℃静置过夜,10000 rpm、4℃离心2 min,弃沉淀,获得抗菌肽粗提物,然后采用0.22 μm的有机滤膜过滤后置于安培瓶中,置于4℃待测。采用高效液相色谱测定[5],色谱柱为C18柱(Eclipse XDB,5μm 4.6×250 mm,安捷伦科技有限公司);进样量为20 μL,柱温40℃,检测波长225 nm。其中流动相A为含0.1%三氟乙酸的水,流动相B为含0.1%三氟乙酸的乙腈,具体的检测条件参照Qian等的进行[6]。
1.2.3 单因素试验提取条件
米糠添加比例的确定:按照初始提取条件pH 7.0、吸附温度45℃、吸附时间90 min,在此基础上考察不同添加比例(20 g/L、40 g/L、60 g/L、80 g/L、100 g/L、120g/L和140g/L)对抗菌肽提取率的影响。
吸附时间的确定:按照初始提取条件pH 7.0、吸附温度45℃、添加比例60 g/L,在此基础上考察不同提取时间(30 min、60 min、90 min、120 min和150 min)对抗菌肽提取率的影响。
吸附温度的确定:按照初始提取条件pH 7.0、吸附时间90 min、添加比例60 g/L,在此基础上考察不同吸附温度(25℃、35℃、45℃、55℃、65℃和75℃)对抗菌肽提取率的影响。
pH的确定:按照初始提取条件温度45℃、吸附时间90 min、添加比例60 g/L,在此基础上考察不同pH(4.0、5.0、6.0、7.0、8.0和9.0)对抗菌肽提取率的影响。
初始提取条件为:pH 7.0、吸附温度45℃、吸附时间90 min、米糠添加比例60 g/L。
除单因素为变量外,其余提取条件不变,每个实验重复3次。
2 结果与分析
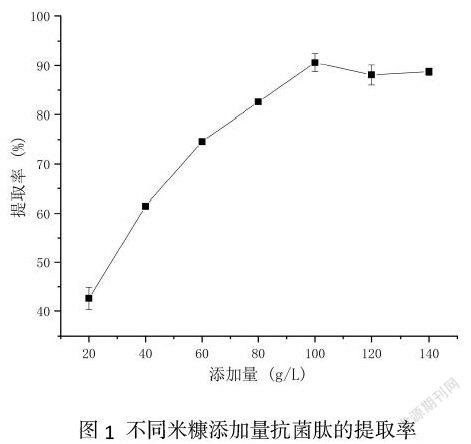
2.1 米糠添加比例对抗菌肽提取率的影响
由图1可知,在发酵液上清中添加不同比例的米糠对抗菌肽提取率有显著的影响。当米糠的添加量在20 g/L-100 g/L的范围内,发酵液上清中抗菌肽提取率随着米糠添加量的增加而提高;其中以米糠的添加量在20 g/L-60 g/L时,发酵液上清中抗菌肽提取率增幅最大;米糠的添加量在100 g/L-140 g/L时,抗菌肽的提取率未出现显著变化。由此可确定米糠添加比例为100 g/L时抗菌肽的提取率最高。
2.2 吸附时间对抗菌肽提取率的影响
由图2可知,米糠在发酵上清液中吸附时间的不同对抗菌肽的提取率影响显著。当吸附时间在30 min - 60 min的范围内,发酵液上清中抗菌肽提取率随着吸附时间的增加而降低;当吸附时间在60 min - 120 min的范围内,发酵液上清中抗菌肽提取率随着吸附时间的增加而提高;其中以吸附时间在60 min - 90 min时,发酵液上清中抗菌肽提取率增幅最大;以吸附时间在90 min - 120 min时,发酵液上清中抗菌肽提取率增幅缓慢;当吸附时间在120 min - 150 min的范围内,发酵液上清中抗菌肽提取率随着时间的增加而降低。可以看出当吸附时间为30 min和120 min时,抗菌肽提取率都接近70 %,在减少资源消耗的情况下,可以确定吸附时间30 min为最优提取条件。
2.3 吸附温度对抗菌肽提取率的影响
由图3可知,在发酵液上清中吸附温度的不同对米糠提取抗菌肽有着显著影响。当吸附温度在25℃ - 45℃ 的范围内,发酵液上清中抗菌肽提取率变化不显著;当吸附温度在45℃ - 65℃的范围内,米糠提取发酵液上清中抗菌肽随着吸附温度的增加而提高;其中以吸附温度在45℃ - 55℃ 时,抗菌肽的提取率增幅最大;当吸附温度在65℃ - 75℃ 的范围内,米糠对抗菌肽的提取率随着温度的增加而降低。由此可确定吸附温度为65℃ 时抗菌肽的提取率最高。
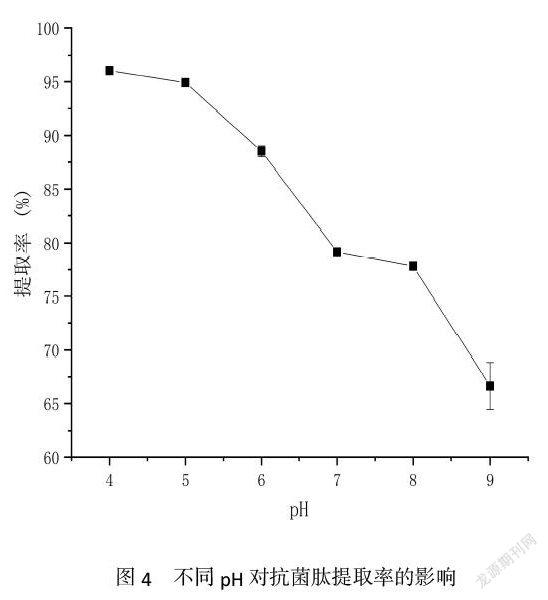
2.4 pH对抗菌肽提取率的影响
由图4可知,pH的不同显著影响米糠对抗菌肽的提取率。随着pH的升高,发酵液上清中抗菌肽的提取率大体呈下降趋势,当pH在4-7的范围内及在8-9的范围内,发酵液上清中抗菌肽提取率下降趋势明显;当pH在7-8范围内,发酵液上清中抗菌肽提取率无显著变化。可以看出pH值越小越有利于抗菌肽的提取,而在pH=4时提取率已高达96%,则可选取pH=4为最佳提取条件。
3 结语
根据米糠提取解淀粉芽孢杆菌fmbj(CGMCC 0943)所产抗菌肽的提取条件进行的单因素实验表明,添加比例100 g/L、吸附时间30 min、提取温度65℃、pH=4时提取率最高。本文只通过单因素实验对提取条件进行了优化,后期仍需在此基础上进行PB实验,以筛选出影响提取率的主要因素,通过响应面实验确定最优提取条件。在最优条件下进行抗菌肽的提取,以低成本、高效率的方式得到绿色环保的抗菌肽产品,可作为添加剂应用在粮食储藏中,通过抗菌肽对霉菌的抑制作用,延长粮食的保存期。
参考文献:
[1] 王志新, 鲁雷震, 周景波, 封成玲, 贾紫伟, 宁亚维, 贾英民. 抗真菌肽研究进展[J]. 生物技术通报, 2021, 37(03): 206-218.
[2] 王永強. 解淀粉芽孢杆菌SDTB009的分离鉴定及其对番茄枯萎病的防治研究[D]. 山东农业大学, 2020.
[3] 赵菁. 稻米油加工安全性评价[D]. 武汉轻工大学, 2018.
[4] 鄢宏浩, 蔡乔宇, 陈轩, 沈汪洋, 黄文晶. 米糠多糖的提取纯化及生理功能活性研究进展[J]. 食品科技, 2020, 45(10): 197-201.
[5] 吴希, 邓勤, 徐志勇, 岑举人, 徐静. 制备型高效液相色谱在天然产物分离中的应用[J]. 化学分析计量, 2017, 26(01): 113-117,122.
[6] Qian S, Lu H, Meng P, Zhang C, Lv F, Bie X, Lu Z. Effect of inulin on efficient production and regulatory biosynthesis of bacillomycin D in Bacillus subtilis fmbJ[J]. Bioresource Technology, 2015, 179: 260-267.
