乙酸乙酯制备演示实验的改进
2015-05-15朱志荣
朱志荣
摘要:就中学化学教材中乙酸乙酯制备演示实验的装置、反应物用量、催化剂选择、操作方法等相关问题,结合自身教学实践,阐述了作者的观点和改进措施,力求乙酸乙酯制备演示实验的经济环保、安全高效、可观察性和可操作性。
关键词:乙酸乙酯;制备;演示实验;实验改进
文章编号:1005–6629(2015)2–0059–04 中图分类号:G633.8 文献标识码:B
乙酸乙酯的制备方法比较多[1],适用于中学化学课堂演示的一般是用乙酸和乙醇的酯化反应来制备乙酸乙酯。关于该反应所用催化剂以及加热方法,不同的资料或教科书均有不同的方式方法。目前鲁教版[2]、苏教版[3]、人教版[4]高中化学必修2均采取浓硫酸作催化剂、酒精灯加热法;上科版[5]采用水浴加热法,并且针对该法还有文章作出了改进[6]。通过教学实践,这些方法仍存在一些值得商榷的地方。笔者就上科版、苏教版等教材关于乙酸乙酯制备课堂演示实验结合自己教学实践谈一些看法。
1 催化剂的选择
酯化反应原理是:
质子(H+)是反应中的催化剂,就一般中学实验室条件而言,浓硫酸是最常用易得的催化剂,事实上大多数教材也都首选浓硫酸作催化剂。浓硫酸既是催化剂也是反应中的吸水剂,加快速率也能使酯化反应正向移动,利于酯的生成,但使用浓硫酸作催化剂的缺点一直为人诟病:容易出现反应物碳化现象,生成乙醚、二氧化硫等,副反应较多、影响观察。实践证明减少浓硫酸用量能有效减少副反应,对酯的生成影响也不大。选用固体酸、杂多酸、无水四氯化锡(路易斯酸)做催化剂虽然效果不错,但受成本和药品来源等因素影响,事实上并不易成行。稀硫酸(8 mol/L)或其他无机酸也可以作为催化剂,催化效果也不错。
2 加热方式的对比
如果侧重于考虑酯的产率和质量,先回流后蒸馏法无疑是首选,酯的产率高、纯度好但操作较繁琐。为减少反应步骤节省课堂授课时间,目前符合课堂演示“短平快”特点的较普遍的制备方法是连续操作的酯化蒸馏法,即酯的生成和酯的蒸馏在同一装置中不间断进行,但这存在着在反应温度较高情况下酯化反应未达到平衡反应物就被蒸出反应器影响酯的产率问题,如酒精灯加热法(如图1)。选择水浴加热法(如图2),虽易于控制温度且给热均匀,能够大大减少酸、醇的蒸发,但受到水浴温度低(最高100℃)、给热环境开放、玻璃材质不易导热、蒸气流过线路长(用于反应器的大试管一般20cm)等限制,反应液实际受热温度难以达到酯化反应温度的要求,反应慢,时间长,特别是成酯后不容易被蒸出,实际出酯较少,反应现象大打折扣。实验证明,在近100℃水浴中,反应液不易沸腾,加热较长时间后,反应器壁上才有油状物回流,很少有馏出液,在接收试管中收集到的酯微乎其微,因此敞开环境下的水浴加热法不十分理想。李嘉改进后的套管水浴加热法效果不错,值得推广[7]。油浴加热法也见诸一些文章,油浴法温度高、加热均匀但缺少可操作性和安全性,作为课堂演示实验一般也不宜采用。而酒精灯加热法虽然给热不很均匀,但操作方便,可保证反应和蒸馏的温度要求,耗时少、出酯快。利用温度计控制酒精灯加热时间,在加热的试管下方垫石棉网(热容大),采用空气浴、间歇式加热等方式可避免温度过高、受热不均匀等缺陷。同时,调整反应装置,将导气管竖直方向设计长一点,也可有效减少酸和醇的挥发。这种加热法实用性强,实际使用效果利大于弊(如图3)。
3 用料量的确定
乙酸和乙醇理论用量为1:1(物质的量之比),考虑酯化反应为可逆反应,增大一种反应物浓度可提高酯的产率。研究资料表明[8],等物质的量酸和醇反应酯的产率最低,酸或醇过量均可提高酯的产率,但醇过量的产率优于酸过量的产率,当乙醇对乙酸过量1.5倍时产率最高(如表1),所以选n(乙醇):n(乙酸)=3:2,由无水乙醇57.20 mL/mol,冰醋酸62.13 mL/mol,可得V(乙醇): V(乙酸)=1.38:1,鉴于演示实验常用试管规格、考虑取用方便以及应取得明显的现象等要求,确定3mL乙醇和2mL冰醋酸为宜。这也是大多数教材演示实验所确定的用料量。
4 几组实验数据的比较
每组用料:3mL无水乙醇+2mL冰醋酸+5mL饱和碳酸钠溶液(加几滴酚酞)
装置如图3:反应器试管规格2cm×20cm,接收酯试管规格1.4cm×15cm,除第8组外,每组停止收集馏出液以控制90℃左右时馏出液不再明显滴入为准,以减少对比误差。
5 实验条件的综合考量
5.1 温度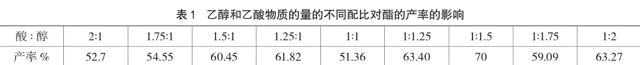
与先回流后蒸馏法不同,采用连续操作的酯化蒸馏法演示酯的生成既要考虑加快速率,又要尽可能减少反应液的挥发确保一定量酯的生成,决定了反应温度不宜太高或太低。温度太低则反应慢,成酯等待时间长,酯难以被蒸出;温度太高,副反应多,原料蒸发严重,酯的产率反而大大降低。实践证明,在演示实验现有条件下(药品用量、反应器试管长度等)进行酯化反应的温度大约在70~80℃之间为宜,这个温度是减少乙醇(沸点是78.4℃)挥发的最高温度区间。从1、4、5、7四组实验来看,情况基本类似:反应液受热不到1分钟,温度迅速上升,70℃左右微沸,80℃左右剧烈沸腾,83℃左右温度上升较慢(酯被蒸出),由于反应液与蒸气出口有段空间距离且部分馏出液被冷凝回流,到85℃左右才有大量馏出液。控制反应液温度停留在85~90℃足够长时间(实际上此时蒸气出口温度在80℃左右)。待酯蒸出后,馏出液会骤然减少,这是停止收集馏出液的时刻,如果让温度继续攀升越过85~90℃温度区间延长收集馏出液时间则会影响酯的产率和纯度,第8组实验数据证实这点。准确控制温度是本次试验的关键,这是在装置中加入一支温度计的原因,使用温度计控制温度也使实验更安全。由于100℃水浴作为热源不能保证馏出液的蒸出,酒精灯加热法便成为一种可靠的热源,但加热过程中要处理好反应快慢和化学平衡间的关系。在低温段(70~80℃)控制温度停留时间尽可能长一点,以保证酯化反应的平衡状态的形成,提高酯的产率;在控制高温段(85~90℃)足够长时间(保证酯的浓度减少)后,一旦发现馏出液明显减少即可停止反应。所有温控要求都是通过温度计调节酒精灯焰大小以及间歇式加热操作方式来实现。
5.2 催化剂
“3mL无水乙醇+2mL冰醋酸+2mL浓硫酸”这种配比物料的催化剂用量确实值得商榷[9~11],从实验结果看,2mL浓硫酸给酯的制备带来较多的副反应,既造成环境污染也造成原料浪费。而减少浓硫酸的用量(0.2mL浓硫酸)、降低浓度(8 mol/L 2mL硫酸)来作催化剂并不显著减少酯的产率,且经济环保、简约安全,应该得到推广和应用。第5组实验是为了验证无水硫酸钠在反应中能否显示吸水作用,从第4、5、6组实验对比结果看,其吸水性并不明显。而值得注意的是,从第1、7组数据结果来看,相对于8 mol/L硫酸,等体积的浓硫酸的吸水作用并不明显,其中原因有待于继续研究。
5.3 其他改进
在接收酯的装置中,如果导管口置于饱和碳酸钠溶液液面上,馏出物蒸气难免逸散到空气中,造成产品损失和空气污染;直接插入吸收液中又容易引起倒吸。如果导管上接入一个干燥管浸在吸收液中,可以起到冷凝馏出物使蒸气完全吸收和防止倒吸问题。
6 演示实验的改进措施
实验改进装置如图3。
乙酸乙酯制备演示实验是为了演示酯的生成原理和过程,在一般情况下,能有目的地引导学生观察实验中酯的生成状态,认识酸、醇、酯的性质,培养学生实事求是的科学态度、安全环保意识和绿色化学思想。笔者提出的改进措施使乙酸乙酯课堂演示制备实验具有较好的实用性、可操作性和科学性,更符合课堂教学的要求。
参考文献:
[1]丁爱军,王金龙.制备乙酸乙酯的新研究和反思[J].化学教育,2010,(5):13.
[2][9]王磊主编.普通高中课程标准实验教科书·化学2(必修)[M].济南:山东科学技术出版社,2007:80.
[3][10]王祖浩主编.普通高中课程标准实验教科书·化学2(必修)[M].南京:江苏教育出版社,2007:71.
[4][11]宋心琦主编.普通高中课程标准实验教科书·化学2(必修)[M].北京:人民教育出版社,2004:69.
[5]姚子鹏主编.化学(高中二年级第二学期)[M].上海:上海科学技术出版社,2004:13.
[6][7]李嘉.制备乙酸乙酯演示实验的改进[J].实验教学与仪器,2013,(1):27.
[8]刁开盛等.实验室制备乙酸乙酯的改进[J].广西民族学院学报(自然科学版),2006,12(1):55~58.
