脑泰方调控细胞铁转运抑制铁死亡保护脑卒中缺血损伤的机制研究
2021-11-08饶政清梅志刚葛金文米招娣王国佐
饶政清,梅志刚,葛金文,杨 梅,米招娣,兰 斌,杨 彤,王国佐
脑泰方调控细胞铁转运抑制铁死亡保护脑卒中缺血损伤的机制研究
饶政清,梅志刚,葛金文,杨 梅,米招娣,兰 斌,杨 彤,王国佐*
湖南中医药大学中西医结合学院,湖南 长沙 410208
探讨脑泰方是否通过调控热休克转录因子1(heat shock factor 1,HSF1)/热休克蛋白B1(heat shock proteins B1,HSPB1)通路降低脑铁沉积、抑制活性氧沉积及脂质过氧化产物产生、减轻神经元铁死亡,从而发挥脑卒中缺血损伤保护作用。SD大鼠随机分为假手术组、模型组、脑泰方(27 g/kg)组和去铁酮(125 mg/kg)组,给予药物干预。通过大脑中动脉闭塞(middle cerebral artery occlusion,MCAO)法制备脑缺血大鼠模型,术后2 h进行神经功能评分及取材。TTC染色法检测脑梗死体积;苏木素-伊红(HE)染色观察脑组织形态结构及损伤情况;尼氏染色观察脑组织尼氏体数目;普鲁士蓝染色观察脑组织神经元内铁聚集水平;免疫组化及Western blotting法检测脑组织HSF1、HSPB1、转铁蛋白受体1(transferrin receptor 1,TFR1)和铁蛋白重链多肽(ferritin heavy polypeptide1,FTH1)蛋白表达;铁离子检测试剂盒与丙二醛检测试剂盒及活性氧检测试剂盒检测脑组织铁、丙二醛及活性氧含量。与模型组比较,脑泰方组大鼠脑梗死体积减少,神经功能评分降低(<0.01);脑缺血区尼氏体增多,细胞损伤程度降低;含铁聚集颗粒细胞的数目减少;脑铁、丙二醛及活性氧含量降低(<0.05、0.01);脑组织HSF1、HSPB1及FTH1蛋白表达上调(<0.05、0.01),TFR1蛋白表达下调(<0.05)。脑泰方可能通过上调HSF1/HSPB1通路,抑制TFR1的表达以减少神经元铁的吸收,上调FTH1的表达以增加铁蛋白的铁存储,以此调控铁代谢稳态平衡,进而抑制因过量的铁通过芬顿反应产生的活性氧及随后脂质过氧化产物引起的缺血性脑卒中神经元铁死亡。
脑卒中;铁死亡;HSF1/HSPB1通路;细胞铁转运;脑泰方
脑卒中是目前世界上排名第2的致死性疾病,每年约有79.5万人新发或复发脑卒中,其中87%为缺血性脑卒中,具有高发病率、高致残率、高致死率、高复发率等特点[1]。铁是体内重要的微量元素,铁在体内的分布及含量异常会影响正常的生理过程,铁的生物毒性最重要的机制在于这种金属催化的芬顿反应中,过量的铁通过芬顿反应产生活性氧促进了脂质的过氧化作用从而导致铁死亡[2-3]。由于铁在脂质过氧化生物学过程中介导活性氧产生及酶活性发挥着重要作用,因此铁死亡受铁代谢生物学过程中铁的吸收、出口、利用、储存共同调节[4-5]。研究表明,铁代谢紊乱及铁死亡与缺血性脑卒中密切相关,铁代谢紊乱是缺血性脑卒中后神经元损伤的重要病理过程,而铁死亡是其病理结局之一[6-7]。脑泰方是本课题组研发的治疗缺血性脑卒中的有效中药方剂,具有较好的防治急性缺血性脑卒中的疗效[8],可通过调节神经元铁代谢及降低铁沉积水平达到保护神经元并促进神经功能康复的作用[9-10]。然而,目前脑泰方对神经元铁死亡的调控机制仍尚不明了。
热休克蛋白B1(heat shock proteins B1,HSPB1)是分布最广和研究最多的小热休克蛋白,其水平以热休克转录因子1(heat shock factor 1,HSF1)依赖性方式上调[11-12]。HSPB1能在大脑缺血及梗塞周围区域上调,其过度表达可减少梗塞面积,具有保护神经元的作用[13-14]。近来研究发现,HSF1/HSPB1通路调控的细胞铁转运与铁死亡密切相关,HSF1/HSPB1通路对铁死亡的负向调控作用为铁死亡的分子机制提供了新的见解[11]。本研究通过制备大鼠大脑中动脉闭塞(middle cerebral artery occlusion,MCAO)模型,以HSF1/HSPB1通路调控细胞铁转运抑制铁死亡为切入点,探讨脑泰方是否可通过调控HSF1/HSPB1通路以降低铁沉积、活性氧沉积及脂质过氧化产物的产生,从而抑制神经元铁死亡并发挥对MCAO大鼠神经元的保护作用。
1 材料
1.1 动物
SPF级雄性SD大鼠68只,8周龄,体质量220~240 g,购自湖南斯莱克景达实验动物有限公司,动物许可证号SCXK(湘)2019-0004,动物质量合格证号430727211100162143。动物饲养于湖南中医药大学实验动物中心,温度22~24 ℃,湿度50%~60%。本研究经湖南中医药大学实验动物中心伦理委员会审核通过(批准号LLBH-202006050001)。所有动物实验遵循湖南中医药大学有关实验动物管理和使用的规定。
1.2 药物
脑泰方由黄芪40 g、川芎10 g、地龙15 g、僵蚕15 g组成,黄芪(批号CK20092801)、川芎(批号TH20112403)、地龙(批号2020120403)、僵蚕(批号HH20081903)购自湖南中医药大学第一附属医院中药房,经湖南中医药大学第一附属医院中心实验室刘林副教授鉴定分别为豆科植物蒙古黄芪(Fisch.) Bge. var.(Bge.) Hsiao的干燥根、伞形科植物川芎Hort.的根茎、钜蚓科动物参环毛蚓(E. Perrier)的去内脏全体、蚕蛾科昆虫家蚕Linnaeus 4~5龄的幼虫感染(或人工接种)白僵蚕(Bals.) Vuilknt而致死的干燥体。
去铁酮片(deferiprone,DFP)是一种FDA批准的口服铁螯合剂,经口服能有效降低铁沉积的临床药物(加拿大奥贝泰克制药有限公司,注册证号H20140379)。
1.3 试剂
热休克转录因子1(heat shock factor 1,HSF1)多克隆抗体(批号bs-3757R)购自博奥森生物技术有限公司,用于Western blotting及免疫组化检测;转铁蛋白受体1(transferrin receptor 1,TFR1)多克隆抗体(批号BA0462)购自博士德生物工程有限公司,热休克蛋白B1(heat shock proteins B1,HSPB1)多克隆抗体(批号bs-0730R)及铁蛋白重链多肽1(ferritin heavypoly peptide1,FTH1)多克隆抗体(批号bs-5907R)购自博奥森生物技术有限公司,用于免疫组化检测;热休克蛋白B1单克隆抗体(批号M00676-5)、羊抗小鼠IgG(H+L)(批号BA1050)购自博士德生物工程有限公司,FTH1单克隆抗体(批号A19544)、TFR1多克隆抗体(批号A5865)购自爱博泰克生物科技有限公司,β-actin多克隆抗体(批号bs-0061R)购自博奥森生物技术有限公司,羊抗兔IgG(H+L)(批号SA00001-2)购自武汉三鹰生物技术有限公司,均用于Western blotting检测;尼氏染色液(批号C0117)及活性氧检测试剂盒(批号S0033)均购自碧云天生物技术有限公司;普鲁士蓝染色试剂盒(批号G1428)、伊红染色液(批号G1108)、Mayer苏木素染液(批号G1080)、组织铁含量检测试剂盒(批号BC4350)、丙二醛含量检测试剂盒(批号BC0025)、2% TTC染色液(批号G3005)均购自索莱宝科技有限公司;通用二步法检测试剂盒(批号PV9000)及DAB试剂盒(批号ZLI-9018)均购自中杉金桥生物技术有限公司。
1.4 仪器
凝胶成像分析仪、多功能酶标仪、光学显微镜(美国Bio-Rad公司);高速冷冻离心机及石蜡切片机(英国Dynamica公司);可见分光光度计(舜宇恒平科学仪器有限公司)。
2 方法
2.1 脑泰方提取物的制备
黄芪、川芎、地龙、僵蚕4味中药按4∶1∶1.5∶1.5比例组成,加入10倍量蒸馏水,浸泡1 h,沸水煎煮1 h,经纱布滤过,重复以上步骤1次,合并2次滤液,经加热浓缩制成浸膏,于真空干燥箱中干燥成粉末,于干燥器中存储(1 g浸膏粉含4 g生药,由湖南中医药大学第一附属医院制剂中心制备),临用前加入蒸馏水溶解。采用高效液相色谱-串联质谱法(HPLC-MS/MS)对粉末进行定量分析,其中黄芪甲苷171.5 μg/g、阿魏酸31.5 μg/g。
2.2 分组及给药途径
参考课题组前期研究[10,15],大鼠适应性喂养3 d后随机分为假手术组、模型组、脑泰方组(27 g/kg)和去铁酮(125 mg/kg)组,每组17只。脑泰方浸膏粉溶于蒸馏水,配制成质量浓度为2.7 g/mL的溶液,脑泰方组ig药物,假手术组及模型组ig等体积0.9%氯化钠溶液,1次/d,连续7 d;去铁酮组ig去铁酮,1次/d,连续3 d,于MCAO术后2 h取材。
2.3 MCAO模型的制备
大鼠ip 10%水合氯醛(0.3 mL/kg)麻醉,除假手术组外,其余各组大鼠均参照Longa法制备MCAO模型[16],假手术组只行麻醉和血管分离术,不结扎血管及导入栓线。
2.4 神经功能评分
参考Longa评分标准进行神经功能评分[16]:0分:无神经功能缺失症状且活动正常;1分:提住大鼠的尾巴时,病灶对侧前肢不能完全伸直;2分:大鼠爬行时向对侧转圈;3分:大鼠爬行时肢体向对侧倾倒;4分:大鼠不能自发行走且意识丧失。分值越高说明动物行为障碍越严重,1~3分为造模成功。
2.5 TTC染色检测
大鼠MCAO术后2 h,ip 10%水合氯醛(0.3 mL/kg)麻醉,取全脑,用0.9%氯化钠溶液洗涤并于−20 ℃速冻30 min,沿大鼠大脑冠状面将大脑切成5片,每片厚约2 mm;放入2% TTC染色液中,37 ℃避光染色30 min,每10分钟轻微振荡数次;染色后用4%多聚甲醛固定并拍照,脑正常区为红色,脑缺血梗死区为白色。
2.6 苏木素-伊红(HE)染色
石蜡切片烘烤、脱蜡和水化,进行HE染色,脱水、透明、封片后于显微镜下观察脑组织病理形态学改变。
2.7 尼氏染色
石蜡切片烘烤、脱蜡和水化、尼氏染色液染色、脱水、透明、封片等具体实验步骤严格按照尼氏染色液试剂说明书进行操作,于显微镜下观察并拍照。
2.8 普鲁士蓝染色
石蜡切片烘烤、脱蜡和水化、Perl’s染色工作液反应、孵育工作液孵育、增强工作液反应、复染染色液反应、脱水、透明、封片等具体实验步骤严格按照普鲁士蓝染色试剂盒说明书进行操作,于显微镜下观察并拍照。
5. 大数据时代的政府审计数据安全性与保密性问题突出。大数据技术能够把不同来源的、单一价值低的信息进行综合分析,从而得到有价值的信息,对信息的保密性与安全性提出较高要求。与此同时,政府审计过程中会接触和利用各种涉密资料和数据,无论是单位层面的财务和内部管理资料,还是国家层面密级较高的信息和数据,其泄露都可能给国家和被审计单位造成难以弥补的损失。大数据时代快速的数据处理、传播速度,要求每一个审计人员都应该加强安全意识,时刻将信息安全控制作为审计项目控制的重要环节来抓;审计机关需要不断加强授权和保密工作,确保数据的安全性,尤其是国家机密、企业商业秘密与个人隐私的安全性。
2.9 免疫组化法检测大鼠脑组织HSF1、HSPB1、TFR1和FTH1蛋白表达
石蜡切片烘烤、脱蜡和水化、内源性过氧化物酶阻断,分别加入HSF1、HSPB1、FTH1(1∶100)及TFR1抗体(1∶300)孵育,加入反应增强液反应、二抗孵育,进行DAB显色、复染、分色、返蓝、脱水、透明、封片,切片于光镜下放大400倍观察显色结果,阳性细胞的细胞质或细胞核着色呈棕黄色,采用Image J软件分析图片平均吸光度()值,平均值为图片上各点的值之和除以目标分布区域的面积。
2.10 Western blotting检测大鼠脑组织HSF1、HSPB1、TFR1和FTH1蛋白表达
取各组大鼠脑组织50 mg,按50∶1比例加入RAPI裂解液(400 μL)和蛋白酶抑制剂(80 μL),提取组织蛋白,采用BCA蛋白定量试剂盒测定蛋白质量浓度,蛋白样品经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转至PVDF膜,加入5%脱脂牛奶室温封闭,分别加入HSF1(1∶1500)、HSPB1(1∶1500)、TFR1(1∶5000)、FTH1(1∶2500)抗体, 4 ℃孵育过夜;加入二抗(1∶8000),37 ℃恒温水浴箱内振荡孵育1 h;加入ECL发光液,采用凝胶成像分析仪显影曝光,Image Lab软件对蛋白灰度值进行分析。
2.11 大鼠脑组织铁和丙二醛及活性氧含量检测
各组大鼠脑组织铁与丙二醛及活性氧含量均通过试剂盒进行检测,具体实验步骤严格按照各试剂说明书进行操作。
2.12 统计学处理
3 结果
3.1 脑泰方对脑缺血大鼠神经功能评分的影响
各组大鼠在术后2 h行神经功能评分,如图1所示,假手术组大鼠神经功能评分均为0分;与假手术组比较,模型组大鼠神经功能评分显著升高(<0.01);与模型组比较,各给药组大鼠神经功能评分明显降低(<0.05、0.01)。
3.2 脑泰方对脑缺血大鼠脑组织TTC染色的影响
如图2所示,假手术组大鼠脑片为红色,未见白色梗死区域;与假手术组比较,模型组大鼠脑片出现白色梗死区域;与模型组比较,各给药组大鼠脑片白色梗死区域较少。
3.3 脑泰方对脑缺血大鼠脑组织HE染色的影响
如图3所示,假手术组大鼠海马CA2区细胞的形态结构正常且轮廓较为清晰,未见明显细胞核固缩、空泡样改变、细胞间隙增宽、细胞肿胀等细胞损伤的病理形态学表现。与假手术组比较,模型组大鼠海马CA2区部分细胞可见细胞间隙增宽及肿胀,且细胞轮廓欠清晰。与模型组比较,各给药组大鼠正常细胞增多,细胞损伤程度较低,细胞轮廓大致正常。

与假手术组比较:**P<0.01;与模型组比较:#P<0.05 ##P<0.01,图6~9同

图2 脑泰方对脑缺血大鼠脑组织TTC染色的影响

图3 脑泰方对脑缺血大鼠脑组织HE染色的影响(×400)
3.4 脑泰方对脑缺血大鼠脑组织普鲁士蓝染色的影响
如图4所示,假手术组大鼠皮质及海马CA2区含铁聚集颗粒细胞(呈黄棕色到黄褐色)聚集不明显。与假手术组比较,模型组大鼠含铁聚集颗粒细胞的数目增加,且皮质区含铁聚集颗粒细胞数目多于海马CA2区(海马CA2区含铁聚集颗粒细胞数目变化不显著)。与模型组比较,各给药组大鼠含铁聚集颗粒细胞的数目减少,且海马CA2区含铁聚集颗粒细胞数目少于皮质区(海马CA2区含铁聚集颗粒细胞数目变化不显著)。
3.5 脑泰方对脑缺血大鼠脑组织尼氏染色的影响
如图5所示,假手术组大鼠海马CA2区细胞的形态结构正常且轮廓较清晰,尼氏体和胞核及胞仁均清晰可辨;与假手术组比较,模型组大鼠海马CA2区尼氏体减少,细胞间隙增宽及肿胀,且细胞轮廓欠清晰;与模型组比较,各给药组大鼠海马CA2区尼氏体增多,细胞损伤程度较低。

图4 脑泰方对脑缺血大鼠脑组织普鲁士蓝染色的影响(×400)
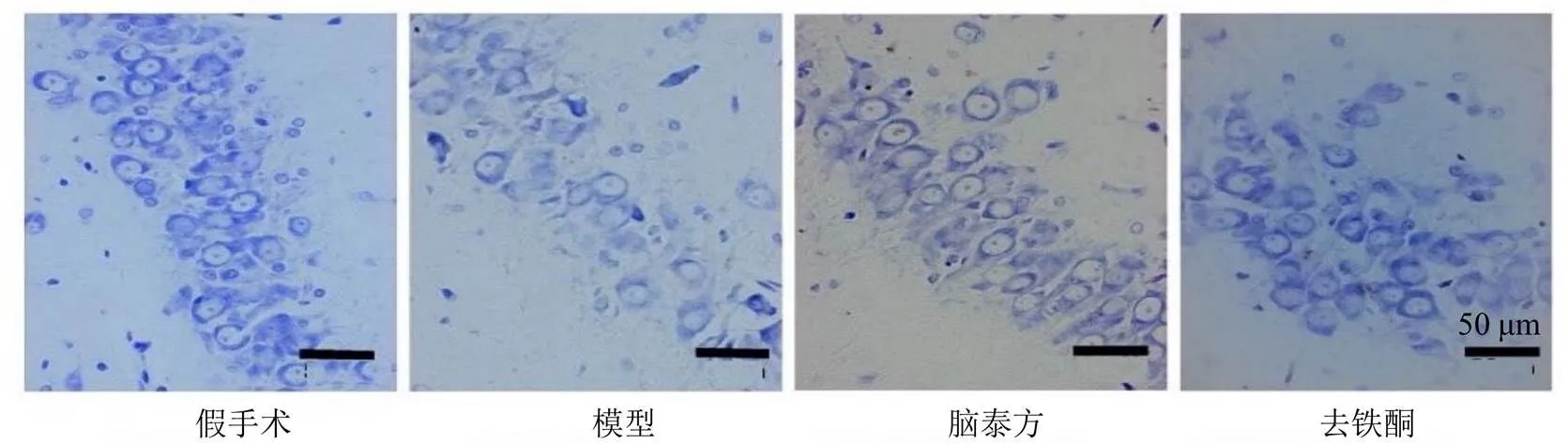
图5 脑泰方对脑缺血大鼠脑组织尼氏染色的影响(×400)
3.6 脑泰方对脑缺血大鼠脑组织HSF1、HSPB1、TFR1和FTH1蛋白表达的影响
免疫组化结果如图6、7所示,与假手术组比较,模型组大鼠脑组织HSF1、HSPB1、TFR1蛋白表达显著上调(<0.05、0.01),脑组织FTH1蛋白表达显著下调(<0.01);与模型组比较,各给药组大鼠脑组织HSF1、HSPB1、FTH1蛋白表达显著上调(<0.05、0.01),脑组织TFR1蛋白表达显著下调(<0.05)。
Western blotting结果如图8所示,与假手术组比较,模型组大鼠脑组织HSF1、HSPB1、TFR1蛋白表达水平显著升高(<0.05、0.01),FTH1蛋白表达显著降低(<0.01);与模型组比较,各给药组大鼠脑组织HSF1、HSPB1、FTH1蛋白表达显著升高(<0.05、0.01),TFR1蛋白表达显著降低(<0.05、0.01)。
3.7 脑泰方对脑缺血大鼠脑组织铁、丙二醛及活性氧含量的影响
如图9所示,与假手术组比较,模型组大鼠脑组织铁、丙二醛及活性氧含量显著升高(<0.01);与模型组比较,各给药组大鼠脑组织铁、丙二醛及活性氧含量显著降低(<0.05、0.01)。

图6 脑泰方对脑缺血大鼠脑组织HSF1和HSPB1蛋白表达的影响(, n = 5)

图7 脑泰方对脑缺血大鼠脑组织TFR1和FTH1蛋白表达的影响(, n = 5)

图8 脑泰方对脑缺血大鼠脑组织HSF1、HSPB1、TFR1和FTH1蛋白表达的影响(, n = 5)

图9 脑泰方对脑缺血大鼠脑组织脑组织铁、丙二醛及活性氧含量的影响(, n = 5)
4 讨论
缺血性脑卒中是由于颈内动脉、大脑中动脉或椎/基底动脉阻塞等各种原因所致的局部脑组织区域血液供应障碍、氧气和三磷酸腺苷(adenosine triphosphate,ATP)及葡萄糖减少、膜离子泵功能丧失、血脑屏障破坏、线粒体膜完整性破裂等,最终导致脑组织缺血缺氧性病变坏死及神经功能缺失的一种疾病[1,17-18]。既往研究表明,坏死、凋亡、自噬、程序性坏死、Parthanatos(基于PARP-1的激活的一种程序性细胞坏死)、焦亡等细胞死亡形式在缺血性脑卒中的脑损伤机制中扮演着重要角色[7]。新近研究发现,铁死亡作为一种新定义的细胞死亡形式与缺血性脑卒中密切相关,铁超载及铁依赖性脂质过氧化产物的堆积可加剧缺血性脑卒中临床患者或动物模型的神经元损伤,而铁死亡抑制剂则可减轻上述损伤[6,19]。
铁死亡以细胞内铁沉积为特征,铁和脂质过氧化产物是铁死亡的2个主要参与者,而发生铁死亡的可能性由铁离子积累诱导的活性氧产生和避免脂质过氧化的抗氧化系统之间的平衡决定[19-21]。由于铁在脂质过氧化生物学过程中介导活性氧产生和酶活性发挥着重要作用,因此铁死亡受铁代谢生物学过程中铁的吸收、出口、利用、储存共同调节[5]。研究表明,TFR1可与TF-Fe3+形成复合物内吞入胞体并完成铁的吸收与释放,而沉默TFR1编码的基因TFRC则可抑制TFR1介导的铁摄取及铁死亡[21-22]。此外,铁储存蛋白复合物由铁蛋白轻链多肽(ferritin light chain,FTL)与FTH1组成,抑制铁代谢主要转录因子铁反应元件结合蛋白2(iron responsive element binding protein 2,IRFB2)的表达则可显著增加FTL和FTH1的表达及铁蛋白的铁储存水平,从而抑制铁死亡[23]。
HSPs是一个高度保守的分子伴侣家族,由细胞对各种应激反应产生,在生物界普遍存在[24-25]。HSPB1也称为HSP25(小鼠)和HSP27(人类),是分布最广和研究最多的小热休克蛋白,HSFs是调节应激条件下诱导合成热休克蛋白的主要转录因子,HSPB1的水平以HSF1依赖性方式上调[11-12]。HSPB1转基因小鼠在永久性MCAO后能明显降低皮质的损伤[14],而小鼠iv HSPB1则可减少大脑中动脉阻塞在灌注(transient middle cerebral occlusion,tMCAO)法后的梗塞体积,具有保护神经元的作用[13]。近来研究发现,HSF1和HSPB1的敲低增强了erastin诱导的铁死亡,而热休克预处理和HSPB1的过表达则可抑制erastin诱导的铁死亡。HSPB1介导的肌动蛋白细胞骨架可抑制TFR1介导的铁摄取及上调FTH1的表达,这个过程抑制了内吞作用和转铁蛋白的循环,从而降低了细胞内铁的含量,进而抑制了因过量的铁通过芬顿反应产生的活性氧及随后的脂质过氧化产物引起的铁死亡[11]。
缺血性脑卒中在中医学中属“中风”病范畴,本病多是在内伤积损的基础上,复因劳逸失度、情志不遂、饮酒饱食或外邪侵袭等触发,引起脏腑阴阳失调、血随气逆、肝阳暴涨、内风旋动、夹痰夹火、横窜经脉、蒙蔽神窍,从而发生卒然昏仆、半身不遂诸症。中医药在缺血性脑卒中临床应用中具有独特的优势,其可在抗兴奋性氨基酸和自由基损伤、抑制钙超载、调节细胞自噬及凋亡、促进血管新生和神经再生等方面发挥重要的作用[26-27]。脑泰方是本课题组研发的治疗缺血性脑卒中的有效中药方剂,方中选用黄芪为君药,借其力专,大补脾胃元气,令气旺则血活,血活则瘀除;川芎活血行气,气行则血行,是为臣药;地龙、僵蚕具有通经活络、化疾熄风的功效,两者均为佐药,诸味配合,共奏益气活血通络、祛风化痰之效。多年来,脑泰方在防治急性脑缺血性损伤方面取得诸多研究成果,能显著减少脑缺血所致的大鼠神经元损伤及促进神经功能的恢复。课题组前期通过对脑泰方有效物质进行系统分析,在差异蛋白中发现了铁蛋白的异常改变,进而从铁代谢稳态调节角度开创了中医药防治缺血性脑卒中机制研究的新方向[28]。
去铁酮是FDA批准的口服铁螯合剂,且在分化的人类多巴胺神经元前体细胞中,去铁酮能够特异性抑制由erastin和谷氨酸引起的铁死亡[5]。本研究以铁死亡抑制剂去铁酮为阳性对照药物,通过MCAO线栓法制备大鼠模型,观察脑组织梗死体积及形态结构、尼氏体数目、神经元内铁聚集水平,并检测脑组织HSF1、HSPB1、TFR1和FTH1蛋白表达水平及脑铁、丙二醛、活性氧含量。结果显示,脑泰方可上调大鼠脑组织HSF1、HSPB1、FTH1蛋白表达及下调TFR1蛋白表达,降低脑组织铁、丙二醛及活性氧含量;增加缺血脑组织尼氏体数目;减轻脑组织病理损伤及神经功能缺失;减少脑组织梗死体积。
综上所述,由于细胞内铁离子的异常沉积,活性氧及脂质过氧化产物的过度产生是铁死亡的主要的生化指标,且鉴于HSF1/HSPB1通路对铁死亡的负向调控作用,结合本研究的结果,推测脑泰方可能通过上调HSF1/HSPB1通路,抑制TFR1的表达以减少神经元铁的吸收,上调FTH1的表达以增加铁蛋白的铁存储,以此调控铁代谢稳态平衡,进而抑制了因过量的铁通过芬顿反应产生的活性氧及随后的脂质过氧化产物引起的缺血性脑卒中神经元铁死亡。
利益冲突 所有作者均声明不存在利益冲突
[1] Katan M, Luft A. Global burden of stroke [J]., 2018, 38(2): 208-211.
[2] Zhou B, Liu J, Kang R,. Ferroptosis is a type of autophagy-dependent cell death [J]., 2020, 66: 89-100.
[3] Toyokuni S, Ito F, Yamashita K,. Iron and thiol redox signaling in cancer: An exquisite balance to escape ferroptosis [J]., 2017, 108: 610-626.
[4] Galaris D, Barbouti A, Pantopoulos K. Iron homeostasis and oxidative stress: An intimate relationship [J]., 2019, 1866(12): 118535.
[5] Chen X, Yu C, Kang R,. Iron metabolism in ferroptosis [J]., 2020, 8: 590226.
[6] Tuo Q Z, Lei P, Jackman K A,. Tau-mediated iron export prevents ferroptotic damage after ischemic stroke [J]., 2017, 22(11): 1520-1530.
[7] Datta A, Sarmah D, Mounica L,. Cell death pathways in ischemic stroke and targeted pharmacotherapy [J]., 2020, 11(6): 1185-1202.
[8] 贺运河, 葛金文, 成战鹰, 等. 脑泰方对气虚血瘀型脑梗死患者血浆TXB2、6-Keto-PGF1α及血清TNF-α含量的影响 [J]. 中国中医药信息杂志, 2002, 9(4): 16-17.
[9] 黄娟, 廖君, 彭熙炜, 等. 脑泰方对脑缺血/再灌注大鼠海马区Nrf2、HO-1和膜铁转运辅助蛋白表达的影响 [J]. 中国药理学通报, 2017, 33(10): 1467-1472.
[10] 廖君, 夏兴, 石咏梅, 等. 脑缺血大鼠海马CA2区转铁蛋白受体及膜铁转运蛋白的表达及脑泰方提取物干预研究 [J]. 中华中医药杂志, 2014, 29(5): 1406-1411.
[11] Sun X, Ou Z, Xie M,. HSPB1 as a novel regulator of ferroptotic cancer cell death [J]., 2015, 34(45): 5617-5625.
[12] Ferns G, Shams S, Shafi S. Heat shock protein 27: Its potential role in vascular disease [J]., 2006, 87(4): 253-274.
[13] Teramoto S, Shimura H, Tanaka R,. Human-derived physiological heat shock protein 27 complex protects brain after focal cerebral ischemia in mice [J]., 2013, 8(6): e66001.
[14] van der Weerd L, Tariq Akbar M, Aron Badin R,. Overexpression of heat shock protein 27 reduces cortical damage after cerebral ischemia [J]., 2010, 30(4): 849-856.
[15] Lan B, Ge J W, Cheng S W,. Extract of Naotaifang, a compound Chinese herbal medicine, protects neuron ferroptosis induced by acute cerebral ischemia in rats [J]., 2020, 18(4): 344-350.
[16] Longa E Z, Weinstein P R, Carlson S,. Reversible middle cerebral artery occlusion without craniectomy in rats [J]., 1989, 20(1): 84-91.
[17] Au A, Griffiths L R, Irene L,. The impact of APOA5, APOB, APOC3 and ABCA1 gene polymorphisms on ischemic stroke: Evidence from a meta-analysis [J]., 2017, 265: 60-70.
[18] Deb P, Sharma S, Hassan K M. Pathophysiologic mechanisms of acute ischemic stroke: An overview with emphasis on therapeutic significance beyond thrombolysis [J]., 2010, 17(3): 197-218.
[19] Tang D, Chen X, Kang R,. Ferroptosis: Molecular mechanisms and health implications [J]., 2021, 31(2): 107-125.
[20] Dixon S J, Lemberg K M, Lamprecht M R,. Ferroptosis: An iron-dependent form of nonapoptotic cell death [J]., 2012, 149(5): 1060-1072.
[21] Xie Y, Hou W, Song X,. Ferroptosis: Process and function [J]., 2016, 23(3): 369-379.
[22] Kwon M Y, Park E, Lee S J,. Heme oxygenase-1 accelerates erastin-induced ferroptotic cell death [J]., 2015, 6(27): 24393-24403.
[23] Li J, Cao F, Yin H L,. Ferroptosis: Past, present and future [J]., 2020, 11(2): 88.
[24] Georgopoulos C, Welch W J. Role of the major heat shock proteins as molecular chaperones [J]., 1993, 9: 601-634.
[25] Wu C. Heat shock transcription factors: Structure and regulation [J]., 1995, 11: 441-469.
[26] 王树林, 安芳. 中药对脑缺血再灌注损伤保护作用及机制研究进展 [J]. 神经药理学报, 2014, 4(3): 39-48.
[27] 赵薇, 李方江, 王树. 脑缺血损伤保护作用机制研究进展 [J]. 神经药理学报, 2014, 4(6): 55-63.
[28] 王国佐, 龚盛强, 兰斌, 等. 脑泰方干预的MCAO模型大鼠血浆差异蛋白筛选及其生物信息学分析 [J]. 辽宁中医杂志, 2018, 45(12): 2473-2477.
Mechanism of Naotaifang on ischemic stroke through regulating cellular iron transport and inhibiting ferroptosis
RAO Zheng-qing, MEI Zhi-gang, GE Jin-wen, YANG Mei, MI Zhao-di, LAN Bin, YANG Tong, WANG Guo-zuo
College of Integrated Traditional Chinese and Western Medicine, Hunan University of Traditional Chinese Medicine, Changsha 410208, China
To explore whether Naotaifang (脑泰方) reduces brain iron deposition by regulating heat shock factor 1 (HSF1)/heat shock proteins B1 (HSPB1) pathway, inhibiting the deposition of reactive oxygen species and the production of lipid peroxidation products, reducing neuronal ferroptosis, and exerting a protective effect on cerebral ischemia injury.SD rats were randomly divided into sham group, model group, Naotaifang (27 g/kg) group ang deferiprone (125 mg/kg) group, drugs were given for intervention. Cerebral ischemia rats model was prepared by middle cerebral artery occlusion (MCAO) method, and the neurological function was scored 2 h after operation. TTC staining was used to detect cerebral infarct volume; HE staining was used to observe the morphology and damage; Nissl staining was used to observe the number of Nissl bodies; Prussian blue staining was used to observe the level of iron accumulation in neurons; Western blotting and immunohistochemical experiments werre used to detect the protein expression levels of HSF1, HSPB1, transferrin receptor 1 (TFR1) and ferritin heavy polypeptide1 (FTH1); Iron ion detection kits, malondialdehyde detection kits and reactive oxygen detection kits were used to detect brain iron, malondialdehyde and reactive oxygen content.Compared with model group, the cerebral infarction volume of rats in Naotaifang group was decreased, and neurological function score was decreased (< 0.01); Nissl bodies in cerebral ischemia area was increased, and the degree of cell damage was decreased; Number of iron-containing aggregate granule cells were decreased; Brain iron, malondioxide aldehyde and reactive oxygen content were decreased (< 0.05, 0.01); HSF1, HSPB1 and FTH1 protein expressions were up-regulated (< 0.05, 0.01), and TFR1 protein expression was down-regulated (< 0.05).Naotaifang may up-regulate HSF1/HSPB1 pathway, inhibit the expression of TFR1 to reduce neuronal iron absorption, and increase the expression of FTH1 to increase the iron storage of ferritin, thereby regulating the steady-state balance of iron metabolism, inhibiting excessive ferroptosis of neurons in ischemic stroke caused by active oxygen produced by Fenton reaction and subsequent lipid peroxide.
stroke; ferroptosis; HSF/HSPB1 pathway; cellular iron transport; Naotaifang
R285.5
A
0253 - 2670(2021)21 - 6552 - 09
10.7501/j.issn.0253-2670.2021.21.013
2021-05-07
湖南省自然科学基金面上项目(2020JJ4467);湖南省教育厅科学研究重点项目(19A378);湖南省教育厅科学研究项目(18C0379)
饶政清,男,硕士研究生,主要从事中西医结合心脑血管疾病防治研究。E-mail: 1054898967@qq.com
王国佐,男,博士,硕士生导师,副教授,主要从事中西医结合心脑血管疾病防治研究。E-mail: 1586074663@qq.com
[责任编辑 李亚楠]
