天佛参口服液对A549细胞体内外增殖的影响及机制研究
2021-11-08张丹丹翟云良张亚云王恒斌
张丹丹,翟云良,季 芳,张亚云,夏 扬,李 全,王恒斌
天佛参口服液对A549细胞体内外增殖的影响及机制研究
张丹丹,翟云良#,季 芳,张亚云,夏 扬,李 全,王恒斌*
雷允上药业集团有限公司,江苏 苏州 215009
探究天佛参口服液对人非小细胞肺癌A549细胞与裸鼠移植瘤增殖的作用以及相关作用机制。采用Cell Titer-Glo发光法检测天佛参口服液对9种不同基因突变表型的肺癌细胞系增殖的抑制作用;采用流式细胞术检测天佛参口服液对A549细胞周期及凋亡的影响;采用Western blotting法考察天佛参口服液对A549细胞增殖相关蛋白表达的影响。裸鼠sc A549细胞建立裸鼠移植瘤模型,考察天佛参口服液对小鼠皮下移植瘤生长的影响。天佛参口服液抑制A549细胞增殖,呈剂量相关性;天佛参口服液阻滞A549细胞周期于G0/G1期和G2/M期(<0.05、0.01),并且1%天佛参口服液可以显著诱导A549细胞凋亡(<0.01);天佛参口服液显著抑制表皮生长因子受体(epidermal growth factor receptor,EGFR)、Raf、丝裂原细胞外信号调节激酶(mitogen extracellular signal-regulated kinase,MEK)以及细胞外调节蛋白激酶(extracellular regulated protein kinase,ERK)蛋白的磷酸化水平(<0.05、0.01),呈剂量相关性。体内实验结果显示,2.25 mL/kg天佛参口服液对裸鼠移植瘤模型的肿瘤体内生长具有显著抑制作用(<0.05)。天佛参口服液对A549细胞的体内外生长具有显著抑制作用,其作用机制可能与抑制EGFR活性和下调Ras/Raf/MEK/ERK信号通路表达有关。
天佛参口服液;肺癌;A549细胞;增殖;裸鼠移植瘤模型;抗肿瘤
肺癌是世界上最常见的恶性肿瘤之一,发病率和死亡率位居恶性肿瘤之首。近年来我国肺癌发病率呈逐渐上升趋势,非小细胞肺癌(non-small cell lung cancer,NSCLC)约占所有肺癌的80%~85%[1-2],其中30%~70%的患者确诊时已处于晚期,5年生存率仅为17.7%[3]。因此大部分肺癌患者在确诊时已经失去最佳手术时机,化疗成为临床晚期肺癌患者的主要治疗手段,而晚期肺癌患者由于化疗药物的各种不良反应及继发的耐药情况极易导致化疗失败。天佛参口服液是一种已被批准生产的抗癌中成药,由西洋参、蟾酥、天冬、倒卵叶五加、猕猴桃根、沙棘、土贝母、佛手8味中药制成,具有扶正祛邪、养阴益气、清热解毒、消核散结的功效,主治恶性肿瘤所致的气阴两虚型及气滞、血瘀、痰凝、毒聚等兼见症候。临床研究表明,天佛参口服液联合化疗药治疗NSCLC疗效明显,可以降低化疗药的不良反应,并提升晚期肺癌患者的生活质量,延长患者生存期[4-7]。本研究以人非小细胞肺癌A549细胞作为研究对象,探究天佛参口服液对其体内外增殖的作用及作用机制,以期为天佛参口服液用于治疗/辅助治疗肺癌及其抗肿瘤活性提供新的科学依据。
1 材料
1.1 细胞株
人非小细胞肺癌NCI-H2228细胞、人大细胞肺癌NCI-H1299细胞、A549细胞、人大细胞肺癌NCI-H460细胞、人非小细胞肺癌NCI-H23细胞、人肺癌腺癌NCI-H1792细胞和人肺退行性癌Calu-6细胞购自美国ATCC;人肺腺癌NCI-H1975细胞购自中国科学院上海生命科学研究院;人非小细胞肺腺癌NCI-H157细胞购自北京银紫晶生物医药技术有限公司。
1.2 动物
SPF级雄性BALB/c裸鼠,6~8周龄,体质量18~20 g,购自北京大学医学部实验动物中心,动物许可证号SCXK(京)2016-0010。动物饲养于SPF动物房中,温度20~24 ℃,湿度40%~60%,照明12 h/d。动物实验经中国中医科学院中药研究所动物实验控制与监督委员会批准(批准号2018-027)。
1.3 试剂
天佛参口服液(体外实验生产批号1404281、体内实验生产批号1805031)由常熟雷允上制药有限公司生产,本品含西洋参不得少于0.35 mg/mL [以人参皂苷Rb1(C54H92O23)计];DMEM培养基、RPMI 1640培养基购自美国Gibco公司;胎牛血清、胰酶购自美国Hyclone公司;Cell Titer-Glo®发光法细胞活力检测试剂盒购自美国Promega公司;磷酸化表皮生长因子受体(phosphorylated epidermal growth factor receptor,p-EGFR)抗体、EGFR抗体、p-b-Raf抗体、b-Raf抗体、磷酸化丝裂原细胞外信号调节激酶(phosphorylated mitogen extracellular signal-regulated kinase,p-MEK)抗体、MEK抗体、磷酸化细胞外调节蛋白激酶(phosphorylated extracellular regulated protein kinases,p-ERK)抗体、ERK抗体、β-actin抗体、二抗均购自美国CST公司;PE-Annexin V凋亡检测试剂盒购自美国BD公司;PBS溶液、RNAse A溶液(不含DNAse)购自北京索莱宝科技有限公司;碘化丙啶(PI)购自美国Sigma公司。
1.4 仪器
1300系列A2生物安全柜(美国Thermo Fisher Scientific公司);Optec倒置显微镜(重庆奥特光学仪器有限责任公司);Envision多功能酶标仪(美国PerkinElmer公司);Guava EasyCyte流式细胞仪(美国Millipore公司)。
2 方法
2.1 药物配制
体外实验以天佛参口服液作为原液(浓度视为100%),每次使用前用无菌的3%蔗糖水溶液稀释成需要的浓度,再经培养基稀释成终浓度分别为10.000 00%、3.330 00%、1.110 00%、0.370 00%、0.123 00%、0.041 20%、0.013 70%、0.004 57% 8个浓度梯度进行细胞干预;动物实验中,用蒸馏水将天佛参口服液原液稀释成4.44、2.22倍的浓度分别用于低、高剂量组的动物给药,现配现用。
2.2 细胞培养
各细胞株用含10%胎牛血清、100 U/mL青霉素和100 mg/L链霉素,于37 ℃、5% CO2培养箱中培养,待细胞融合度为70%时,进行传代,取对数期、生长状态良好的细胞进行实验。
2.3 Cell Titer-Glo法检测9种不同基因突变表型的肺癌细胞系活力
取处于对数生长期的细胞,经胰酶消化后接种于96孔板中,180 μL/孔,其中A549细胞接种密度为1×103/孔,NCI-H2228细胞接种密度为4×103/孔,其余细胞接种密度为2×103/孔,培养24 h。由于天佛参口服液的溶剂为3%蔗糖,因此用3%蔗糖水溶液将天佛参口服液进行稀释,最高浓度取天佛参口服液原液的10%,并进行3倍梯度稀释,每个浓度取20 μL加入到受试细胞中,3%蔗糖水溶液处理组为对照孔。处理72 h后,弃去培养基,加入25 μL Cell Titer-Glo®试剂,室温振荡混匀2 min,静止10 min后,采用酶标仪读取Luminescence荧光信号,使用GraphPad Prism 5.0软件计算天佛参口服液对细胞增殖抑制的半数抑制浓度(half inhibitory concentration,IC50)值。
2.4 流式细胞仪测定A549细胞周期分布
将A549细胞以2.5×105/孔接种于6孔板中,37 ℃过夜培养。加入终浓度分别为0.030%、0.060%、0.125%、0.250%、0.500%的天佛参口服液,对照组加入3%蔗糖水溶液,处理24 h后用胰酶消化并收集细胞。收集的细胞样品用预冷的PBS溶液洗涤2遍,用70%乙醇-PBS溶液吹散细胞,4 ℃固定过夜;用预冷的PBS溶液洗涤2遍,尽量去除残留的乙醇;样品用含50 μg/mL RNase-A和PI的染液进行染色,37 ℃避光孵育30 min,采用流式细胞仪检测细胞周期,通过FlowJo 3.0软件进行数据分析。
2.5 流式细胞仪测定A549细胞凋亡情况
取对数生长期的A549细胞,以2.5×105/孔接种于6孔板中,37 ℃过夜培养。加入终浓度分别为0.01%、0.10%、1.00%的天佛参口服液,对照组加入3%蔗糖水溶液,处理24 h后用胰酶消化并收集细胞。收集的细胞样品用预冷的PBS溶液洗涤2遍,重悬于50 μL结合液中,每管加入2.5 μL PE- Annexin V试剂和2.5 μL 7-AAD试剂;对照组加入200 μL结合液,均分成4等份:1份不加任何染料,1份加入2.5 μL PE-Annexin V试剂,1份加入2.5 μL 7-AAD试剂,另1份加入2.5 μL PE-Annexin V试剂和2.5 μL 7-AAD试剂。温和混匀,避光室温孵育15 min,每份样品加入150 μL结合液混匀,1 h内采用流式细胞仪检测细胞凋亡情况。
2.6 Western blotting法检测A549细胞p-EGFR、EGFR、p-b-Raf、b-Raf、p-MEK、MEK、p-ERK和ERK蛋白表达情况
取对数生长期的A549细胞,以5×105/孔接种于6孔板中,每组样品设3个复孔,培养24 h。加入终浓度分别为0.001%、0.010%、0.100%的天佛参口服液,对照组加入3%蔗糖水溶液,分别处理0、10、20、30、45、60、90、120、240 min,用胰酶消化并收集细胞,收集的细胞样品用预冷的PBS溶液清洗1次,加入细胞裂解液(1% NP-40、20 mmol/L Tris-HCl pH 8.0、137 mmol/L NaCl、10%甘油、磷酸酶抑制剂、蛋白酶抑制剂),冰上裂解15 min;4 ℃、12 000 r/min离心10 min,取上清液,采用BCA蛋白定量试剂盒测定蛋白质量浓度。蛋白样品经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转至PVDF膜,加入5%脱脂奶粉封闭,分别加入p-EGFR、EGFR、p-b-Raf、b-Raf、p-MEK、MEK、p-ERK、ERK和β-actin抗体,4 ℃孵育过夜;TBST洗膜后,加入二抗,室温孵育1 h,TBST清洗后,X光曝光显影,采用Image J灰度分析软件进行定量分析。
2.7 裸鼠移植瘤模型
BALB/c裸鼠适应性喂养7 d后,随机分为模型组和天佛参口服液高、低剂量(4.50、2.25 mL/kg,分别相当于临床剂量的1/2、1/4倍)组,每组6只。造模当天取对数生长期的A549细胞胰酶消化,细胞计数后以预冷的0.9%的氯化钠溶液制备成5×106/mL细胞悬液备用。BALB/c裸鼠用75%乙醇消毒右侧腋下皮肤,每只裸鼠右腋sc 0.2 mL A549细胞悬液[19],造模后24 h开始给药。以给药当天为第1天,各给药组ig相应药物(10 mL/kg),模型组ig等体积的蒸馏水,1次/d,连续48 d。第10天肿瘤开始陆续出现,于接种第20天(即给药第19天)开始使用游标卡尺测量肿瘤长径(mm)和短径(mm),并计算肿瘤体积。每2~4天测1次,保持1周测2次。动物给药第48天进行安乐死,剥离肿瘤称定质量,计算抑瘤率。
肿瘤体积=1/2×肿瘤长径×肿瘤短径2
抑瘤率=(模型组平均瘤质量-给药组平均瘤质量)/模型组平均瘤质量
2.8 统计学分析
3 结果
3.1 天佛参口服液对不同肺癌细胞系增殖的抑制作用
如图1和表1所示,天佛参口服液对9种不同基因突变表型的肺癌细胞系均存在不同程度的抑制作用,其中以N-Ras突变的NCI-H1299细胞和K-Ras突变的A549细胞对天佛参口服液最敏感,IC50分别为0.012%和0.013%,并且浓度超过0.3%的天佛参口服液能够完全抑制并杀死9种不同基因突变表型的肺癌细胞系。

图1 天佛参口服液对不同肺癌细胞增殖的抑制作用

表1 天佛参口服液对不同肺癌细胞增殖的抑制作用 (n =2)
3.2 天佛参口服液对A549细胞周期的影响
细胞增殖抑制与细胞周期分布密切相关。根据细胞增殖实验结果,进一步检测不同浓度天佛参口服液对其敏感细胞株A549的细胞周期分布影响,结果如图2和表2所示,A549细胞经不同浓度天佛参口服液处理24 h后,与对照组比较,0.030%天佛参口服液组G0/G1期细胞显著增加(<0.01),而0.060%、0.125%、0.250%、0.50%天佛参口服液组G2/M期细胞显著增加(<0.01),表明低浓度的天佛参口服液能够使A549细胞周期阻滞于G0/G1期,而浓度超过0.06%的天佛参口服液能够明显阻滞A549细胞于G2/M期,并成剂量相关性。
3.3 天佛参口服液对A549细胞凋亡的影响
细胞凋亡指为维持内环境稳定,由基因控制的细胞自主的有序的死亡。与对照组相比,肿瘤细胞存在明显的抗凋亡现象。如图3和表3所示,0.10%、1.00%天佛参口服液显著诱导A549细胞发生晚期凋亡(<0.05),表明高浓度的天佛参口服液能够诱导A549细胞凋亡,并呈剂量相关性。

图2 天佛参口服液对A549细胞周期的影响

表2 天佛参口服液对A549细胞周期分布的影响(, n = 3)
与对照组比较:*<0.05**<0.01,表3同
*<0.05**<0.01control group, same as table 3
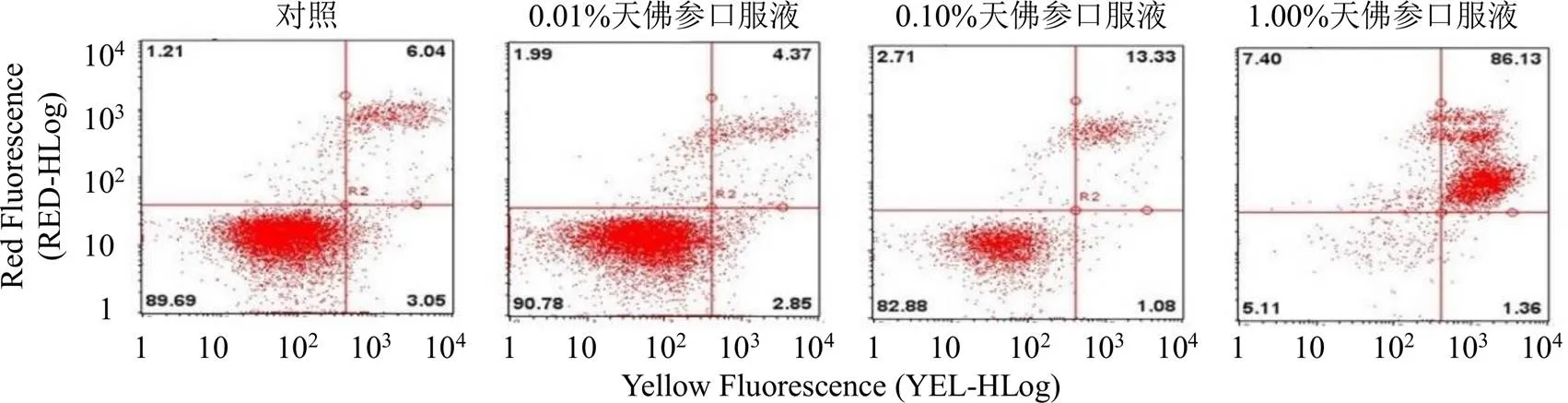
图3 天佛参口服液对A549细胞凋亡的影响

表3 天佛参口服液对A549细胞凋亡的影响(, n = 3)
3.4 天佛参口服液对A549细胞增殖相关蛋白表达的影响
为了进一步阐明TFS抗肿瘤的作用机制,检测了天佛参口服液对增殖信号通路Ras/Raf/MEK/ ERK磷酸化水平的调节作用。首先观察了0.5%天佛参口服液处理A549细胞不同时间点对该细胞信号转导通路中EGFR、Raf、MEK、ERK蛋白磷酸化的作用,结果如图4-A所示,0.5%天佛参口服液处理细胞A549 10 min时,MEK和ERK蛋白磷酸化水平开始降低;处理30 min时EGFR和b-Raf蛋白磷酸化水平开始降低,并于45 min时降低最明显,天佛参口服液对Raf、MEK及ERK蛋白磷酸化的抑制作用一直持续2 h左右,随后作用缓慢减弱,于作用4 h时MER和ERK的磷酸化水平开始上调。随后观察了不同浓度天佛参口服液处理A549细胞2 h对该细胞信号转导通路的作用,结果如图4-B所示,与对照组比较,不同浓度天佛参口服液作用2 h后均能够不同程度地下调A549细胞中EGFR、Raf、MEK及ERK激酶结构域的磷酸化水平,并且存在一定的剂量相关性,且0.1%天佛参口服液抑制作用最显著(<0.05、0.01),表明天佛参口服液抑制A549细胞增殖的作用机制可能与调控EGFR活性及其下游信号通路Ras/Raf/MEK/ERK有关。

A-0.5%天佛参口服液作用不同时间对A549细胞增殖相关蛋白表达的影响 B-不同剂量天佛参口服液对A549细胞增殖相关蛋白表达的影响 与对照组比较:*P<0.05 **P<0.01
3.5 天佛参口服液对裸鼠移植瘤模型体内肿瘤生长的影响
如图5和表4所示,给药48 d期间,与模型组比较,天佛参口服液高、低剂量(4.50、2.25 mL/kg)对小鼠体质量均没有明显影响;天佛参口服液高、低剂量对裸鼠移植瘤模型肿瘤生长均具有一定的抑制作用,抑瘤率分别达到27.7%、36.7%;与模型组比较,天佛参口服液低剂量组小鼠瘤质量显著降低(<0.05)。

与模型组比较:*P<0.05

表4 天佛参口服液对裸鼠移植瘤模型肿瘤抑制率的影响()
与模型组比较:*<0.05
*<0.05model group
4 讨论
天佛参口服液源于关中名医李新民教授经过长期的临床实践,反复论证而总结出的抗癌经验方。近年来,诸多药理研究和临床研究表明天佛参口服液对喉癌[8]、胃癌、肝癌、宫颈癌[9]等多种肿瘤细胞均具有良好的抑制作用,尤其临床用于肺癌的治疗起到很好的效果,能够提高患者免疫功能,改善晚期肺癌患者的临床症状和生活质量。此外,天佛参口服液与化疗药联用可以减轻化疗引起的不良反应,达到增效减毒效应,经临床实践证明为安全有效的治疗非小细胞肺癌的中成药[10],但是其抑癌机制尚未阐明。本研究首先通过体外增殖实验全面地观察天佛参口服液对9种不同基因突变来源的肺癌细胞系(Calu-6、A549、NCI-H1299、NCI-H23、NCI-H460、NCI-H2228、NCI-H157、NCI-H1792、NCI-H1975)的生长抑制作用,筛选出天佛参口服液的敏感肺癌细胞系为A549和NCI-H1299细胞。合理的细胞有丝分裂及增殖是生物生存的基础,而细胞周期失控导致细胞恶性增殖成为肿瘤,选取A549细胞进一步进行细胞周期和细胞凋亡检测,发现低浓度的天佛参口服液(0.03%)能够将A549细胞周期阻滞于G0/G1期,高浓度的天佛参口服液(0.06%~0.50%)可以阻滞其细胞周期于G2/M期,此外浓度超过0.1%的天佛参口服液可以明显诱导A549细胞出现晚期凋亡,提示天佛参口服液可能通过阻滞细胞周期和诱导细胞凋亡达到抗肺癌作用。
EGFR是一种具有酪氨酸酶活性的膜表面受体,在NSCLC中常发生突变,其突变后导致的酪氨酸激酶域过度激活是肺肿瘤发生的原因[11],EGFR也是目前NSCLC靶向治疗中最重要的靶点之一,EGFR能够介导细胞的生长和凋亡,其主要机制是通过EGFR配体本身同源二聚化或异源二聚化启动信号通路,从而引起机体内部的级联反应。Ras/Raf/MEK/ERK-MAPK通路为EGFR介导的下游信号通路中最重要且作用最广泛的通路[12],其主要涉及细胞的生长、增殖、分化、凋亡和转移等生物学过程[13]。当Ras激活时,细胞质膜大量分泌并活化下游分子Raf激酶,并激发了一系列蛋白激酶激活和磷酸化,磷酸化的Raf和活化MEK可进一步激活ERK,活化的ERK从Ras-Raf-MEK-ERK复合体上分离,并转移至细胞核内,在此发生磷酸化并激活细胞周期蛋白D1(Cyclin D1)、下调基因从而导致肿瘤细胞增殖,同时增强抗凋亡蛋白B淋巴细胞瘤2(B-cell lymphoma 2,Bcl-2)和髓细胞白血病-1(myeloid cell leukemia-1,Mcl-1)活性,减少肿瘤细胞的凋亡[14]。因此该通路的过度激活在NSCLC的发生、发展中发挥重要的作用[15]。Western blotting结果显示,天佛参口服液能够抑制EGFR活性,并下调其下游信号通路中Raf、MEK以及ERK蛋白的磷酸化水平,且处理细胞45 min时作用最强。由此推断天佛参口服液中的有效成分能够通过抑制EGFR活性,降低Ras/Raf/MEK/ERK信号通路中相关蛋白的磷酸化水平,诱导细胞周期阻滞和细胞凋亡,从而发挥抑瘤效果。
目前,裸鼠移植瘤模型已被广泛应用于抗肺癌、乳腺癌、前列腺癌、肝癌、胃癌和结肠癌等肿瘤药物的筛选中[16-19]。课题组前期在Lewis肺癌小鼠移植瘤模型上,发现天佛参口服液剂量在2.25~4.50 mL/kg时抑瘤效果较好,为了避免雌性小鼠性周期对造模和药效的影响,本研究采用雄性BALB/c裸鼠皮下接种A549细胞建立裸鼠移植瘤模型来评估天佛参口服液(2.25、4.50 mL/kg)对A549细胞的体内抗肿瘤活性,结果显示低剂量(2.25 mL/kg)的天佛参口服液能够抑制A549细胞移植瘤模型的肿瘤体内生长。
综上,体内外实验表明天佛参口服液对A549细胞具有抗肿瘤活性,可能通过诱导细胞周期阻滞和细胞凋亡来抑制A549细胞增殖,作用机制主要与抑制EGFR的活性、下调Ras/Raf/MEK/ERK信号通路表达有关。本研究为天佛参口服液临床用于抗肿瘤治疗或辅助治疗提供了理论基础。
利益冲突 所有作者均声明不存在利益冲突
[1] Chen W, Zheng R, Baade P D,. Cancer statistics in China, 2015 [J]., 2016, 66(2): 115-132.
[2] Siegel R L, Miller K D, Jemal A. Cancer statistics, 2018 [J]., 2018, 68(1): 7-30.
[3] Vijayvergia N, Mehra R. Clinical challenges in targeting anaplastic lymphoma kinase in advanced non-small cell lung cancer [J]., 2014, 74(3): 437-446.
[4] 于宏杰, 梁芳, 方萍, 等. 天佛参口服液联合化疗治疗气阴两虚非小细胞肺癌随机平行对照研究 [J]. 实用中医内科杂志, 2016, 30(6): 59-61.
[5] 张善兰, 姚红玉, 姜觉如, 等. 天佛参治疗气阴两虚型晚期非小细胞肺癌疗效观察 [J]. 现代肿瘤医学, 2017, 25(16): 2592-2594.
[6] 余敏, 田应选, 唐春卉, 等. 天佛参口服液治疗非小细胞肺癌气阴两虚证的临床研究 [J]. 中国肿瘤临床与康复, 2018, 25(3): 257-261.
[7] 刘畅, 李枫, 王莉, 等. 天佛参口服液联合GP方案治疗老年晚期非小细胞肺癌的近期疗效观察 [J]. 癌症进展, 2017, 15(3): 294-296.
[8] 李新民, 党琦. 天佛参口服液(TFS)诱导人喉癌细胞Hep-2凋亡及机理探讨[J]. 中国中西医肿瘤杂志, 2011, 1(1): 11-15.
[9] 杜秀平, 李新民, 杨峰. 天佛参口服液对体外人癌细胞抑制效应及其对细胞动力学影响的实验研究 [J]. 癌症, 1991, 10(3): 190-192.
[10] 孔平孝, 陈光伟, 王希胜, 等. 天佛参口服液治疗中晚期恶性肿瘤的临床与实验研究 [J]. 中国中西医结合杂志, 2001, 21(6): 427-430.
[11] 张锦锦, 唐慧. 表皮生长因子受体在肿瘤发生、发展中的研究进展 [J]. 中国生物制品学杂志, 2018, 31(4): 425-430.
[12] 传锋彬, 王雯, 王立宏. EGFR介导的信号通路影响肺癌细胞增殖与转移的机制 [J]. 实用癌症杂志, 2020, 35(9): 1429-1432.
[13] Degirmenci U, Wang M, Hu J C. Targeting aberrant RAS/RAF/MEK/ERK signaling for cancer therapy [J]., 2020, 9(1): E198.
[14] 陈子, 王莹. MEK抑制剂治疗非小细胞肺癌的研究进展 [J]. 国际呼吸杂志, 2014, 34(4): 269-273.
[15] 王瑞娟. 非小细胞肺癌EGFR信号通路相关microRNAs的表达及意义 [D]. 北京: 解放军总医院, 2016.
[16] Walsh N C, Kenney L L, Jangalwe S,. Humanized mouse models of clinical disease [J]., 2017, 12: 187-215.
[17] Duan Z G, Wei B, Deng J J,. The anti-tumor effect of ginsenoside Rh4 in MCF-7 breast cancer cellsand[J]., 2018, 499(3): 482-487.
[18] Wu Y W, Hsu K C, Lee H Y,. A novel dual HDAC6 and tubulin inhibitor, MPT0B451, displays anti-tumor ability in human cancer cellsand[J]., 2018, 9: 205.
[19] 张惠兰, 张珍祥, 徐永健. 环格列酮抑制人肺癌A549细胞增殖活性的实验研究 [J]. 中华肿瘤杂志, 2004, 26(9): 531-534.
Effect and mechanism of Tianfoshen Oral Liquid on proliferation of A549 cellsand
ZHANG Dan-dan, ZHAI Yun-liang, JI Fang, ZHANG Ya-yun, XIA Yang, LI Quan, WANG Heng-bin
Lei Yun Shang Pharmaceutical Group Co., Ltd., Suzhou 215009, China
To investigate the effect and related mechanism of Tianfoshen Oral Liquid (天佛参口服液) on cell proliferation in A549 cells and lung cancer mice transplantable tumor in model animals.Cell Titer-Glo assay was used to detect the inhibitory effect of Tianfoshen Oral Liquid on proliferation of nine different gene mutation phenotypes of lung cancer cell lines; Flow cytometry was applied to determine the effect of Tianfoshen Oral Liquid on cell cycle and apoptosis of A549 cells; Western blotting was used to explore the effect of Tianfoshen Oral Liquid on expression of proliferation-related proteins in A549 cells. Nude mice were sc A549 cells to establish nude mice xenograft tumor model, the effect of Tianfoshen Oral Liquid on growth of subcutaneous xenograft tumors in mice was investigated.Tianfoshen Oral Liquid inhibited the proliferation of A549 cells, with dose-dependent; Tianfoshen Oral Liquid blocked the A549 cell cycle in G0/G1and G2/M phases (< 0.05, 0.01), and 1% Tianfoshen Oral Liquid significantly induced apoptosis of A549 cells (< 0.01); Tianfoshen Oral Liquid significantly inhibited epidermal growth factor receptor (EGFR), Raf, mitogen extracellular signal-regulated kinase (MEK) and extracellular regulated protein kinase (ERK) protein phosphorylation levels (< 0.05, 0.01), showing a dose-dependent. The results ofexperiments showed that 2.25 mL/kg Tianfoshen Oral Liquid had a significant inhibitory effect on tumor growth in nude mice transplanted tumor models (< 0.05).Tianfoshen Oral Liquid has a significant inhibitory effect on growth of A549 cellsand, and its mechanism may be related to the inhibition of EGFR activity and down-regulation of Ras/Raf/MEK/ERK signal pathway expression.
Tianfoshen Oral Liquid; lung cancer; A549 cells; proliferation; nude-mice transplanted tumor model; anti-cancer
R285.5
A
0253 - 2670(2021)21 - 6568 - 08
10.7501/j.issn.0253-2670.2021.21.015
2021-04-14
张丹丹(1988—),女,博士,主要从事中药药理毒理基础研究。E-mail: zhangdandan@lys.cn
王恒斌(1972—),男,高级工程师,主要从事中药新药开发及上市后研究。E-mail: wanghengbin@lys.cn
#共同第一作者:翟云良(1988—),男,硕士,主要从事中药药理及临床研究。E-mail: zhaiyunliang@lys.cn
[责任编辑 李亚楠]
