多花黄精多糖对斑马鱼2型糖尿病合并骨质疏松症模型的药效学研究
2021-11-08曹语珈王子丽边金焕安礼友许舒雯龚祝南
曹语珈,王 凯,王子丽,边金焕,安礼友,许舒雯,龚祝南, *
多花黄精多糖对斑马鱼2型糖尿病合并骨质疏松症模型的药效学研究
曹语珈1,王 凯2#,王子丽1,边金焕3,安礼友3,许舒雯2*,龚祝南1, 3*
1. 南京师范大学食品与制药工程学院,江苏 南京 210046 2. 安徽省科学技术研究院,安徽 合肥 230031 3. 南京师范大学生命科学学院,江苏 南京 210046
研究多花黄精多糖对斑马鱼幼鱼2型糖尿病合并骨质疏松症的作用。用链脲佐菌素和泼尼松龙建立斑马鱼幼鱼2型糖尿病合并骨质疏松症模型,设置对照组、模型组、二甲双胍+依替膦酸二钠组和多花黄精多糖(60、120、240 μg/mL)组,考察药物对斑马鱼早期发育毒性的影响;采用试剂盒测定各组幼鱼组织的糖含量;采用茜素红染色法考察各组斑马鱼头骨矿化面积和骨密度;采用qRT-PCR法检测各组斑马鱼骨质疏松相关基因Runx家族转录因子2b(Runx family transcription factor 2b,)、Sp7转录因子(Sp7 transcription factor,)、I型胶原蛋白α2(collagen type I α2,)、富含半胱氨酸的酸性分泌蛋白质因子(cysteine-rich acidic secreted protein,)和维生素D受体b(vitamin D receptor b,)mRNA表达情况。显微注射链脲佐菌素和浸泡泼尼松龙能够提高幼鱼组织糖浓度,降低头骨矿化面积和骨密度。与模型组比较,多花黄精多糖显著上调斑马鱼幼鱼2型糖尿病合并骨质疏松症模型、、、、mRNA表达水平(<0.05、0.01、0.001)。多花黄精多糖对斑马鱼幼鱼2型糖尿病合并骨质疏松症模型有较好的降血糖及抗骨质疏松症作用。
斑马鱼;多花黄精;多糖;糖尿病;骨质疏松
糖尿病是一种以高血糖为特征的代谢紊乱性疾病[1],高血糖可增加晚期糖基化终端产物的蓄积,抑制成骨细胞的形成,激活破骨细胞,成骨细胞和破骨细胞的平衡被打破,影响骨的正常形成,从而导致骨质疏松的发生,因此2型糖尿病患者很容易产生骨质疏松这一并发症[2-3]。现代医学采用降糖、促进骨生成、抗氧化等常规治疗,均存在不足与局限,而中药治疗具有显著的潜力和优势,正逐渐被接受和使用。黄精系药食同源的多年生草本植物,具有补气养阴、健脾、润肺、益肾之效[4]。现代药理学研究表明,黄精的主要成分黄精多糖具有降血糖、调血脂、抗肿瘤、抑菌、抗炎、抗病毒、增强免疫等作用[5]。多花黄精Hua属天门冬科黄精属植物,与滇黄精、黄精一同收录于《中国药典》2020年版[6]。目前,多花黄精多糖的降血糖合并骨质疏松症研究鲜有报道。
本研究通过分析多花黄精多糖对2型糖尿病合并骨质疏松症斑马鱼幼鱼模型的组织糖含量、骨骼矿化面积、积累光密度[7]和骨代谢相关因子表达等影响,来评价多花黄精多糖对糖尿病合并骨质疏松的作用,以期为后续研究提供参考。
1 材料
1.1 动物
AB系野生型斑马鱼购自上海费曦生物科技有限公司。
1.2 药材
黄精于2016年7月采自安徽省青阳县九华山地区,经南京师范大学生命科学院龚祝南教授鉴定为天门冬科植物多花黄精Hua的根茎。
1.3 药品与试剂
多花黄精多糖(批号20191113)由安徽省科学技术研究院提供;Runx家族转录因子2b(Runx family transcription factor 2b,)、Sp7转录因子(Sp7 transcription factor,)、I型胶原蛋白α2(collagen type I α2,)、富含半胱氨酸的酸性分泌蛋白质因子(cysteine-rich acidic secreted protein,)、维生素D受体b(vitamin D receptor b,)、引物由生工生物工程(上海)股份有限公司合成;链脲佐菌素(批号20191022)购自广州赛国生物科技有限公司;泼尼松龙(批号c10788051)、盐酸二甲双胍(批号c10440628)购自上海麦克林生化科技有限公司;依替膦酸二钠(批号20191015)购自中国药品生物制品检定所;茜素红S(批号20191203)、柠檬酸(批号20190409)购自国药集团化学试剂有限公司;柠檬酸钠(批号190311-1)购自西陇科学股份有限公司;QuantiChrom™ Glucose Assay Kit葡萄糖测试盒购自北京群晓科苑生物技术有限公司。
1.4 仪器
恒温光照培养箱(宁波东南仪器有限公司);IM-9B型手动斑马鱼显微注射泵(日本Narishige公司);qRT-PCR仪(瑞士Roche公司);EVOS新型显微镜细胞成像系统(美国Life Technologies公司)。
2 方法
2.1 多花黄精多糖的制备
多花黄精经洗净烘干,切片,粉粹成60目,备用。取0.5 kg多花黄精粉末加入5倍量水,85 ℃水浴回流提取2次,2 h/次,滤过,取滤液,恒温水浴浓缩至一定体积,滤过除渣。所得滤液加3倍量100%乙醇,于4 ℃放置24 h,抽滤后减压干燥得沉淀,冷冻干燥所得粉末即为黄精粗多糖。由安徽省科学技术研究院提取并检测,采用苯酚硫酸法测定多花黄精粗多糖的质量分数为63.7%[8]。
2.2 实验培养液及药液的制备
2.2.1 10×E3斑马鱼胚胎培养液的制备 称取NaCl 1 462.5 mg、KCl 63.325 mg、CaCl2242.583 mg、MgSO4198 mg,加入适量单蒸水溶解,超声20 min,待全部溶解后移入500 mL量瓶中,定容,于4 ℃保存备用,后续用单蒸水稀释10倍使用。
2.2.2 500 μg/mL链脲佐菌素母液的制备 称取0.015 g链脲佐菌素粉末,加入适量纯净水溶解,超声5 min,保存备用。
2.2.3 1 mg/mL盐酸二甲双胍母液的制备 称取0.025 g盐酸二甲双胍粉末,加入适量纯净水溶解,超声5 min,保存备用。
2.2.4 120 μg/mL泼尼松龙母液的制备 称取2.6 mg泼尼松龙粉末,滴加微量二甲基亚砜(DMSO)使其溶解后,再加入适量纯净水,磁力搅拌器搅拌3 min,保存备用。
2.2.5 180 μg/mL依替膦酸二钠母液的制备 称取6.3 mg依替膦酸二钠固体,加入适量纯净水溶解,超声5 min,保存备用。
2.2.6 480 μg/mL多花黄精多糖母液的制备 称取16.8 mg多花黄精多糖粉末,加入适量纯净水溶解,超声10 min,保存备用。
2.3 药物对斑马鱼早期发育毒性的影响
挑选受精后第2天(2 dpf)的斑马鱼胚胎,置24孔板,每孔6个胚胎,设置对照组、链脲佐菌素(50、100、200、300、400、500 μg/mL)、泼尼松龙(5、10、20、40、80、120 μg/mL)、二甲双胍(50、100、200、400、800、1000 μg/mL)、依替膦酸二钠(30、60、90、120、150、180 μg/mL)和多花黄精多糖(80、160、240、320、400、480 μg/mL)组,设置3个平行复孔,于28 ℃恒温培养箱中培养。每3天换1次液,给药周期为8 d,每8小时观察幼鱼的状态,发现死亡的鱼卵或幼鱼及时挑出,4 dpf通过EVOS新型显微镜细胞成像系统观察斑马鱼给药后的形态变化,计算胚胎孵化率和死亡率,绘制最佳“死亡率-浓度”效应曲线,用GraphPad Prisr 6.0软件拟合得出半数致死浓度(half lethal concentration,LC50)值[9]。
胚胎孵化率=孵化的胚胎数量/总胚胎数量
胚胎死亡率=死亡胚胎数量/总胚胎数量
2.4 斑马鱼幼鱼2型糖尿病合并骨质疏松症模型的建立和给药
选择2 dpf的斑马鱼胚胎放置在琼脂糖鱼卵固定板上,采用显微注射方式在卵黄囊部位注射2 nL链脲佐菌素(200 μg/mL),注射完成的胚胎立即放回E3培养液,以免停留时间过久导致胚胎死亡,影响死亡率。注射后每8小时观察,移除脱下的卵黄膜,4 dpf后转移到24孔板中(6尾/孔)并采用直接浸泡泼尼松龙(10 μg/mL)方式造模。置24孔板,6尾/孔,设置对照组、模型组、二甲双胍(150 μg/mL)+依替膦酸二钠(30 μg/mL)组和多花黄精多糖(60、120、240 μg/mL)组,每组90~100尾。培养周期为4 d,隔2 d换新液体,直至8 dpf。
2.5 幼鱼组织的糖含量测定
由于无法在幼鱼身上获得血液样本,因此测定整个鱼体匀浆中的糖含量。给药后4 dpf和8 dpf的斑马鱼幼鱼每组各取30尾,加入200 μL冰PBS溶液充分研磨,4 ℃、12 000 r/min离心10 min,采用QuantiChrom™ Glucose Assay Kit葡萄糖测试盒进行测定。
2.6 斑马鱼矿化骨骼定量分析
取培养至8 dpf的斑马鱼幼鱼置于培养皿中,加入4%多聚甲醛,4 ℃固定过夜;用磷酸盐吐温缓冲液(PBST)洗3遍,用0.5% KOH和3% H2O2的漂白剂脱色30 min至斑马鱼无黑色素,去除漂白剂后,加入4%多聚甲醛,4 ℃固定过夜;PBST清洗3次,甲醇梯度洗脱,置换20% DMSO-80%甲醇,于−20 ℃保存;4 h后复水和染色,用PBST洗3遍,于0.5% KOH配制的茜素红染液中染色过夜,室温避光孵育12 h以上,去除染色液,用PBST洗3遍,再更换为80%甘油,避光保存,于显微镜下拍照,采用Image pro plus 6.0软件分析头部骨骼染色面积和骨密度。
2.7 qRT-PCR检测骨质疏松相关基因mRNA表达
从对照组、模型组、二甲双胍+依替膦酸二钠组和多花黄精多糖(60、120、240 μg/mL)组选取25尾8 dpf斑马鱼幼鱼,按照试剂盒说明书提取斑马鱼组织总RNA并合成cDNA,进行qRT-PCR分析。引物序列见表1。
2.8 统计学分析

表1 引物序列
3 结果
3.1 斑马鱼早期发育死亡率和孵化率
选取2 dpf斑马鱼胚胎给药,培养7 d得出链脲佐菌素、泼尼松龙、二甲双胍、依替膦酸二钠和多花黄精多糖对斑马鱼幼鱼的LC50(表2)。从图1可以看出,480 μg/mL多花黄精多糖给药后斑马幼鱼很快死亡,320 μg/mL多花黄精多糖给药5 d后斑马鱼出现明显死亡且死亡率较低,并且在6 dpf之后死亡率保持不变;斑马鱼孵化率在3~4 dpf时保持不变。

表2 各药物对斑马鱼幼鱼的LC50值 (6 dpf)

图1 多花黄精多糖对斑马鱼死亡率和孵化率的影响
3.2 多花黄精多糖对斑马鱼幼鱼形态和心脏毒性的影响
4 dpf斑马鱼鱼卵已经发育成熟,幼鱼将从绒毛膜中孵化出,同时心脏已经发育[10],因此选择4 dpf时间点进行毒性暴露和心脏毒性分析。图2清晰地展示了不同质量浓度多花黄精多糖给药后斑马鱼幼鱼形态和心脏组织形态变化。发育异常的斑马鱼的腹部或腹部周围会发生水肿或出血现象,造成身体畸形包括脊柱弯曲和折尾等,同时斑马鱼幼鱼心脏组织形态发生异常,心包囊肿等症状逐渐加重。从图中可以看出,与对照组比较,多花黄精多糖(160 μg/mL)组斑马鱼出现轻微腹部水肿和心脏毒性,400 μg/mL多花黄精多糖组斑马鱼水肿和心包囊肿明显,呈剂量相关性。结合LC50值,后续实验多花黄精多糖给药质量浓度为60~240 μg/mL,避免影响斑马鱼幼鱼发育异常和死亡。
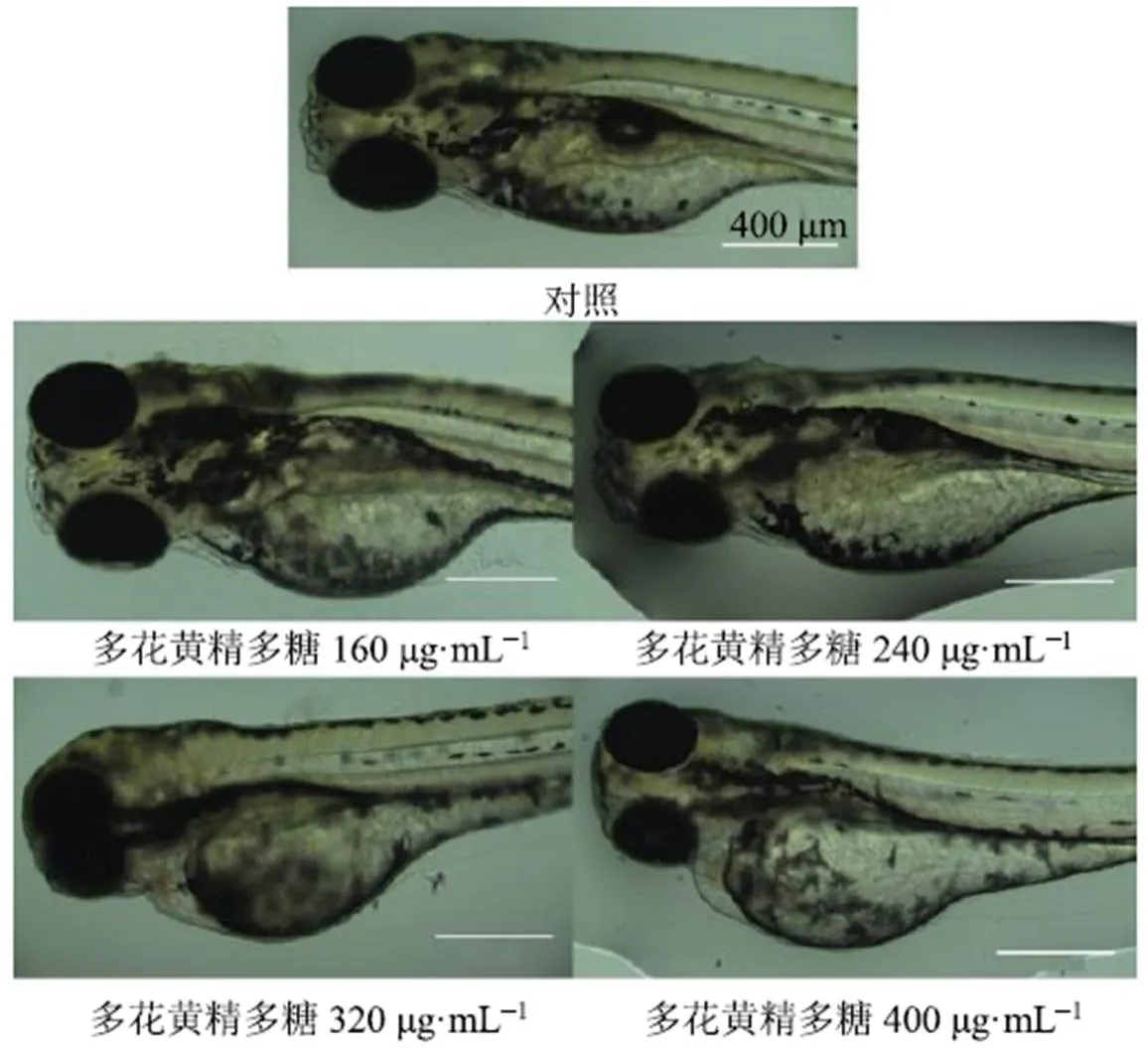
图2 多花黄精多糖对斑马鱼幼鱼形态和心脏毒性的影响(×10)
3.3 多花黄精多糖对幼鱼组织糖含量的影响
使用QuantiChrom™ Glucose Assay Kit葡萄糖测试盒检测组织糖含量。在0~300 mg/dL内,斑马鱼幼鱼组织糖含量与吸光度呈现良好的线性关系,得到的标准曲线回归方程:=0.000 9+0.001,=0.999 9;其中,是葡萄糖测试盒中对照品溶液的质量浓度,是吸光度。
当模型组斑马鱼的血糖水平高于对照组3倍时,可认为糖尿病斑马鱼造模成功[11-12]。如图3所示,2 dpf斑马鱼胚胎注射链脲佐菌素后,4 dpf模型组斑马鱼幼鱼的组织糖含量为3.457 nmol/尾,明显高于对照组的1.063 nmol/尾,为对照组的3.25倍。泼尼松龙浸泡给药后8 dpf模型组糖含量为3.068 nmol/尾,为对照组的2.88倍,表明给予泼尼松龙后,斑马鱼幼鱼达到2型糖尿病的检测标准,因此斑马鱼幼鱼2型糖尿病模型构建成功。

图3 多花黄精多糖对幼鱼组织糖含量的影响(, n = 3)
与模型组比较,二甲双胍+依替膦酸二钠组和多花黄精多糖(60、120、240 μg/mL)组斑马鱼组织糖含量有降低的趋势,且呈剂量相关性。由于高剂量多花黄精多糖对幼鱼会有形态和心脏毒性,未能进一步加大给药浓度充分验证其降糖作用。
3.4 斑马鱼矿化骨骼定量分析
各组8 dpf斑马鱼腹面头骨茜素红染色的显微成像见图4,斑马鱼头骨矿化面积和骨密度见图5。与对照组相比,模型组斑马鱼头骨矿化面积和骨密度显著降低(<0.01、0.001),表明链脲佐菌素+泼尼松龙成功诱导了糖尿病斑马鱼骨质疏松模型。与模型组比较,多花黄精多糖组斑马鱼头骨矿化面积和骨密度显著升高(<0.05、0.01),且呈剂量相关性。
3.5 qRT-PCR检测成骨细胞基因mRNA表达
如图6所示,与对照组比较,模型组斑马鱼、、、、mRNA表达水平均显著降低(<0.05、0.001);与模型组比较,多花黄精多糖组、、、、mRNA表达水平均显著升高(<0.05、0.01、0.001),且呈剂量相关性。
4 讨论
2型糖尿病患者的血糖比正常人偏高[13],一方面由于外周血管粥样硬化使血供明显减少,易出现肢体坏疽,运动负荷减小,严重影响骨质量;另一方面糖尿病微血管病变[14],造成骨组织的血液不能正常供应,血液内营养障碍,影响骨质量和骨密度,这些都会使骨质疏松发生的风险随之增加。降糖药物主要影响2型糖尿病患者血糖水平,但对机体除血糖外的其他指标也有一定影响。自从研究人员发现噻唑烷二酮类降糖药物[15]有增加骨折的风险后,就广泛开展了大量关于降糖药物和骨代谢及骨密度的临床试验和动物实验。多项研究显示,各类降糖药物在稳定血糖的同时也对骨代谢造成影响,因此预防糖尿病慢性并发症的发生和发展,改善骨代谢对患者有重要作用[16]。

图4 骨骼染色的显微成像 (×10)

与对照组比较:#P<0.05 ##P<0.01 ###P<0.001;与模型组比较:*P<0.05 **P<0.01 ***P<0.001,图6同

图6 多花黄精多糖对斑马鱼Runx2b、Sp7、vdrb、sparc、col1a2 mRNA表达的影响(, n = 3)
本研究利用斑马鱼体型小、易饲养、繁殖周期短等其他模式生物不具备的优点[17-18]建立2型糖尿病合并骨质疏松症斑马鱼幼鱼模型。通过加入不同浓度的药物观察并统计对斑马鱼生长发育的影响,选择给予链脲佐菌素(200 μg/mL)和泼尼松龙(10 μg/mL)进行造模,通过试剂盒测定斑马鱼组织糖含量后,采用茜素红对斑马鱼矿化骨骼进行固定染色,分析骨矿化面积和骨密度。结果表明,给予链脲佐菌素和泼尼松龙后能够建立2型糖尿病合并骨质疏松症斑马鱼幼鱼模型。
黄精是中医临床常用的治疗消渴症较为有效的中药。黄精多糖是黄精的主要有效成分,黄精可入肾经,中医理论认为肾主骨生髓,因此黄精多糖具有应用于治疗骨代谢相关疾病的潜在作用[19]。本研究利用2型糖尿病合并骨质疏松症斑马鱼幼鱼模型研究多花黄精多糖降血糖和抗骨质疏松作用,通过qRT-PCR法检测多花黄精多糖对2型糖尿病合并骨质疏松症斑马鱼模型成骨细胞标志基因、、、、mRNA表达的影响,结果显示,与模型组比较,多花黄精多糖可以通过上调和mRNA表达,调控成骨细胞分化过程中转录级联反应,共同加速成骨细胞分化;而vdrb这种维生素D受体转录因子,能调节体内钙或磷酸盐的吸收,多花黄精多糖能够上调和mRNA表达,有助于皮肤、骨骼、肌腱以及其他纤维连接组织。sparc不仅在骨骼组织中引起活跃的矿化作用,还能够促进与游离的钙离子结合。因此,多花黄精多糖能够不同程度地降低2型糖尿病合并骨质疏松症斑马鱼组织糖浓度,上调成骨细胞相关因子表达,促进成骨细胞分化,恢复维持骨骼矿化,加快骨重建。
利益冲突 所有作者均声明不存在利益冲突
[1] 宋超, 刘祖德. 2型糖尿病并发骨质疏松的机制研究进展 [J]. 中国骨质疏松杂志, 2010, 16(2): 139-142.
[2] Liu J M, Zhu D L, Mu Y M,. Management of fracture risk in patients with diabetes-Chinese expert consensus [J]., 2019, 11(11): 906-919.
[3] Evely R S, Bonomo A, Schneider H G,. Structural requirements for the action of parathyroid hormone- related protein (PTHrP) on bone resorption by isolated osteoclasts [J]., 1991, 6(1): 85-93.
[4] 陈晔, 孙晓生. 黄精的药理研究进展 [J]. 中药新药与临床药理, 2010, 21(3): 328-330.
[5] 陆建平, 张静, 张艳贞. 黄精多糖的功能活性及应用前景 [J]. 食品安全质量检测学报, 2013, 4(1): 273-278.
[6] 中国药典[S]. 一部. 2020: 319-320.
[7] 陈颖. 抗骨接生软膏药学研究及斑马鱼评价 [D]. 南京: 南京中医药大学, 2017.
[8] 肖小妹, 沈小雄, 张桂生, 等. 黄精多糖对儿童肾病综合征红细胞免疫功能影响的研究 [J]. 赣南医学院学报, 2018, 38(2): 134-136.
[9] 鲁疆, 王占洋, 袁玉婷, 等. 氯化镉对斑马鱼胚胎的发育毒性 [J]. 生态毒理学报, 2013, 8(3): 381-388.
[10] Kari G, Rodeck U, Dicker A P. Zebrafish: An emerging model system for human disease and drug discovery [J]., 2007, 82(1): 70-80.
[11] 朱妍, 秦卫松. 糖尿病斑马鱼模型研究进展 [J]. 肾脏病与透析肾移植杂志, 2021, 30(1): 59-63.
[12] 劳乔聪, 俞航萍, 李春启. 斑马鱼糖尿病模型评价常用降糖药物降糖药效[J]. 中国药理学通报, 2015(31): 248.
[13] Alberti K G, Zimmet P Z. Definition, diagnosis and classification of diabetes mellitus and its complications. Part 1: Diagnosis and classification of diabetes mellitus provisional report of a WHO consultation [J]., 1998, 15(7): 539-553.
[14] Colman J R, Twiner M J, Hess P,. Teratogenic effects of azaspiracid-1 identified by microinjection of Japanese medaka () embryos [J]., 2005, 45(7): 881-890.
[15] 马长宏, 张翼翔. 噻唑烷二酮类药物治疗2型糖尿病的效果 [J]. 中国实用医药, 2009, 4(19): 248-250.
[16] 庄会艳. 噻唑烷二酮类药物的药理作用研究 [J]. 医学食疗与健康, 2019(17): 88.
[17] Dooley K, Zon L I. Zebrafish: A model system for the study of human disease [J]., 2000, 10(3): 252-256.
[18] 段秀英, 马瑞娇, 张云, 等.斑马鱼炎症模型及其在中药抗炎领域的应用[J]. 药物评价研究, 2021, 44(8): 1573-1580.
[19] 姜程曦, 张铁军, 陈常青, 等. 黄精的研究进展及其质量标志物的预测分析 [J]. 中草药, 2017, 48(1): 1-16.
Pharmacodynamics study of polysaccharide fromon zebrafish model with type 2 diabetic and osteoporosis
CAO Yu-jia1, WANG Kai2, WANG Zi-li1, BIAN Jin-huan3, AN Li-you3, XU Shu-wen2, GONG Zhu-nan1,3
1. School of Food and Pharmaceutical Engineering, Nanjing Normal University, Nanjing 210046, China 2. Anhui Academy of Science and Technology, Hefei 230031, China 3. School of Life Sciences, Nanjing Normal University, Nanjing 210046, China
To study the effect of polysaccharide from(PSP) on type 2 diabetes and osteoporosis in juvenile zebrafish.A zebrafish juvenile type 2 diabetes model with osteoporosis was established with streptozotocin and prednisolone, which were divided into control group, model group, metformin + etidronate disodium group and PSP (60, 120, 240 μg/mL) groups, the effect of drugs on early developmental toxicity of zebrafish was investigated; Kit was used to determine the sugar content of juvenile fish tissues in each group; Alizarin red staining method was used to investigate the mineralized area and bone mineral density in bones of zebrafish in each group; qRT-PCR was used to detect osteoporosis-related genes Runx family transcription factor 2b (), Sp7 transcription factor (), type I collagen α2 (), cysteine-rich acidic secreted protein () and vitamin D receptor b () mRNA expressions in zebrafish.Microinjection of streptozotocin and immersion of prednisolone increased the sugar concentration of juvenile fish tissues, reduced the mineralized area and bone density of skull. Compared with model group, PSP significantly up-regulated mRNA expression levels of,,,andin zebrafish juvenile type 2 diabetes mellitus with osteoporosis model (< 0.05, 0.01, 0.001).PSP has a good hypoglycemic and anti-osteoporosis effect on zebrafish juvenile with type 2 diabetes and osteoporosis.
zebrafish;Hua; polysaccharide; type 2 diabetes; osteoporosis
R285.5
A
0253 - 2670(2021)21 - 6545 - 07
10.7501/j.issn.0253-2670.2021.21.012
2021-04-13
安徽省博士后研究人员科研活动经费资助项目(2020A396);安徽省2020年度中央引导地方科技发展专项项目(202007d06020007)
曹语珈(1997—),女,硕士研究生,研究方向为药理学。Tel: 13814780060 E-mail: caoyujiaguodong@hotmail.com
许舒雯,研究员。E-mail: shuwne_xu@163.com
龚祝南,教授,硕士生导师。E-mail: gongzhunan@njnu.edu.cn
#共同第一作者:王 凯(1987—),男,硕士,助理研究员,研究方向为数据分析、科研管理。Tel: 17730201081 E-mail: woyun_2002@163.com
[责任编辑 李亚楠]
