艾灸调节肉瘤微环境中Th1/Th2漂移的作用*
2021-11-08李丽君廖群好骆敏翔何丽娇赵昌林
李丽君,廖群好,骆敏翔,何丽娇,王 坤,赵昌林△
(1.广东祈福医院,广东 广州 511495;2.广东药科大学,广东 广州 510006)
软组织肉瘤是少见的间叶组织恶性肿瘤,在初诊时14.5%~26.5%的患者就已经远处转移,40%~50%的局限性病灶会出现远处转移,肉瘤的低发病率和多样性亚型限制了开展大规模、特异性的临床研究[1-2]。目前,化疗仍然是晚期软组织肉瘤治疗的标准,其他治疗方法效果仍不确定[3]。艾灸是利用艾叶产生的热量作用于特定穴位或部位,通过刺激经络来调节内脏器官的功能,达到治疗疾病的目的[4]。艾灸常用于恶性肿瘤的姑息治疗[5-7]。
辅助T淋巴细胞主要分为Th1、Th2、Th17和Treg共4个类型。Th1细胞分泌白介素-2(IL-2)、干扰素-γ(IFN-γ)等细胞因子,调节细胞免疫,在抗肿瘤中起重要作用。Th2细胞分泌IL-4、IL-10等细胞因子,介导体液免疫,促进抗体产生。正常情况下,Th1和Th2细胞亚群维持相对稳定,维持免疫平衡[8]。当恶性肿瘤形成时,Th1和Th2细胞亚群平衡紊乱,Th1/Th2平衡左漂移,抑制机体的抗肿瘤免疫[9-10]。如果纠正Th1向Th2漂移,则具有抗肿瘤的作用。本项研究以S180肉瘤移植瘤为模型,研究热敏艾灸对肉瘤微环境中Th1/Th2平衡的调节作用。
1 材料与方法
1.1 动物
C57BL/6J小鼠,SPF级,35~42 d,雌雄各40只;昆明小鼠,SPF级,16~18 g,28~30 d,雌雄各10只,均购自广东省医学实验动物中心[生产许可证号:SCXK(粤)2013-0034]。实验小鼠适应性喂养1周,室温(24±2)℃,相对湿度50%~70%,实验过程遵守科技部颁发的《关于善待实验动物的指导性意见》的规定。S180肉瘤细胞株购自广东省医学实验动物中心。本实验经广东药科大学实验动物伦理委员会批准。
1.2 试剂与仪器
1.2.1 主要试剂 热敏艾条(南阳绿莹艾草生物制品有限公司);顺铂(山东齐鲁制药公司);BSA、蛋白酶K和DAPI(武汉Servicebio公司);anti-DIG-HRP(美国Jackson公司);Mouse Premixed Multi-Analyte Kit(美国Luminex公司,LXSAMSM-7);CD4(PE-CY7-A)、IFN(PE-A)和IL-4(APC-A)购自(美国eBioscience公司)。
1.2.2 主要仪器 悬液微珠芯片平台Luminex® 200TM(美国Luminex公司);正置荧光显微镜(日本尼康,Nikon Eclipse ci);成像系统(日本尼康,Nikon DS-U3);流式细胞仪(美国BD公司,FACS Aria);原位杂交用载玻片、涡旋混匀(武汉Servicebio公司);包埋机(武汉俊杰电子有限公司)。
1.3 分组与模型制备
C57BL/6J小鼠按照完全随机法分为空白组、模型组、顺铂组和艾灸组,雌雄各半,每组10只。复苏S180肉瘤细胞株,接种于昆明小鼠腹腔形成腹水,取腹水离心,调整细胞浓度1×107/mL,取0.1 mL接种于C57BL/6J小鼠胸部皮下,形成移植瘤。在接种4 d后,局部可见突起,触摸为硬结节,病理检查证实移植瘤,作为造模成功的标准。
1.4 干预方法
1.4.1 艾灸组 接种第6天开始给以艾灸治疗,以移植瘤为治疗穴位,使用热敏艾条直接灸移植瘤,距离3 cm,每次艾灸10 min,每日1次,连续干预14 d为一疗程。
1.4.2 模型组 接种S180细胞形成移植瘤,不进行干预。
1.4.3 顺铂组 按照小鼠体重4 μg/g给药,在接种第6天开始给予腹腔注射,共3次为一疗程。
1.5 检测指标及方法
治疗1个疗程后处死小鼠,取血清进行细胞因子检测,测量移植瘤的重量,通过流式细胞检测分析脾淋巴细胞的Th1和Th2细胞亚群,移植瘤进行病理分析,Fish检测Th1和Th2的基因表达。
1.5.1 细胞因子检测 样品孵育,取微珠在振荡器上振荡30 s,超声30 s,使用Assay Diluent RD1W 稀释微珠;取50 μL标准品与 Background加入96孔板中。取25 μL样品加入96孔板中,并加入25 μL Calibrator Diluent RD6-52稀释样品。避光,室温孵育120 min。孵育检测抗体,每孔加入50 μL Detection Antibody,室温避光孵育60 min。弃去检测抗体,洗涤3次。每孔加入50 μL Streptavidin-PE,室温避光孵育30 min。每孔加入100 μL Wash Buffer重悬,放置在平板摇床上850 rpm,室温避光振荡2 min,送入Luminex®200TM机器中读值。
1.5.2 流式细胞检测 脾剪碎,分离淋巴细胞。加红细胞裂解液约2 mL,裂解2 min。取30 mL淋巴细胞分离液,将裂解后的悬浮细胞缓慢加在淋巴细胞分离液上,离心。取中间层淋巴细胞离心15 min。每个样本分别加CD4 PE-CY7-A 1.25 μL、IFN PE-A 1.25 μL和IL-4 APC-A 2.5 μL。检测对照组加CD90-FITC,室温避光孵育30 min。上机检测。
1.5.3 Fish检测 移植瘤组织固定,脱水,切片,石蜡切片脱蜡至水。消化,预杂交:滴加预杂交液,37℃孵育1 h。杂交:滴加含探针杂交液,浓度 6 ng/μL,恒温箱37℃杂交过夜。滴加封闭血清BSA。滴加鼠抗地高辛标记过氧化物酶(anti-DIG-HRP)。滴加CY3-TSA试剂,避光室温反应5 min。DAPI复染核,镜检拍照。探针:TH1-m probe:5′-DIG-TCTCC GGCGG CGTTG GCCTG GTCTC ACT-DIG-3′。Th2-m probe:5′-DIG-TCGGC GAAGG CGCTG TTGAT GCTCT G-DIG-3′。Fish结果判定:计算100个肿瘤细胞数,查看阳性表达率。
1.6 统计学处理
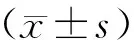
2 结果
2.1 各组S180肉瘤移植瘤比较
各组HE染色分析,细胞呈暗色嗜酸性染色,胞浆和染色细胞核紧密相连,证实为S180肉瘤,见图1。 结果表明,艾灸组移植瘤的重量低于模型组,与顺铂组比较无统计学意义,模型组的均数为(2.45±0.23)g,艾灸组为(1.54±0.18)g,顺铂组为(1.97±0.20)g。艾灸组与模型组比较,差异具有统计学意义(P<0.01),艾灸组与顺铂组比较,差异无统计学意义(P>0.05)。见图2。

图1 S180肉瘤移植瘤HE染色
注:与模型组比较,#P<0.01。图2 各组移植瘤重量比较(n=10)
2.2 各组血清IL-2、IFN-γ、IL-10和IL-4的浓度
Th1分泌IL-2、IFN-γ,Th2分泌IL-4和IL-10等细胞因子,艾灸组可提高血清IL-2和IFN-γ的浓度,降低IL-10和IL-4的浓度。见表1。

表1 各组血清IL-2、IFN-γ、IL-10和IL-4浓度比较
2.3 各组脾淋巴细胞中Th1和Th2细胞的数量比较
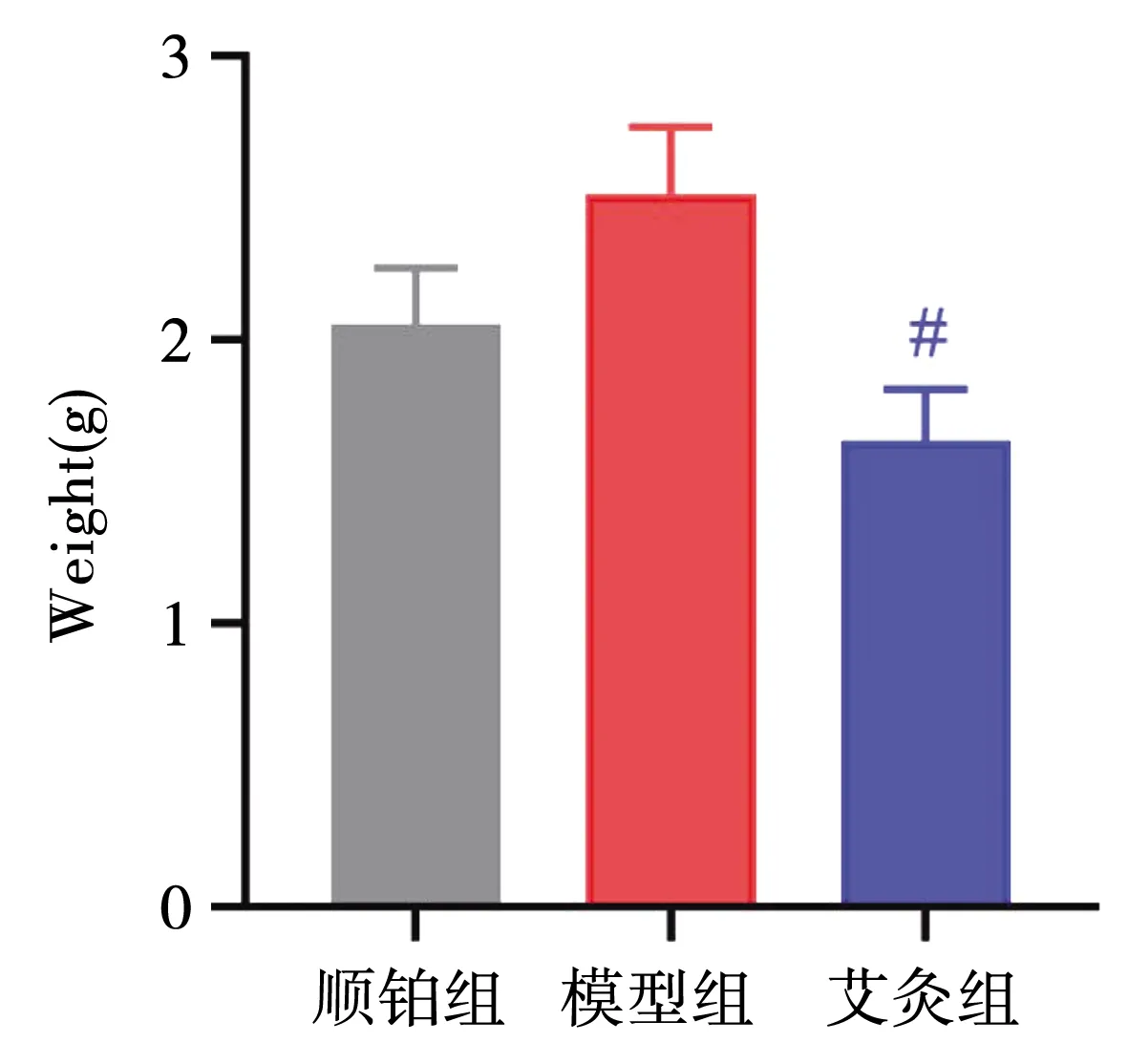
以CD4和IFN-γ为标记进行Th1细胞亚群的检测,见图3,艾灸增加荷瘤小鼠Th1细胞亚群的数量,见表2。以CD4和IL-4为标记进行Th2细胞亚群的检测,见图3,艾灸组具有下调移植瘤小鼠Th2细胞亚群数量的作用,见表2。

注:A为各组Th1细胞亚群数量的比较;B为各组Th2细胞亚群数量的比较。图3 各组脾淋巴细胞Th1和Th2细胞数量比较

表2 各组脾淋巴细胞中Th1和Th2细胞的数量比较
2.4 各组移植瘤微环境中Th1和Th2基因表达的比较
S180肉瘤移植瘤微环境中Th1基因的表达率为41.8%,顺铂组19.1%,艾灸组87.5%,与模型组比较,艾灸组Th1基因表达增加,差异具有统计学意义(P<0.01),与顺铂组比较,艾灸组Th1基因表达增加,差异具有统计学意义(P<0.01),艾灸上调Th1的基因表达。见图4。
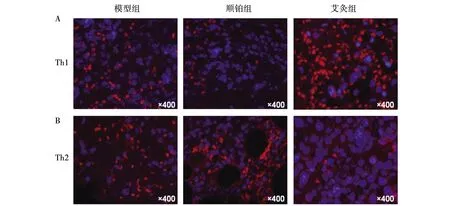
注:A为各组移植瘤微环境中Th1基因表达,红色荧光;B为各组移植瘤微环境中Th2基因表达,红色荧光。图4 各组移植瘤微环境中Th1和Th2基因表达
S180肉瘤移瘤微环境中Th2基因的表达率为45.5%,顺铂组50.1%,艾灸组16.3%,与模型组比较,艾灸组Th2基因表达下降,差异具有统计学意义(P<0.01),与顺铂组比较,艾灸组Th2基因表达下降,差异具有统计学意义(P<0.01),艾灸下调Th2的基因表达。见图4。
与模型组比较,顺铂组Th1/Th2比例向Th2偏移,差异具有统计学意义(P<0.05),与模型组比较,艾灸组Th1/Th2比例向Th1偏移,差异具有统计学意义(P<0.01)。见图5。
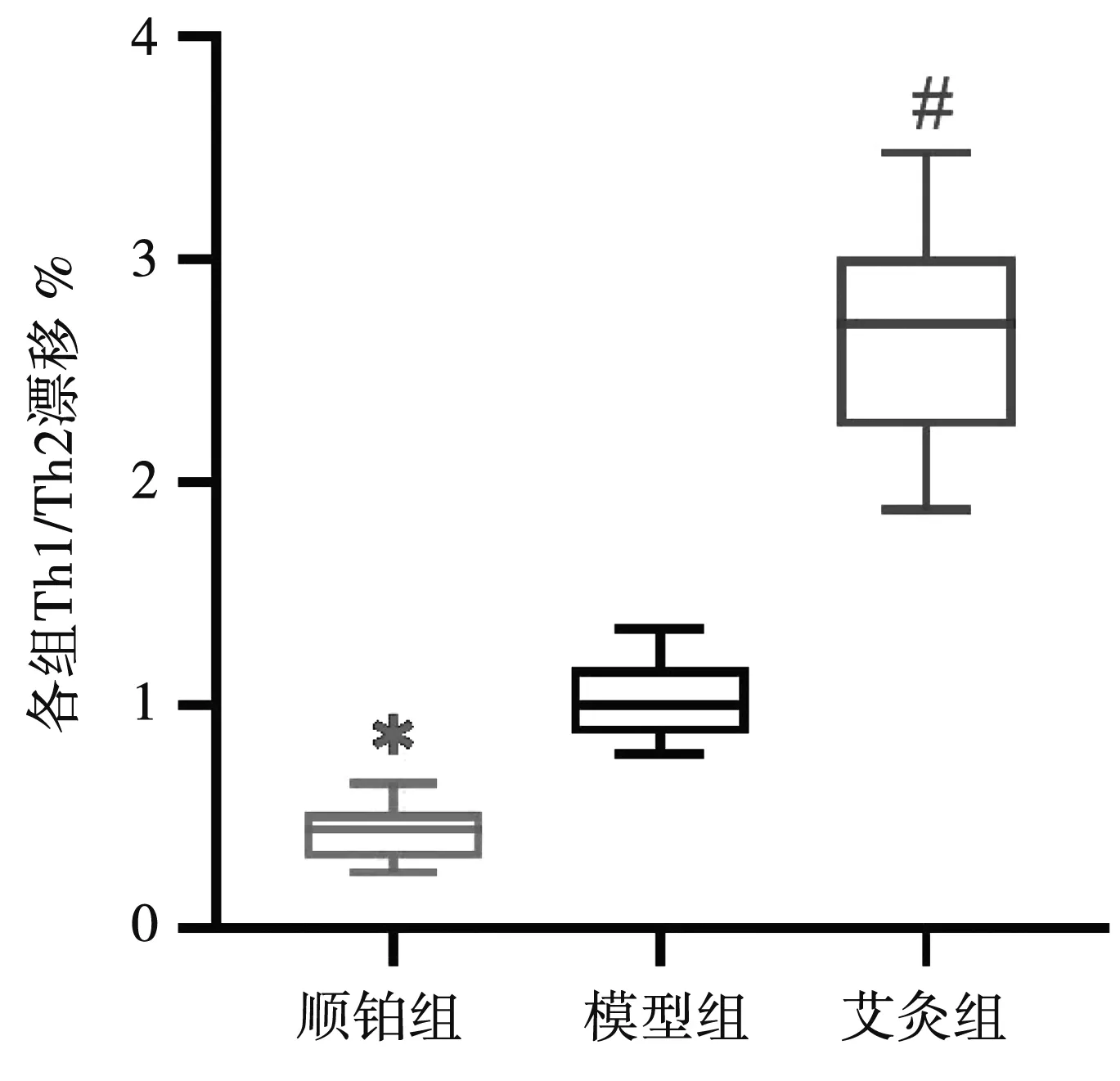
注:与模型组比较,*P<0.05,#P<0.01。图5 各组移植瘤微环境中Th1/Th2比例比较
3 讨论
在肉瘤微环境中,Th1/Th2比例向Th2漂移。临床研究表明,宫颈癌或宫颈上皮肉瘤病变患者Th1细胞比例较低,Th2、Th17和Treg细胞比例较高,宫颈癌患者IL-4、IL-10、IL-17、IL-23和TGF-β1血清浓度增加,而INF-γ血清浓度下降;宫颈癌或宫颈上皮肉瘤病变存在Th1/Th2和Th17/Treg失衡[9]。Th1数量升高,改变Th1/Th2失衡和血清IL-6浓度下降是肝癌预后良好的标记物[11]。肿瘤微环境中包括复杂的T细胞亚群网络,通过相关矩阵的层次聚类,确定与Th17 (RORC,IL-17A)、Th2 (IL-4,IL-5,IL-13)、Th1 (IRF1,IL-12Rb2,STAT4)和细胞毒性(GNLY, GZMB, PRF1)相关基因的功能簇,Th17基因高表达的患者预后较差,而Th1基因高表达的患者无病生存期较长[12]。结直肠癌的进展与Th1/Th2的失衡有关,Th1/Th2失衡向Th2漂移与Dukes分期下降有关[13]。通过流式细胞学检测,正常小鼠脾的Th1/Th2的比例为6.59:1;在S180肉瘤模型中,Th1/Th2的比例为1.66∶1,出现明显的Th2偏移。在S180移植瘤的模型中,血清IL-2和IFN-γ的浓度明显下降,IL-10和IL-4的浓度明显升高,证实在S180移植肉瘤微环境中Th1/Th2比例出现Th2偏移。
化疗抑制肿瘤生长,Th1/Th2向Th2偏移。研究表明,肺癌化疗后CD3+、CD4+、CD8+和CD4+/CD8+比值均明显下降,是导致肺部感染等的主要原因[14]。笔者使用顺铂进行干预,对S180移植瘤重量检测,模型组的均数为2.455 g,顺铂组为1.972 g。顺铂可以控制肉瘤的生长,但是其导致Th1/Th2的比例更加漂移,正常小鼠脾的Th1/Th2的比例为6.59∶1;顺铂干预组比例为0.91∶1,出现明显的Th2偏移,IL-10和IL-4的浓度明显升高。结果表明顺铂抑制肿瘤生长,导致Th1/Th2向Th2偏移。
艾灸具有抑制S180移植瘤的作用。对晚期恶性肿瘤患者在常规治疗基础上艾灸双侧足三里,每日1次,生存质量评分较治疗前提高,在乏力、气短、纳呆食少、头晕目眩、面色、心悸、腰膝酸软方面及总分的改善优于对照组,艾灸足三里能有效调节恶性肿瘤晚期患者免疫平衡,改善症状[15]。艾灸对癌症出现的恶心和呕吐具有治疗作用[16]。将S180肉瘤细胞移植到雌性小鼠乳房皮下组织中,艾灸治疗的平均生存时间为87.8 d,对照组为60.2 d[17]。通过对每组的S180移植瘤进行重量检测,艾灸组的抑制率为59.9%,顺铂组24.5%,艾灸具有抑制180移植瘤的作用,其效果优于顺铂。
艾灸通过纠正Th1/Th2偏移起抑制肿瘤的作用。谭静等研究艾灸对胃荷瘤大鼠Th1、Th2表达的影响,艾灸组第1 d悬灸中脘、关元和双侧足三里,第2日悬灸双侧脾俞及胃俞。艾灸组抑制率达41.89%,瘤体内Th1类细胞因子TNF-α、INF-γ含量增加,Th2类细胞因子IL-6、IL-22含量减少[18]。艾灸干预动脉粥样硬化降低动脉粥样硬化指数,影响Th1/Th2的漂移偏向,调整体液免疫与细胞免疫的平衡[19]。麦粒灸可有效调节荷瘤小鼠的免疫功能,促进荷瘤小鼠Th1型细胞因子的产生,有效纠正荷瘤导致Th1/Th2的失衡[20]。许焕芳等观察艾燃烧生成物对SAMP8小鼠血清Th1/Th2细胞因子的影响,模型组小鼠血清IFN-γ水平显著高于正常组,而IL-4水平则显著低于正常组,艾烟通过对Th1/Th2细胞因子平衡的调节而起到抗衰老作用[21]。
本研究表明,正常小鼠脾的Th1/Th2的比例为6.59∶1;在S180肉瘤模型中,比例为1.66∶1,通过艾灸治疗后,其比例为10.49∶1,出现明显的Th1漂移,对恶性肿瘤导致的Th1/Th2向Th2偏移具有纠正作用。艾灸治疗可以提高移植瘤小鼠血清IL-2和IFN-γ的浓度,下调IL-10和IL-4的浓度;分析肿瘤微环境中Th1和Th2基因的表达,艾灸上调了Th1基因表达,下调Th2基因表达,表明艾灸通过纠正Th1/Th2漂移起抑制肿瘤的作用。
综上所述,艾灸可抑制S180移植瘤的生长,通过调节肿瘤微环境中Th1/Th2的比值,使其由Th2漂移向Th1漂移,从而具有抗肿瘤的作用。
