双孢菇粉添加量对面包品质及抗氧化特性的影响
2021-11-07刘松韬刘宇迪刘小刚李莉蓉覃宇悦
刘松韬,刘宇迪,张 珩,刘小刚,李莉蓉,覃宇悦*
(1.昆明轩中工程技术咨询有限公司,云南 昆明 650550;2.昆明理工大学 农业与食品学院,云南 昆明 650550)
面包是世界上最主要的主食之一,同时面包制作技术是已知最悠久的技术之一[1]。面包主要是通过小麦粉、酵母、脂肪、砂糖、盐和水等原料进行混合、发酵和烘烤等过程制作而成[2]。虽然面包的蛋白质和脂肪含量较低,但是,面包中快速消化的淀粉含量较高。食用面包后,人体的餐后血糖会因淀粉的迅速水解消化而急剧升高,不利于维持人体葡萄糖稳态。
添加具有天然活性成分的物质至面包中,能使面包具有一定的功能性。例如,Li等人将麦麸加入面粉制作成面团,发现麦麸虽然降低了面团的延展性和比容,增加了馒头硬度、粘性和咀嚼性,但是,添加麦麸可以降低馒头的血糖反应,比对照组提高了39%[3]。Lu等人表明,蘑菇含有生物活性成分,据报道是有效的抗氧化剂,特别是酚类化合物和多糖,将天然多酚添加面食中,可以提高面包的的抗氧化活性,同时可以延缓淀粉的消化,具有良好的市场前景[4]。
双孢菇(Agaricus bisporus)属蘑菇科(黑伞科)(Agaricaceae)蘑菇属。双孢菇含有各种氨基酸、核苷酸、维生素C、维生素B1等众多维生素[5]。双孢菇中的酪氨酸酶可以显著降低血压。此外,其含有的醌类化合物与磺胺基结合,能有效阻碍脱氧核酸的合成,在医学中起到阻碍肿瘤细胞活性的作用[6]。目前,我国双孢菇产品主要还停留在鲜菇售卖为主,即初级加工阶段,深度加工的产品较少,不利于双孢菇资源的合理利用。双孢菇粉添加到面包中可以改善其营养结构,通过添加双孢菇粉(0、5%、10%、15%),研究其对面包比容、色差、质构及抗氧化特性的影响,为双孢菇作为功能基产品开发提供参考。
1 材料与方法
1.1 材料与设备
双孢菇、高筋麦芯小麦粉、食盐、牛奶、黄油,市售;酵母购自安琪酵母股份有限公司。没食子酸溶液、福林酚试剂、2,2′-联氮-双-3-乙基苯并噻唑啉-6-磺酸(ABTS)、1,1-二苯基-2-三硝基苯肼(DPPH)、3,5-二硝基水杨酸,购自Sigma-Aldrich公司;甲醇、维生素C标准品、葡萄糖标准品、无水碳酸钠、无水乙醇、磷酸缓冲溶液、MES-TRIS缓冲液均为分析纯;α-淀粉酶、胃蛋白酶、猪胰酶均为标准品,购自国药集团化学试剂有限公司。
SMJ-80J型和面机,无锡胜麦机械有限公司;SMF-32B型醒发箱,无锡胜麦机械有限公司;SM-603型烤箱,无锡胜麦机械有限公司;TA.XT Plus质构仪,英国Stable Micro Systems公司;LGJ18-A冷冻干燥机,上海舜制仪器制造有限公司;TU 1901型双光束紫外可见分光光度计,北京普析通用仪器有限责任公司;LXJ-IIB型离心机,上海安亭科技仪器厂。
1.2 试验方法
1.2.1 双孢菇粉的制作
双孢菇用单室真空冷冻干燥机冻干,干燥完成后,双孢菇粉通过50目筛网,置于密封袋中,4 ℃条件下保存。
1.2.2 双孢菇面包制作
将高筋面粉250 g(双孢菇粉以0、5%、10%、15%的添加量代替高筋面粉),酵母7.5 g、砂糖75 g、盐3 g、黄油50 g、牛奶150 g放入和面机中混合均匀。将和好的面团置于醒发箱中28 ℃,相对湿度75%条件下进行一次醒发,发酵90 min。醒发完成后,排气,将面团分割,每个100 g,放置松弛20 min。放入醒发箱中,在35 ℃、相对湿度75%条件下进行二次醒发,发酵45 min。焙烤温度上下火均为180 ℃,时间为18 min。室温冷却后,进行检测。
1.2.3 面包比容测定参考Hathorn等的方法[7],采用菜籽油置换法测定面包体积,按式(1)计算面包比容。

式中,ρ-面包比容,ml/g;V-面包体积,ml;M-面包质量,g。
1.2.4 面包皮和面包芯色差的测定
参考Hsu等的方法[8],采用色差仪分别对面包皮及面包芯进行测定。面包放置室温冷却后,将面包皮及面包芯粉碎过50目筛,置于色差仪中,测定每个样品的L*,a*及b*值,按式(2)计算△E值。

式中,△E-色差(值越大,说明色差越大);L*-亮度值差(值为正时,则说明比标准色板浅;值为负时,说明比标准色板深);a*-红绿值差(值越大,说明越红);b*-黄蓝值差(值越大,说明越黄)。
1.2.5 面包质构特性的测定
参照张园园等方法进行测定[9]。面包冷却至室温,取面包芯部分切割成1 cm×1 cm×2 cm厚度均匀的面包片,用质构仪进行测定,TPA 模式下测试参数为:P/36R 探头,测试前、中、后速率为1.0 mm/s、5.0 mm/s、5.0 mm/s,压缩程度50%,感应力8 g 进行测定。每组面包至少重复测定5 次,取平均值,以硬度、弹性、咀嚼性、内聚性和粘合性作为评价指标。
1.2.6 面包抗氧化特性测定
1.2.6.1 总酚含量测定
按Foli-Ciocalteu 的方法进行总酚含量测定[10]。以没食子酸为标准,测定总酚样品含量,实验结果以没食子酸当量mg/g干重表示。
用10 mL蒸馏水溶解0.010 0 g没食子酸,定容至100 mL,分別移取0、1、2、3、5、7 mL的没食子酸溶液至50 mL容量瓶中,定容。
将新鲜制备的2.5 mL 0.2 mol/L Foli-Ciocalteu试剂添加到不同浓度没食子酸溶液中(2.5 mL)静止3 min,加入2 mL 7.5%Na2CO3溶液,然后在黑暗中静置2 h。在760 nm处测量反应混合物的吸光度,7.5%Na2CO3溶液为空白。
将新鲜制备的2.5 mL 0.2 mol/L Foli-Ciocalteu 试剂添加到提取液中(2.5 mL)静止3 min,加入2 mL 7.5%Na2CO3溶液,然后在黑暗中静置2 h。在760 nm处测量反应混合物的吸光度,7.5%Na2CO3溶液为空白。
1.2.6.2 DPPH自由基清除活性
按Kim等方法测定DPPH自由基清除率[11]。先配制浓度为0.4 mmol/L DPPH自由基的无水乙醇溶液,将DPPH自由基溶液2 mL与多酚萃取物混合,在黑暗条件下,反应时间为30 min,随即测定OD517nm值。2 mL无水乙醇取代DPPH自由基溶液与样液混合做对照组,反应后,随即测定OD517nm值。2 mL无水乙醇取代样品与DPPH自由基溶液做空白组,反应后,随即测定OD517nm值。
按公式(3)计算DPPH自由基清除率。

式中:
A空白:2 mL DPPH自由基溶液与2 mL无水乙醇混合液测得的吸光值;A对照:2 mL无水乙醇与2 mL样液的混合液测得的吸光值;
A样品:2 mL DPPH自由基溶液与2 mL样液的混合液测得的吸光值。
1.2.6.3 ABTS测定
按Li的试验方法进行ABTS测定[12]。取100 μL样品(或VC),加入3.9 mL ABTS工作液,振荡30 s,在黑暗中反应10 min,即刻测定OD734nm值(Ai)。3.9 mL ABTS工作液与100 μL乙醇溶液混合,振荡30 s,在黑暗中反应10 min,即刻测定OD734nm值(A0)。3.9 mL 磷酸缓冲溶液与100 μL 样品混合,振荡30 s,在黑暗中反应10 min,即刻测定OD734nm值(Aj)。
按式(4)计算出样品和VC溶液对ABTS自由基的清除率。
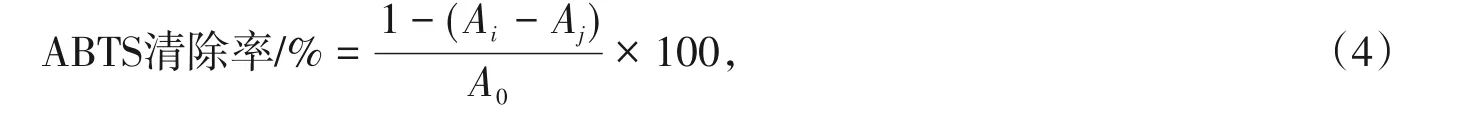
式中:Ai-样液或VC与ABTS工作液的混合液的吸光值;Aj-乙醇溶液与ABTS工作液的混合液的吸光值;A0-磷酸缓冲溶液与ABTS工作液的混合液的吸光值。
1.2.6.4 面包体外消化特性
参照Ajay的方法,测定面包在体外的消化率[13]。称取0.5 g样品于250 mL的烧杯中,加入80 mL的磷酸缓冲溶液(50 mmol/L,pH=6.9),用1 mol/L HCl调溶液调节pH至2,加入5 mL的胃蛋白酶溶液(0.35 mg/mL,pH=2.0),在37 ℃下孵育30 min。孵育结束后,立即用1 mol/L NaOH 溶液调节pH 至6.9,加入2.5 mL 的α-淀粉酶溶液,和5 mL脱氧胆酸钠溶液,在磁力恒温锅中孵育4 h,温度37 ℃。孵育结束后分别于不同时间点(0、20、60、90、120、180 min)取5 mL 消化液,沸水浴5 min 灭酶。将样品在3500 r/min 下离心10 min 并取上清。采用3,5-二硝基水杨酸法,以1 mg/mL葡萄糖标准液,测定OD540nm值,并计算葡萄糖含量。
1.2.7 数据处理
实验结果以±SD表示,数据统计分析使用SPSS 16.0软件,通过方差分析(One-Way ANOVA)的方法,对多个组间的平均数进行比较。如果P<0.05,则说明组间数据存在显著性差异。
2 结果与分析
2.1 双孢菇添加量对面包比容影响
如图1所示,随着双孢菇粉的增加,面包的比容呈现逐渐下降的趋势。与对照组的原面包相比,双孢菇添加量为15%的面包的比容下降了40.53%,说明双孢菇粉的添加影响了面团的醒发。这可能是因为双孢菇粉的加入,使面筋蛋白的稳定结构受到破坏,从而减弱了双孢菇粉-小麦粉面团的产气与持气能力,影响了面包成品的体积。这与孔晓雪等人研究面包中加入膳食纤维会降低面包比容[14],以及李嘉仪等人研究百合粉的加入会降低面包比容结果一致[15]。

图1 不同双孢菇添加量对面包比容的影响Figure 1 Effect of agaricus bisporus addition on the specific volume of bread
2.2 双孢菇添加量对面包色差影响
双孢菇添加量对面包芯色差值影响如表1 所示,面包芯的L*值随双孢菇添加量的增加呈减弱的趋势,5%、10%和15%的面包L*值分别比空白面包的减小34.25%、45.29%和52.75%,且添加量的面包与对照组面包之间存在显著性差异(P<0.05)。而随双孢菇含量的增加,a*值逐渐增大且显著高于对照组面包(P<0.05),b*值显著减小(P<0.05)。双孢菇面包与对照组面包间的色差ΔE值随双孢菇粉含量的增加而显著增大。因此,面包中双孢菇粉的含量会影响面包芯的颜色。

表1 不同双孢菇添加量对面包芯色差的影响Table 1 Effect of agaricus bisporus addition on the color difference of bread core
双孢菇添加量对面包皮色差值影响如表2所示。双孢菇面包的L*值均小于对照组(71.03),且组间存在显著性差异(P<0.05)。随着双孢菇粉添加量的增加,a*值明显增大且差异明显(P<0.05)。同时,b*值呈减小趋势且与对照组面包存在显著差异(P<0.05)。和对照组面包颜色的差异ΔE值随双孢菇含量的增加而增加,但是,双孢菇面包的面包皮色差值明显小于面包芯的色差值,这可能是由于面包在焙烤过程中,糖类物质和游离氨基酸发生美拉德反应,以及酚类物质在焙烤过程中发生了氧化,从而在面包皮上形成了红褐色物质,减小了各组间的差异。

表2 不同双孢菇添加量对面包皮色差的影响Table 2 Effect of agaricus bisporus addition on the color difference of bread crust
2.3 双孢菇添加量对面包质构特性影响
如表3所示,随着双孢菇含量的增加,面包的硬度显著增加(P<0.05),且15%双孢菇面包硬度值明显升高(P<0.05)。面包的咀嚼性与粘合性亦随着双孢菇粉含量的增加而增大,且15%双孢菇面包的咀嚼性以及粘合性,与其他各组面包相比,存在显著差异(P<0.05),与对照组面包相比分别增加了77.64%、47.48%。随着双孢菇粉添加量的增加,双孢菇面包的弹性呈减小的趋势,但5%的面包与对照组相比,并无显著差异(P<0.05)。5%、10%、15%添加量的三种双孢菇面包的内聚力与对照组面包均出现了显著差异(P<0.05),但各添加量之间的差异不大(P>0.05),这与杨雯珺等研究结果趋势相一致。上述结果表明,面包的质地会受到双孢菇粉添加的影响,这可能是因为双孢菇粉的添加影响了面团发酵,随着添加量的增加,变化程度也不同,其中双孢菇添加量为15%的面包与对照组面包相比,其质地变化最为显著[16]。

表3 不同双孢菇添加量对面包质构的影响Table 3 Effect of agaricus bisporus addition on the bread texture
2.4 双孢菇添加量对面包总酚含量影响
不同双孢菇粉添加量面包的总酚含量的测定结果如图2所示。与对照组总酚含量相比,随着双孢菇粉添加量的增加,双孢菇面包的总酚含量增加显著(P<0.05),其中,15%双孢菇添加量的总酚含量达到了12.09 mg/g。因此,双孢菇多酚经过高温处理后仍有很高的保留含量,同时也表明双孢菇多酚类物质具有耐高温的特点。

图2 不同双孢菇添加量对面包多酚含量的影响Figure 2 Effect of agaricus bisporus addition on the total phenolics content of bread
2.5 双孢菇添加量对面包抗氧化特性影响
用DPPH 以及ABTS 方法测定了添加蘑菇粉面包的抗氧化能力。从图3、4 可以看出,对照组面包的DPPH以及ABTS自由基清除率分别为10.59%和11.74%,这是由于面粉中含有维生素E、植酸等物质有一定的抗氧化性,以及在烘烤过程中产生的美拉德反应产物也具有一定的抗氧化能力,因此,有一定的DPPH以及ABTS自由基清除能力。随着双孢菇粉添加量的增大,相对应面包的DPPH以及ABTS自由基清除率逐渐上升,与对照组相比,当双孢菇粉增加到15%,面包的DPPH 以及ABTS 自由基清除率分别提高到了75.31%以及65.50%,因此,添加双孢菇可以明显提高面包的抗氧化性。这可能是因为酚类物质具有较高的抗氧化特性,而双孢菇粉的添加提高了面包中总酚含量,故而可以有效地提高面包氧化稳定性。同时也表明了,经过高温烘烤后,双孢菇多酚类物质仍具有较高的抗氧化能力。段云龙将茶叶提取物加入面包中,研究发现多酚类物质经过高温加工后,仍具有较高的抗氧化活性[17]。Sun-Waterhouse 等人将猕猴桃多酚加入到无麸质面包中,也得出相似的结论[18]。
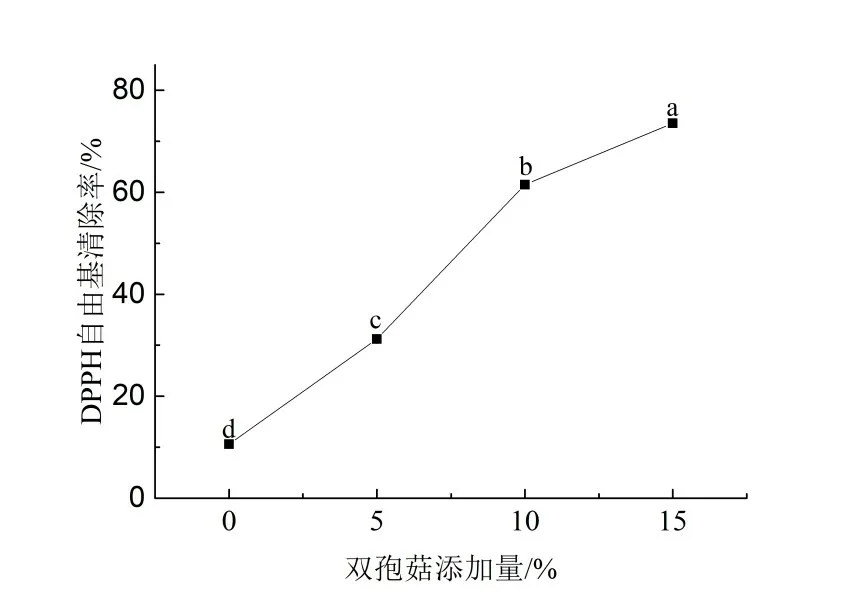
图3 不同双孢菇添加量对面包DPPH自由基清除率的影响Figure 3 Effect of agaricus bisporus addition on the DPPH radical scavenging activity of bread
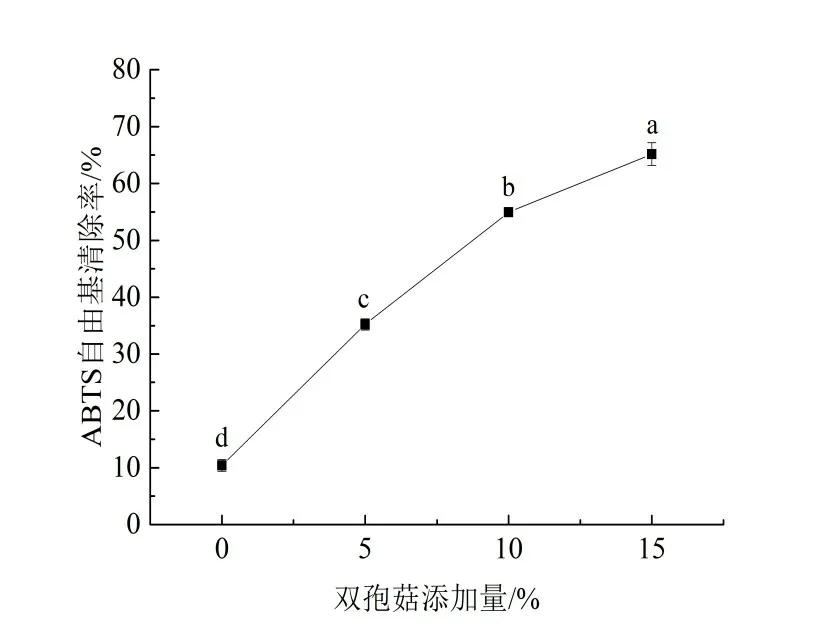
图4 不同双孢菇添加量对面包ABTS自由基清除率的影响Figure 4 Effect of agaricus bisporus addition on the ABTS radical scavenging activity of bread
2.6 双孢菇添加量对面包体外消化特性影响
如表4所示,随着消化时间的延长,各组淀粉水解率逐渐增加,不同双孢菇面包在各取样点时,样品中的淀粉水解率差异性不大,但均小于对照组面包。当消化时间达到90 min后,双孢菇添加量为10%和15%的面包的淀粉水解率明显低于对照组面包,且在180 min时,双孢菇添加量为15%的面包的淀粉水解率显著低于其他各组面包(P<0.05)。结果表明,不同双孢菇粉添加量面包均具有延缓淀粉水解率的作用,且与双孢菇添加量存在一定的相关性,双孢菇添加量为15%的面包对淀粉消化的延缓与对照组相比有明显作用。这可能是由于,随着双孢菇粉的添加,提高了面包中的膳食纤维,有研究表明,通过加入不同的膳食纤维组分,可以降低对食物的血糖反应[19]。同时,Cleary和Brennan指出,将大麦中的β-葡聚糖纤维部分添加到小麦面食中可减少体外淀粉消化后还原糖的释放[20]。这些结果可能是由于面食中淀粉-蛋白质基质的变化和膳食纤维的高水结合能力引起的,两者都会影响面食的理化性质和消化率,这与孟红伟将薯粉添加至面包中降低了面包淀粉体外水解消化率结论一致[21]。因此,这种通过添加蘑菇粉等高膳食纤维的天然物质可能对面包的淀粉体外消化率有一定影响。
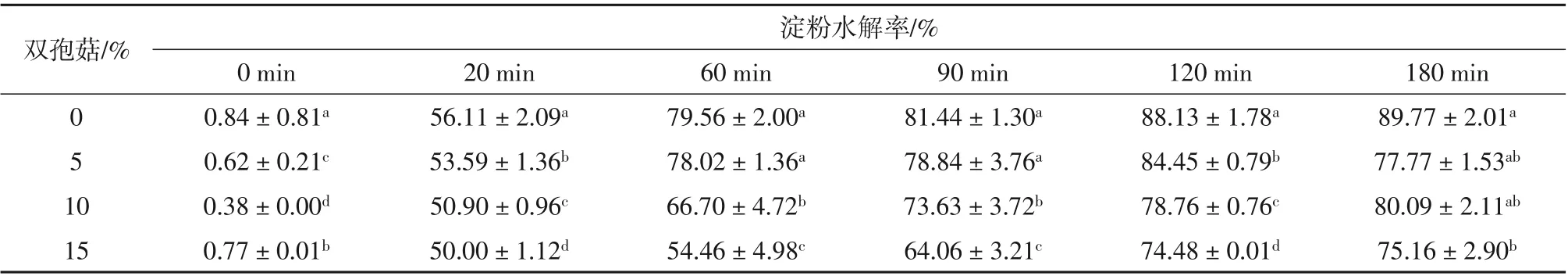
表4 不同双孢菇添加量对面包淀粉体外水解率的影响Table 4 Effect of agaricus bisporus addition on the hydrolysis rate of bread starch
3 结论
综上所述,与对照组面包相比,添加双孢菇粉的面包比容显著减小,对面包色泽影响显著,总体对产品的接受程度无显著影响。双孢菇粉对面包质构特性对照组面包相比有显著性差异,面包硬度由对照组的17.94 N 增加至39.25 N,同时面包的咀嚼性以及粘合性也较对照组增高,且相互间具有显著性差异。将DPPH 和ABTS 自由基清除率以及双孢蘑菇多酚含量与对照组进行比较,发现随着双孢蘑菇粉添加量的增加,面包的多酚含量明显增多,其抗氧化活性明显增强。与对照组相比,淀粉水解率随着双孢菇量的增加逐渐减小。因此,双孢菇的添加可提高面包的抗氧化能力,作为一种天然抗氧化成分应用于食品中,且具有广阔的市场前景,但其具体作用机制有待进一步研究,本研究为双孢菇产品的应用前景提供了参考。
