肿节风多糖SGP-2的高级结构解析及构效关系研究
2021-11-07张琬玥高向东
张琬玥,刘 玮,徐 航,高向东
(中国药科大学生命科学与技术学院,南京 210009)
肿节风多糖SGP-2是本课题组从肿节风全草中提取、分离纯化得到的一种结构复杂且生物学活性多样的酸性多糖[1]。体内外实验结果表明,SGP-2通过抑制α-葡萄糖苷酶而具有良好的降血糖活性[2-3]。多糖结构的复杂性,限制了其作用机制的阐释及构效关系的研究,也是进一步开发多糖类药物普遍存在的瓶颈问题。而多糖结构作为活性的基础及构效关系中关键的角色,近年来随着研究技术的进步不断被推动。随着多糖结构信息的揭示,其生物活性评价及作用机制的探究及构效关系的阐释都将得到推进。作为一类重要的生物大分子,与蛋白质和核酸一样,多糖的结构又分为一级结构及高级结构[4-5],而高级结构又对其活性影响起到至关重要的作用。目前高效液相-动态光散射法/静态光散射法[6]、透射电子显微镜分析(TEM)[7]、原子力显微镜分析(AFM)[8]等都是对多糖高级结构研究较常见的研究方法,将多种技术相结合可以更全面地开展对多糖高级结构及构效关系的研究。多糖高级构象变化对生物学活性的影响逐渐被科研工作者关注,如香菇多糖的抗肿瘤活性会伴随着三螺旋结构的解链而消失[9]。另外,不同的溶液环境使分子间作用力发生改变,也会导致多糖的构象发生变化从而影响其生物学活性[10-11]。
因此,本研究采用激光粒度分析、TEM和AFM等技术对肿节风酸性多糖SGP-2的高级结构进行了解析。采用不同处理方法改变了多糖SGP-2的空间构象,并初步探讨了SGP-2不同高级结构与α-葡萄糖苷酶抑制活性的关系,为多糖结构解析提供新思路,为将其开发成药物及寻找类似生物活性的多糖提供了理论依据。
1 材料
1.1 试 剂
肿节风多糖SGP-2(相对分子质量1 880 kD,本实验室自制,经高效凝胶过滤色谱检测为单个对称峰的均一多糖[1]);4-硝基苯-β-D-葡萄糖苷(pNPG)、来自酿酒酵母的α-葡萄糖苷酶(美国Sigma-Aldrich公司);其他试剂均为国产分析纯。
1.2 仪 器
Multiskan全波长酶标仪(美国Thermo公司);Easysizer20激光粒度分析仪(珠海欧美克仪器有限公司);SP13800原子力显微镜、JEM2100透射电子显微镜(日本电子株会社);KH5200DB超声清洗器(昆山禾创超声仪器有限公司)。
2 方法
2.1 肿节风多糖SGP-2高级结构解析
2.1.1 激光粒度分析 称取多糖样品SGP-2 5 mg置于25 mL茄形瓶中,加入蒸馏水或0.05 mol/L Na2SO4溶液10 mL搅拌过夜,临用前用超声清洗器100 W超声10 min,置于比色皿中用激光粒度分析仪扫描,每个样品重复3次。
2.1.2 透射电子显微镜(TEM)分析 称取多糖样品SGP-2 10 mg置于10 mL茄形瓶中,加入蒸馏水或0.05 mol/L Na2SO4溶液5 mL配制为质量浓度为2 mg/mL的溶液,磁力搅拌过夜,80℃加热2 h,临用前用超声清洗器100 W超声10 min,0.45µm滤膜过滤。将样品溶液滴加到200目铜网上,用磷钨酸染色并干燥,当仪器电压升高到80 kV时,用镊子将铜网置于电子枪上并插入样品室中,通过调焦系统选择适当视野拍照记录结果。
2.1.3 原子力显微镜分析 称取多糖样品SGP-2 10 mg置于10 mL茄形瓶中,加入蒸馏水5 mL溶解后磁力搅拌过夜,蒸馏水对样品进行梯度稀释至终浓度为10µg/mL,0.45µm滤膜过滤。将稀释后的样品溶液滴在新剥离的云母片上,室温干燥后立即置于金属样品台中。调整样品与探针之间的距离并控制在1~2 mm范围内,图像测量方式设置为DFM轻敲模式,扫描速度为0.8 Hz,获取AFM图像。图像及测量数据采用Nanoscope V Multimode 8软件进行分析。
2.2 肿节风多糖SGP-2构效关系的初步研究
2.2.1 SGP-2及其衍生物在不同条件处理下的样品制备
物理处理:(1)以不同浓度的尿素(0.5,1,2,4,8,10 mol/L)为溶剂将SGP-2配制成0.5 mg/mL或1 mg/mL的溶液后在4℃放置24 h,再设置另一组如上处理后通过透析去除尿素;(2)将SGP-2配制成0.5 mg/mL或1 mg/mL的溶液转移至泪滴型安培管中抽真空封口,分别放置于不同温度(100,120,140℃)的油浴中加热1 h并于4℃保存24 h。
脱甲酯:将多糖SGP-2配成3 mg/mL多糖溶液,50℃加热溶解。用NaOH调pH至12并维持24 h,使其发生皂化反应脱去甲酯,再用HCl中和至pH为7。反应液用8~14 kD透析袋透析48 h,减压浓缩至40 mL并加入4倍体积无水乙醇醇沉过夜,离心,取沉淀进行真空干燥后命名为SGP-2T。
羧基还原:称取多糖样品SGP-2 80 mg溶于双蒸水30 mL,用盐酸调pH至4.75,加入碳化二亚胺固体766.8 mg对羧基进行活化并在该pH条件下维持45 min。反应结束后用盐酸调pH为9.0并在维持3 h的同时缓慢加入硼氢化钠固体3.6 g,反应结束后再用盐酸将pH调回7.0。滴入少量浓盐酸观察是否有气泡产生,从而判断反应是否完全。将还原产物用8~14 kD透析袋透析48 h,截留液减压浓缩至3.5 mL,加入无水乙醇14 mL过夜,4 000 r/min离心10 min,沉淀用无水乙醇洗涤2次后干燥后命名为SGP-2H。
2.2.2 高级结构分析 按“2.1.1”和“2.1.2”项下操作,使用激光粒度分析仪和TEM研究“2.2.1”项不同处理条件下SGP-2及其衍生物高级结构的变化,以相同浓度未经过任何处理的SGP-2水溶液为对照。
2.2.3α-葡萄糖苷酶活性的测定 用磷酸盐缓冲溶液(PBS)将处于不同溶剂、加热处理、脱甲酯及羧基还原处理的SGP-2及其衍生物样品配制成1 mg/mL溶液,梯度稀释至终浓度分别为15.63,31.25,62.5,125,250,500和1 000µg/mL。样品160µL和α-葡萄糖苷酶(1 U/mL)20µL混合后置于37℃孵育10 min,再加入底物5 mmol/LpNPG溶液20µL混匀后在37℃孵育30 min。以相同浓度未经过任何处理的SGP-2为阳性对照,以PBS代替样品作为空白对照,每组设置3个平行,测定405 nm的吸收度。计算样品的抑制率,抑制率(%)=(样品吸收度-以PBS代替α-葡萄糖苷酶时反应体系吸收度)/PBS代替样品时反应体系的吸收度×100。
数据由Graphpad Prism 8.0软件进行统计学处理,采用Two-Way ANOVA比较分析。
3 结果
3.1 肿节风多糖SGP-2高级结构解析
3.1.1 激光粒度分析 使用激光粒度分析仪测得肿节风多糖SGP-2在水中直径为(147.1±3.0)nm,粒径分布为0.157;在0.05 mol/L Na2SO4中直径为(91.6±2.5)nm,粒径分布为0.260。无论是在水溶液还是在盐溶液中粒径分布范围均较窄,小于0.3,表明肿节风多糖SGP-2均一性较好[12]。与在水中相比SGP-2在盐溶液中粒径明显降低,这可能是由于Na+离子的存在中和了SGP-2羧基所带的负电荷,减少了多糖分子间的排斥作用。
3.1.2 TEM分析TEM结果如图1所示,在水溶液中SGP-2多数以聚集体的形式存在(图1-A),这可能由于多糖分子之间或者多糖与水分子之间存在氢键或者范德华力,为分子的聚集提供支撑作用[13-14]。相反,在视野边缘地区有少量SGP-2浓度相对较低,分子分散性较好,主要表现为周边光滑的圆形颗粒(图1-B)。在盐溶液中,SGP-2的聚集体明显减少,部分伴随分支形态(图1-C),集中呈现出圆形结构(图1-D)。而TEM数据统计出的粒径大小,相同浓度的SGP-2在纯水中的直径为155 nm,在盐溶液中的粒径为80 nm,这种尺寸的略微减小可能是由于盐离子的存在破坏了多糖分子内或分子间的相互作用力如静电排斥作用从而导致解聚现象的发生,或是可能归因于铜网对大分子的吸附作用[15]。
3.1.3 AFM分析SGP-2的三维AFM结果如图2所示。经过数据统计及软件分析,SGP-2的平均直径为33 nm,测算得到的粒径大小与TEM结果在一个数量级。另外软件分析计算出多糖分子的平均高度为1.84 nm,而单链多糖分子的平均高度为0.1~1.0 nm[16],也证明了SGP-2在纯水中发生了聚集现象,与TEM结果一致。
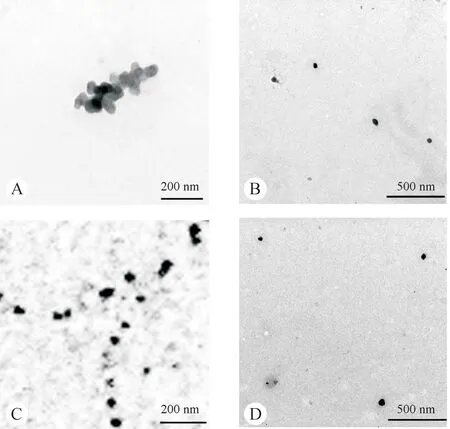
Figure 1 Transmission electron microscope(TEM)images of polysaccharide SGP-2 extracted from Sarcandra glabra
3.2 肿节风多糖SGP-2构效关系的初步研究
3.2.1 SGP-2及其衍生物在不同条件处理下的高级结构分析 采用不同的处理方法得到了高级结构发生变化的SGP-2及其衍生物,尿素处理对SGP-2粒径及粒径分布的影响如表1所示。氢键被认为是多糖构象变化的主要驱动力之一[17],随着尿素浓度的升高,SGP-2的分子粒径逐渐增大,这可能因为尿素的存在破坏了SGP-2分子内或分子间的氢键,促使分子间相互作用力减弱,分子内部结构松散。采用透析的方法去除尿素后,低浓度尿素被透析后SGP-2粒径基本恢复,而当尿素浓度增加至1 mol/L以上,透析后SGP-2的粒径并没有完全恢复。这可能因为低浓度尿素对氢键的破坏力相对较弱,随着浓度的升高,尿素促使多糖与水分子之间氢键的断裂,多糖内部的疏水残基伸展,粒径变大,而且部分尿素可以转变为氰酸盐,氰酸盐的存在可能改变多糖分子的表面电荷,从而导致部分构象透析后没有完全恢复[18]。经过高温加热的SGP-2粒径明显随着温度升高而增大,在100℃时粒径为(181.3±1.6)nm,粒径分布为0.255;在120℃时粒径为(206.0±7.5)nm,粒径分布为0.288;并最终在140℃达到(208.2±4.6)nm,粒径分布为0.249。这可能因为分子间氢键发生断裂,游离的糖链之间相互交替、缠绕所致。由此可见,溶液环境的变化显著影响SGP-2的粒径大小。而脱甲酯的SGP-2衍生物在水溶液中的粒径变大,其直径可达(522.6±3.5)nm,粒径分布为0.404。这可能因为脱甲酯会暴露出部分羧基,游离的羧基促使分子内或分子间氢键增多,分子聚集。羧基还原后的SGP-2衍生物粒径也变大,直径为(222.1±3.8)nm,粒径分布为0.264。原因可能在于羧基的减少使得分子间相互作用力减弱,糖链展开,结构松散。
Table 1 Effects of urea on the diameter distributions of SGP-2(±s,,n=3)
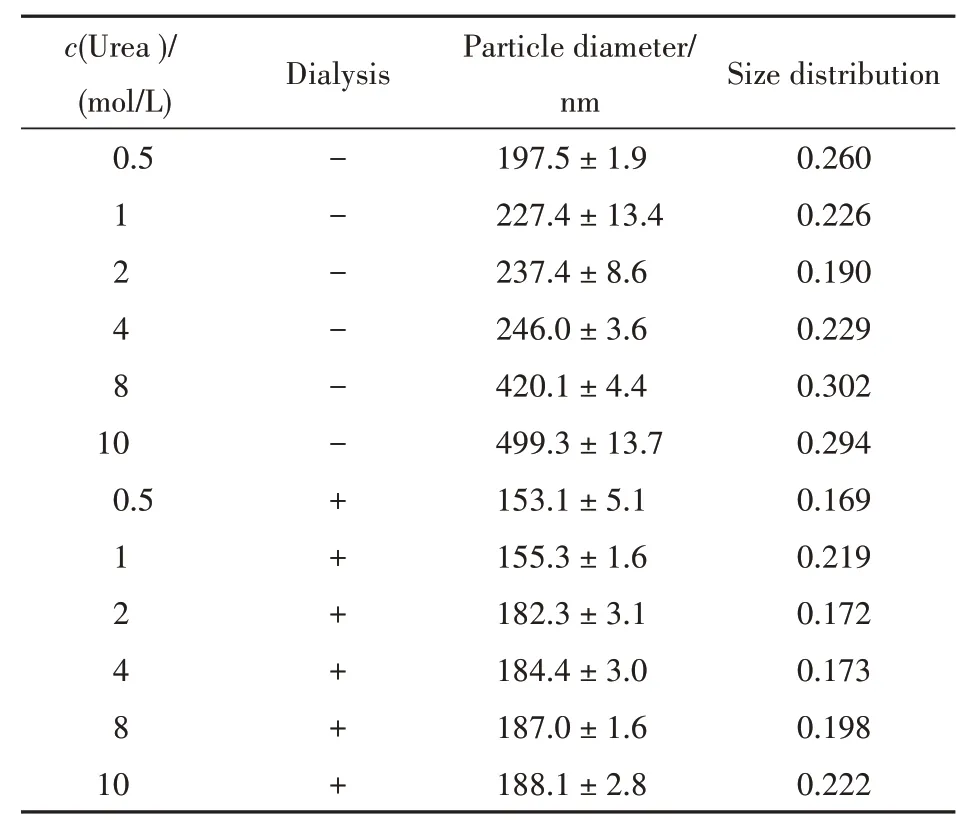
Table 1 Effects of urea on the diameter distributions of SGP-2(±s,,n=3)
c(Urea)/(mol/L)0.5 1248 10 0.5 1 2 4 8 10 Dialysis------++++++Particle diameter/nm 197.5±1.9 227.4±13.4 237.4±8.6 246.0±3.6 420.1±4.4 499.3±13.7 153.1±5.1 155.3±1.6 182.3±3.1 184.4±3.0 187.0±1.6 188.1±2.8 Size distribution 0.260 0.226 0.190 0.229 0.302 0.294 0.169 0.219 0.172 0.173 0.198 0.222
将粒径发生显著变化的样品用TEM进行观察,结果如图3所示。经低浓度尿素(0.5 mol/L)处理过的SGP-2透析后去除诱因,其水溶液形貌为50 nm左右的内部具有少量空穴的球体(图3-A),与未经任何处理的SGP-2构象具有较高的相似性。而经高浓度尿素处理过的SGP-2水溶液并没有恢复原始形貌,而是受分子间或分子内氢键断裂、分子间作用力减弱等因素的影响,原本紧密结合的球体结构发生扩散,糖链之间形成有规则的稀疏的氢键及范德华等作用力,从而聚集成具有卵圆形空穴的网格形态(图3-B)。经不同温度加热处理的SGP-2水溶液也会具有不同的形貌(图3-C、D)。100℃加热后,SGP-2形成致密网格,而140℃的加热处理为氢键的进一步断裂提供了足够能量,促使糖链之间的氢键几乎完全断裂,最终形成具有分支的杆状结构。羧基还原这一化学反应对分子形态的影响较大,羧基还原后的衍生物SGP-2H高级结构松散,糖链之间相互交叠、缠绕形成特征性较为明显的缠结链,可能由于分子间氢键较少。这与香菇多糖在TEM表现出的三螺旋结构有些相似[18],同时SGP-2H呈现出明显的高分支状态(图3-E)。而脱甲酯后的衍生物SGP-2T与SGP-2相比,游离的羧基增多,分子内及分子间的氢键及分子间作用力明显增大,导致分子的聚集程度变大,但由于SGP-2结构中甲酯度相对较低,并没有对结构产生明显的影响,SGP-2T仍表现为紧密的聚集球体(图3-F)。
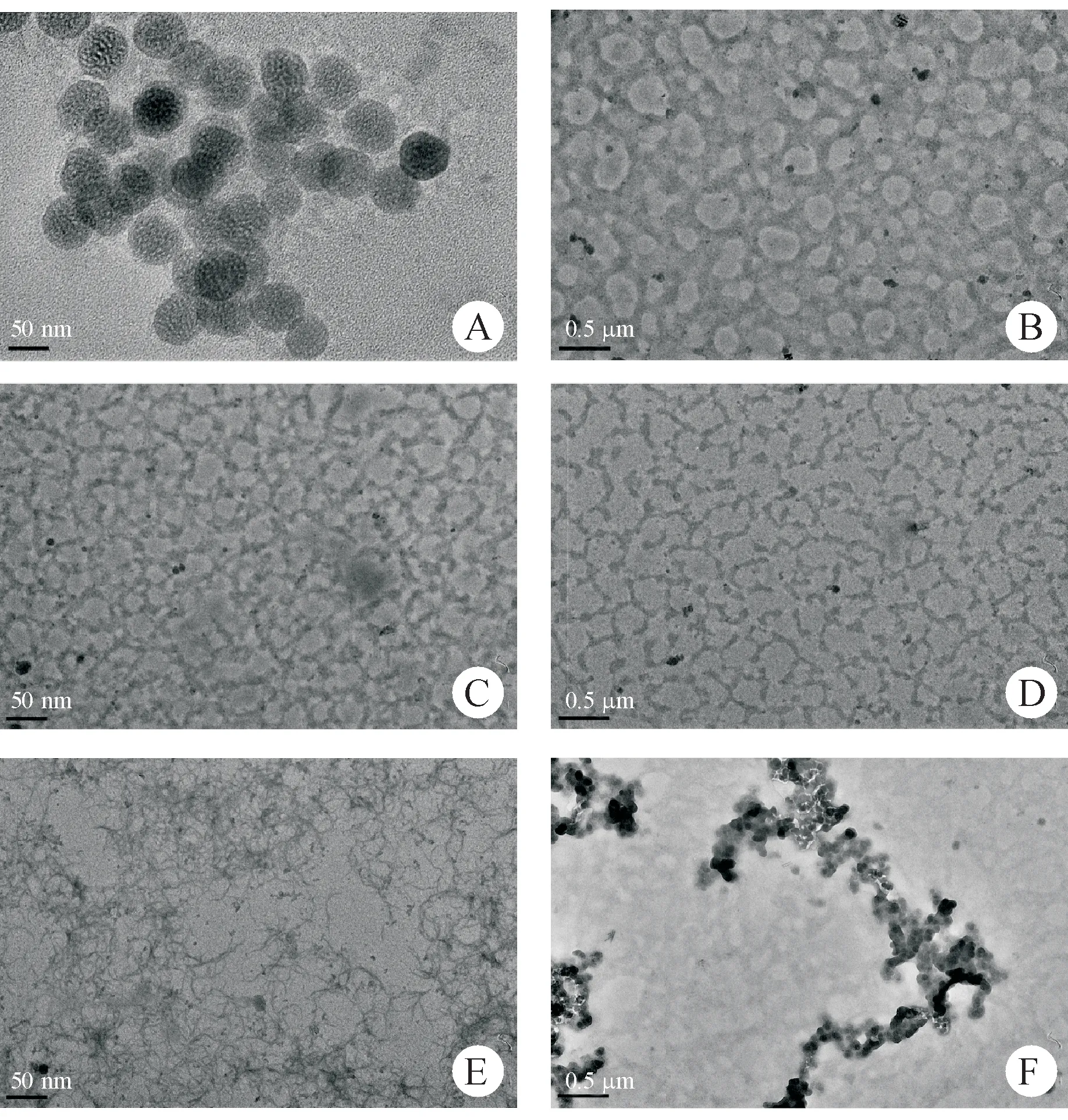
Figure 3 Morphology of SGP-2 after different treatment
3.2.2α-葡萄糖苷酶活性的测定 采用不同的处理方法改变多糖SGP-2的高级构象后,对其不同的高级结构与α-葡萄糖苷酶体外抑制活性间关系进行了初步探究。结果如图4-A可知,经尿素处理的SGP-2都表现出α-葡萄糖苷酶抑制活性,并呈剂量依赖性。与未经处理的SGP-2相比,0.5 mol/L尿素处理后的SGP-2在1 000µg/mL下抑制率可达未处理SGP-2抑制率的98.8%。而经10 mol/L尿素处理的SGP-2抑制活性明显降低,在62.5µg/mL下抑制率仅有原SGP-2抑制率的28.5%。如图4-B所示高温处理后的SGP-2对糖苷酶抑制活性明显升高,且温度越高,活性越强,原因可能在于加热促使多糖分子间或分子内氢键断裂,暴露出某些活性基团[19]。经140℃处理的SGP-2于1 000µg/mL下抑制率高达83.3%,高于同浓度下原型SGP-2的抑制率(72.7%)。图4-C表明SGP-2脱去甲酯后的衍生物活性有所提高,在1 000µg/mL下抑制率为77.7%,推测可能是由于甲酯的去除使得空间位阻减小,暴露出部分活性位点,有利于SGP-2与α-葡萄糖苷酶的相互作用。而羧基还原的SGP-2衍生物活性明显降低,由此推测糖醛酸在SGP-2与α-葡萄糖苷酶结合过程中发挥重要作用。
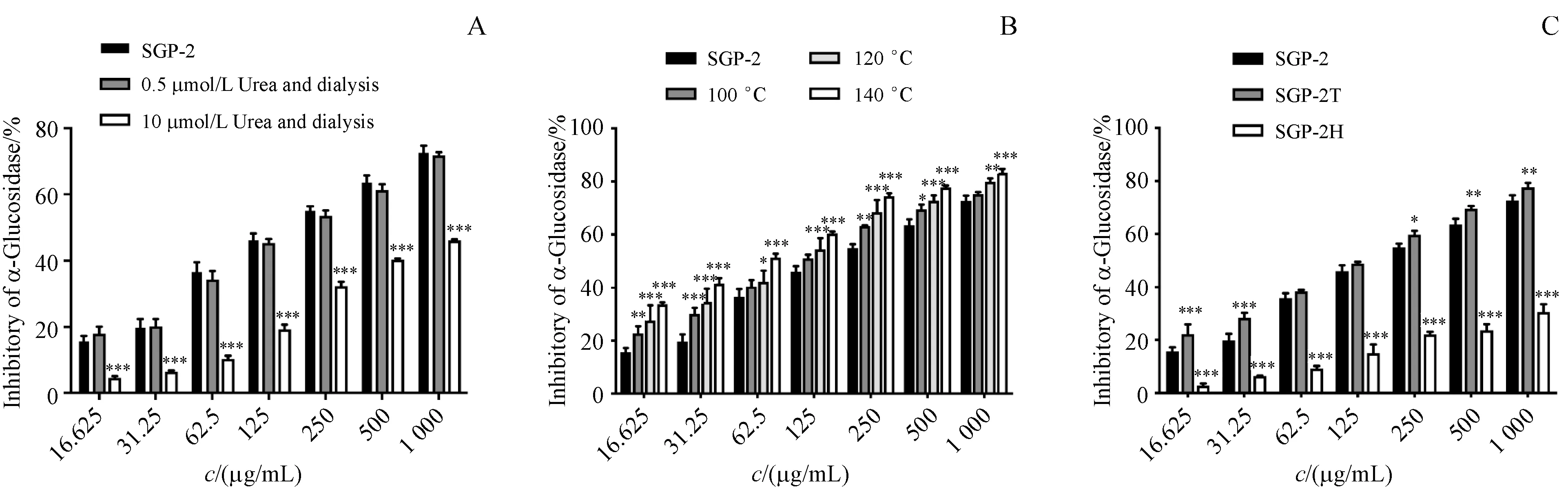
Figure 4 Inhibition activity of on SGP-2α-glycosidase at different conditions in vitro(±s,,n=3)
4 讨论
本研究显示经0.5 mol/L尿素处理并透析的SGP-2以及脱甲酯的SGP-2衍生物在电镜下呈现出的球形结构有助于与α-葡萄糖苷酶的结合。而经高温处理的SGP-2形成网格结构甚至进一步断裂网格形成短杆状,且处理温度越高活性越强,由此推测游离的羟基及羧基有助于SGP-2与酶蛋白的相互作用,这可能与氢键的形成有关。SGP-2经羧基还原后的衍生物呈现相互缠结纤维状构象,抑制活性显著下降,推测可能因舒展的结构造成糖链的长度增加,导致无法进入酶蛋白的活性区域。另外,高浓度尿素及加热处理后虽同为网格形态,但对α-葡萄糖苷酶的抑制活性却区别很大,这可能因为高浓度的尿素导致SGP-2表面电荷发生改变,与酶蛋白之间的离子键减弱,结合能力降低。本研究仅通过体外α-葡萄糖苷酶抑制活性初步研究了SGP-2的构效关系,后续实验将通过动物实验进一步讨论不同构象的SGP-2在体内的降糖活性。
