TM9SF2促进三阴性乳腺癌MDA-MB-231细胞的增殖与转移
2021-11-07王丽新姜修博郭巧珍王籽橙王玉霞瞿文生段小涛
王丽新,姜修博,郭巧珍,王籽橙,王 勃,王玉霞,瞿文生*,段小涛**
(1天津大学化工学院,天津 300350;2军事医学研究院毒物药物研究所,抗毒药物与毒理学国家重点实验室,北京 100850;3南京工业大学生物与制药工程学院,南京 211800)
乳腺癌是女性最常见的恶性肿瘤之一,在我国占比恶性肿瘤的7%~10%,并呈逐年上升趋势。到2020年,乳腺癌的新增病例数达到了270万[1]。乳腺癌主要分为三阴型、HER2/neu阳性、Luminal A和Luminal B 4种亚型[2]。乳腺癌的转移是导致患者预后不良的重要因素。现在已知的乳腺癌转移类型有如下3种:局部扩展、淋巴转移、血运转移。目前针对转移并无特效治疗手段,因此,寻找新的控制乳腺癌转移的关键基因,掌握特定蛋白在乳腺癌转移中的作用机制,明确转移相关的分子靶标,对于乳腺癌临床治疗具有重要意义。
9次跨膜超家族蛋白2(transmembrane 9 superfamily protein member 2,TM9SF2)具有9个跨膜结构域,在整个进化过程中保守[3-4],研究表明TM9蛋白可能在吞噬、黏附和营养吸收中发挥关键作用[5-7],其中TM9SF1的表达与膀胱癌呈正相关[8],TM9SF4的过表达与肿瘤转移表型正相关[9-11]。TM9SF2在各种分型的乳腺癌(MCF-7、T-47D、SKBR-3、ZR-75-1、MDA-MB-231、MDA-MB-435、MDAMB-134)细胞系中均有表达,而在正常细胞中表达量较低[12]。通过对肿瘤基因组图谱数据(TCGA)进行分析,约35%的大肠癌患者TM9SF2的mRNA水平升高[13]。另有研究发现,长的基因间非编码RNA 01232(LINC01232)通过调节TM9SF2在胰腺癌中发挥致癌活性[14]。通过乳腺癌整合数据分析平台(breast cancer integrative platform,BCIP)分析TM9SF2 mRNA的表达水平在癌旁组织和乳腺癌组织中的差异,结果发现TM9SF2的mRNA水平在肿瘤细胞中的表达量比在正常细胞中高[15]。本研究对三阴性乳腺癌MDA-MB-231细胞株中TM9SF2的蛋白表达水平进行检测,并通过靶向沉默TM9SF2,探究TM9SF2对三阴性乳腺癌细胞MDA-MB-231的增殖和转移能力的影响,并进一步探讨了TM9SF2调控三阴性乳腺癌的分子机制。
1 材料
1.1 试 剂
DMEM培养基(德国Sigma公司);胎牛血清、胰酶、磷酸盐缓冲液(PBS)(美国Gibco公司);Lipofectamine-iMAX(美国Invitrogen公司);苯甲基磺酰氟(PMSF)、蛋白酶抑制剂、磷酸酶抑制剂(Phostop)(美国Selleck公司);Bradford蛋白定量试剂盒(美国Thermo公司);兔抗人TM9SF2(美国Abcam公 司);兔 抗 人Snail、Slug、N-cadherin、PI3K、p-AKT、ERK、SRC、GAPDH、兔二抗(美国CST公司)、聚偏二氟乙烯膜(PVDF,美国Millipore公司)。
1.2 仪 器
酶标仪、细胞培养箱、水平离心机、高速低温离心机(美国Thermo公司);显微图像采集系统、电泳仪、电转仪(美国Bio-Rad公司);微量移液器(德国Eppendorf公司)。
1.3 细 胞
人乳腺癌细胞株MDA-MB-231、非致瘤的乳腺上皮细胞株MCF-10A购自美国模式培养物集存库(ATCC),由军事科学院军事医学研究院毒物药物研究所保存。
2 方法
2.1 siRNA合成
本研究用到的siRNA的核酸序列如表1所示,由广州锐博生物科技有限公司进行设计并合成。
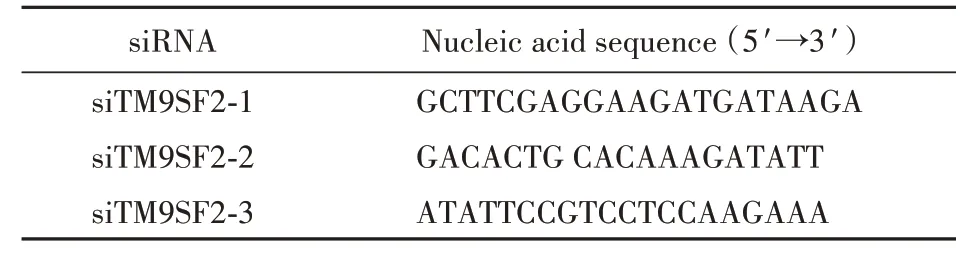
Table 1 siRNA Sequence
2.2 细胞培养
用DMEM完全培养基(含有10%胎牛血清和1%青链霉素)在37℃、5%CO2的培养箱内培养细胞,细胞融合率达90%及以上,用胰蛋白酶消化,人乳腺癌细胞株MDA-MB-231的传代比例一般为1∶3,非致瘤的乳腺上皮细胞株MCF-10A一般按照1∶2的比例传代。
2.3 敲低TM9SF2基因
将MDA-MB-231细胞以每毫升1×105个细胞的密度接种于6孔板,每孔2 mL,置于细胞培养箱中培养12 h,待细胞融合率达35%左右,对MDAMB-231细胞进行转染实验。将转染试剂Lipofectamine-iMAX 4µL与opti-MEM培养基100µL混合,同时将2µmol/L siRNA储存液加入opti-MEM 100µL混合,5 min后,将两者混匀,室温放置15 min后滴加到相应孔板中,培养6 h后换培养液,48 h后可进行后续实验。
2.4 MTS法检测增殖活性
MDA-MB-231细胞经siRNA转染48 h后,进行消化,再用DMEM完全培养基混悬,对每组转染序列的细胞进行计数,并调整每组细胞的浓度为每毫升1×105个细胞,接种到96孔板进行细胞培养,每孔加细胞悬液100µL,摇晃孔板使细胞分布均匀,在37℃、5%CO2条件下进行培养,在接种后的12,24,48,72,96 h,每孔细胞加入MTS溶液20µL,轻晃使其分布均匀,继续37℃孵箱内孵育培养2 h,酶标仪检测570 nm波长处的吸收度,根据吸收度制作细胞的对数期生长曲线。
2.5 Transwell小室侵袭实验检测转移能力
MDA-MB-231细胞经siRNA转染48 h后,进行消化,再用无血清DMEM培养基混悬,对每组转染序列的细胞进行计数,并调整每组细胞的浓度为每毫升2.5×104个细胞,在Transwell小室的下层孔中加入DMEM完全培养基800µL,在上室加入混匀的细胞悬液200µL,置于37℃、5% CO2培养箱中培养36~48 h,用4%多聚甲醛固定20 min,1%结晶紫染色1 h后,用棉签小心擦去膜上面的细胞,在显微镜下观察细胞染色情况,用显微图像采集系统进行拍照。
2.6 划痕愈合迁移实验检测转移能力
siRNA转 染MDA-MB-231细 胞48 h后,利 用10µL枪头在细胞层中形成划痕,生理盐水洗去漂浮细胞,更换无血清培养基,于0 h,24 h在显微镜下观察细胞迁移情况,并随机选取3处进行拍照。每组转染序列设3个复孔。
2.7 Western blot实验检测相关蛋白的表达情况
MDA-MB-231细胞转染48 h后,收集细胞,用RIPA裂解液(含有PMSF、protease inhibitor cocktail、phostop)进行蛋白提取,加上样缓冲液,100℃煮沸15 min,用10% SDS-PAGE电泳分离蛋白,再转印至PVDF膜上,将PVDF膜放在用TBST配制的含5%脱脂牛奶溶液中室温封闭1 h,再分别加入相应一抗,4℃过夜,次日以TBST洗涤3次,加入二抗,室温孵育1 h,TBST洗涤3次,定影显色,用GAPDH作内参对照,检测不同转染组别的MDAMB-231细胞的蛋白表达情况。
2.8 数据统计
实验数据使用Graph Pad Prism 5统计软件进行统计及图像处理。采用单因素方差分析,以P<0.05为差异具有统计学意义。
3 结果
3.1 TM9SF2在MDA-MB-231细 胞 和MCF-10A细胞的表达量差异
体外培养三阴性细胞株MDA-MB-231以及非致瘤的乳腺上皮细胞株MCF-10A,采用Western blot检测细胞内TM9SF2蛋白表达情况,结果表明TM9SF2在MDA-MB-231中的表达量明显高于MCF-10A(图1)。结果证明,TM9SF2在恶性和转移程度都较高的MDA-MB-231中高表达。
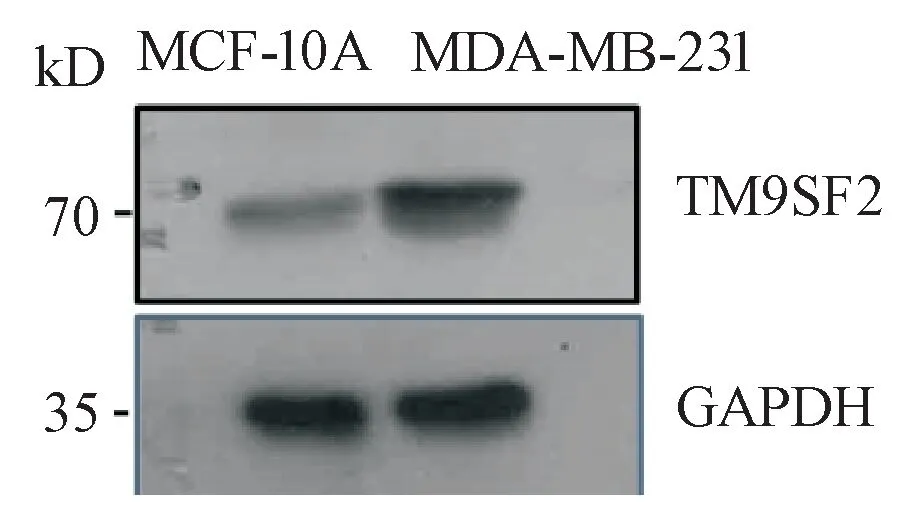
Figure 1 MCF-10A cells had lower expression of TM9SF2 than MDAMB-231 cells
3.2 敲低TM9SF2的效率验证
用siNC、siTM9SF2(1、2、3序列)转染乳腺癌细胞MDA-MB-231,细胞转染48 h后,Western blot检测结果(图2)显示,与对照组相比,转染了siTM9SF2(1、2、3序列)的细胞中TM9SF2的蛋白表达水平明显下调。

Figure 2 Gene silencing efficiency in MDA-MB-231 cells
3.3 敲低TM9SF2对细胞增殖能力的影响
MTS检测结果显示:在细胞贴壁的0、24、48、72和96 h用MTS试剂盒检测细胞增殖活性,敲低TM9SF2的细胞增殖活性明显低于对照组(图3),提示敲低TM9SF2抑制MDA-MB-231的增殖能力。
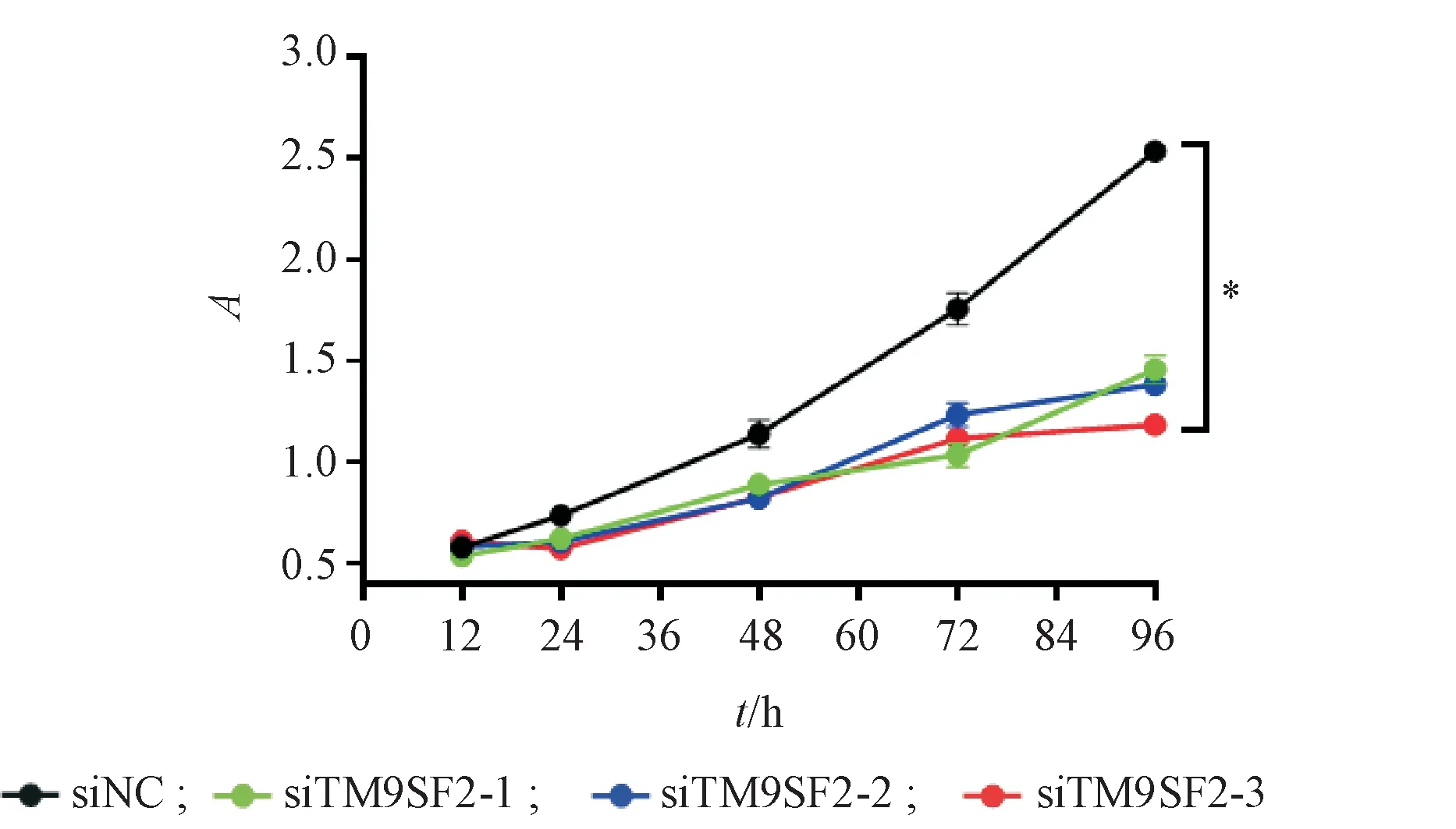
Figure 3 Effects of silencing the TM9SF2 gene on proliferation of MDA-MB-231 cell lines(±s,,n=3)
3.4 敲低TM9SF2对细胞转移能力的影响
Transwell实验结果显示,敲除TM9SF2的细胞转移数显著减少(图4-A),差异有统计学意义(图4-B)。划痕实验结果显示,与对照组相比,敲低TM9SF2的细胞划痕间隙变化降低(图4-C)。
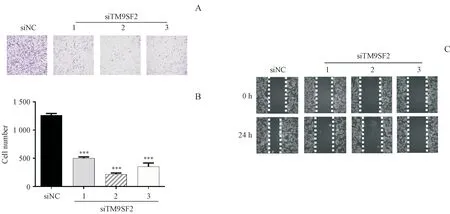
Figure 4 Effects of silencing TM9SF2 on migration in MDA-MB-231 cell lines
3.5 敲低TM9SF2后相关信号通路的变化
Western blot实验结果显示,与对照组比较,敲低TM9SF2可下调PI3K蛋白表达;并影响AKT蛋白磷酸化激活(图5-A),而对于SRC与ERK通路影响较小。提示TM9SF2主要通过PI3K-AKT通路,调控三阴性乳腺癌的增殖。敲低TM9SF2后Snail、Slug和N-cadherin在蛋白水平表达均出现明显下调(图5-B),这些是EMT通路的重要转录因子和相关蛋白,由此表明敲低TM9SF2影响EMT过程进而影响MDA-MB-231的转移。
4 讨论
本实验通过对高表达TM9SF2的MDA-MB-231细胞进行基因沉默,检测细胞增殖和转移能力的变化,结果表明,TM9SF2在MDA-MB-231细胞中发挥了促进增殖和转移的作用。接下来的实验可以采用Transwell小孔铺人工基底膜胶(Matrigel)进一步检测TM9SF2是否对MDA-MB-231细胞的侵袭产生影响。实验后续通过对其分子机制的研究,发现敲低TM9SF2可下调PI3K的表达,抑制下游AKT磷酸化的发生,但并不显著影响SRC和ERK的表达。PI3K-AKT信号通路在多种细胞功能(例如细胞存活、生长、增殖和代谢)中起着至关重要的作用,在许多人类肿瘤中均被异常激活[16]。TM9SF2特异性通过PI3K-AKT通路影响三阴性乳腺癌细胞株MDA-MB-231的增殖。由此说明可以通过降低TM9SF2的表达来抑制三阴性乳腺癌的增殖。但是具体通过PI3K-AKT通路的哪个分子对增殖产生影响并未十分明确,而且PI3K-AKT也会对肿瘤细胞的迁移、黏附、肿瘤血管生成以及细胞外基质的降解等过程产生影响,所以对TM9SF2促进肿瘤增殖的具体分子机制还有待进一步的探究。Western blot实验结果还证明,TM9SF2通过上调EMT通路的重要转录因子Snail、Slug和通路的相关蛋白N-cadherin来增强细胞的转移能力。因此,通过抑制TM9SF2基因发挥生物作用可以减少三阴性乳腺癌细胞进行EMT过程,这一过程可能发生在肿瘤产生早期,因此通过对TM9SF2基因表达的控制有助于患者降低远端转移发生概率,从而提高患者预后的生存质量。
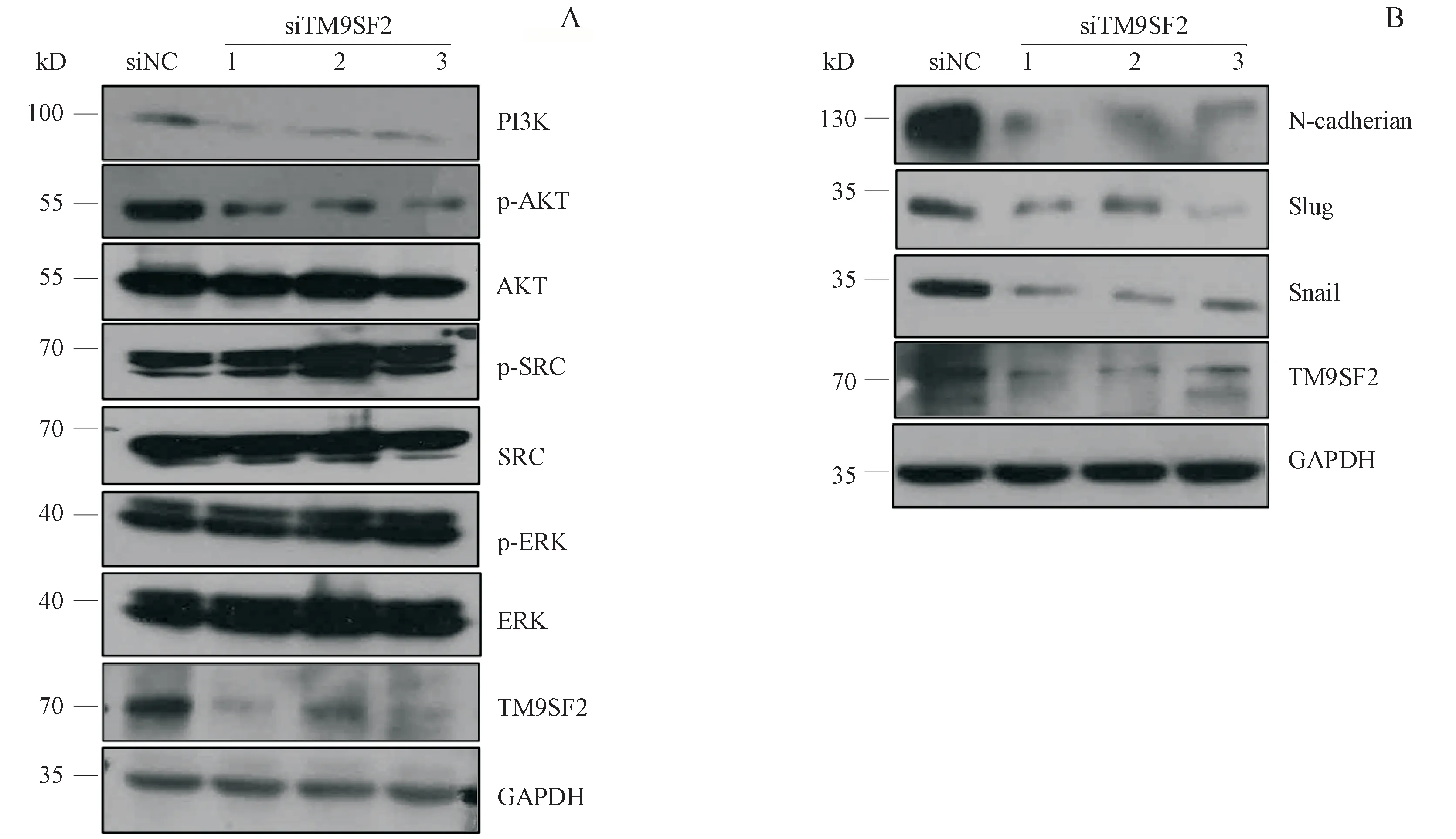
Figure 5 Effects of silencing the TM9SF2 gene on the expressions of protein related to proliferation(A)and metastasis(B)in MDA-MB-231 cell lines
TM9SF2调控三阴性乳腺癌的作用机制以及TM9SF2在肿瘤发生发展过程中起到的作用有待进一步深入研究。
