灵芝孢子糖肽对小鼠肝损伤的保护作用
2021-11-07郭青龙方伟蓉
冯 鹏,费 璇,陈 言,郭青龙,方伟蓉*
(1中科健康产业集团有限公司,南京 210008;2中国药科大学基础医学与临床药学学院,南京 211198)
肝脏作为人体最大的代谢器官,参与机体蛋白质、脂肪、维生素等营养物质的代谢过程,一旦出现受损,就可能诱发一系列代谢性疾病,甚至导致死亡[1]。肝损伤通常是肝脏暴露于高水平毒素下的结果,这些毒素可以是酒精等化学物质、药物、病毒等,这与肝脏代谢功能障碍密不可分[2]。研究表明,当肝脏出现受损,就会刺激肝细胞发生增殖和炎症反应等进行修复;当出现持续肝损伤时,可能会促进肝组织进行性纤维的形成,而炎症细胞会释放炎症因子如肿瘤坏死因子(TNF-α)、白介素1β(IL-1β)等参与调节肝脏纤维化的形成,最终导致肝硬化和肝癌[3]。近些年来,肝病的发病率随着肥胖及代谢综合征的增加而逐年攀升,但可用于肝损伤治疗的药物很少,多依据病因进行治疗,对于病毒性肝损伤多给予核苷类似物等抗病毒药物,对于药源性肝损伤多以临床对症治疗为主,虽然药物治疗以中药为主,但其作用机制仍需进一步探究[4]。
灵芝作为一味名贵中药材,以子实体入药,含有脂肪酸、多种氨基酸、三萜类、多糖类等物质。灵芝孢子糖肽(Ganoderma lucidumspore glycopeptides,GLSG)是从灵芝子实体中经蛋白酶酶解后醇提得到的糖肽,其主要成分有灵芝多糖、灵芝总三萜、灵芝多糖肽等[5]。灵芝多糖可以通过淋巴细胞和髓细胞唤起对肿瘤、病毒、细菌和真菌的免疫防御而发挥抗肿瘤作用[6],通过上调B细胞和抗凋亡蛋白而最终产生降血糖作用等[5]。另外,有学者从灵芝子实体中提取分离得到多个灵芝三萜类化合物,并发现可一定程度上抑制一氧化氮的产生而发挥抗炎效应[7]。有研究表明,灵芝多糖[8]、灵芝超微粉[9]、灵芝孢子油[10]、灵芝总三萜[11]等可以显著降低肝损伤模型小鼠血清中谷草转氨酶(AST)和谷丙转氨酶(ALT)活性,通过肝组织病理学切片观察发现模型小鼠肝组织损伤程度明显减轻。以上发现均提示灵芝中的多种有效成分具有保肝作用。
本研究建立了乙醇致小鼠急性肝损伤以及CCl4致小鼠急性和慢性肝损伤的模型,探索灵芝孢子糖肽对肝损伤的保护作用及作用机制,为灵芝孢子糖肽的进一步开发提供实验依据。
1 材料
1.1 药物与试剂
灵芝孢子糖肽(南京中科集团有限公司);水飞蓟素(silymarin)胶囊(德国MEDA Pharma GmbH& Co.KG公司);CCl4(上海中怡医疗科技有限公司);ALT测试盒、AST测试盒(南京建成生物工程研究所);小鼠IL-6、TNF-α和iNOS ELISA检测试剂盒(上海酶联生物科技有限公司)。
1.2 仪 器
电子天平(北京赛多利斯仪器系统有限公司);TGL-16型低温高速离心机(湖南湘仪实验仪器开发有限公司);酶标仪(美国Thermo公司)。
1.3 动 物
昆明种小白鼠,雄性,体重20~25 g,分别购自辽宁长生生物技术股份有限公司,生产许可证号:SCXK(辽)2020-0001,合格证编号:2107262011-00522362;河南斯克贝斯生物科技股份有限公司,生产许可证:SCXK(豫)2020-0005,合格证编号:410983201100113624;饲料:颗粒饲料,由中国药科大学动物室供给;饲养条件:恒温,18~24℃;恒湿,相对湿度70%。所有动物实验均符合动物伦理委员会标准。
2 方法
2.1 灵芝孢子糖肽的制备方法
依据文献中的提取方法并加以改良,对采收而得的灵芝孢子粉进行低温物理破壁处理;将破壁后的灵芝孢子粉进行二氧化碳超临界萃取,两次分离后,收集油脂和脱脂破壁灵芝孢子粉;将脱脂破壁灵芝孢子粉与纯净水混合后,加碱溶液调节pH至5~10;加入酶进行酶解,边搅拌边将酶解液升温至90~100℃并保温1~2 h,得到提取液,分离,收集澄清滤液;加入乙醇,静置后收集沉淀;真空低温干燥后,粉碎过筛,即得灵芝孢子糖肽粉末[12-13]。
2.2 对乙醇致小鼠急性肝损伤的影响
60只雄性昆明小鼠随机分为6组,每组10只动物:空白对照组、模型对照组、水飞蓟素组(60 mg/kg)、灵芝孢子糖肽低剂量(65 mg/kg)、中剂量(130 mg/kg)、高剂量(260 mg/kg)组。各组灌胃给予相应的药物,空白对照组和模型对照组每天灌胃等体积CMC-Na,给药体积为0.01 mL/g,每日1次,连续14 d。从灌胃给药第4天开始,给药1 h后,除空白对照组外,各组饮用水更换为5%乙醇水溶液;给药第14天上午8点至9点,除空白对照组外,其余各组均按20 mL/kg的剂量灌胃31.5%乙醇水溶液[14]。9 h后,腹腔注射水合氯醛(400 mg/kg)麻醉,摘眼球取血,静置2 h后,4℃3 500 r/min离心10 min,分离血清,测定ALT和AST含量。小鼠处死后置于冰上迅速开腹,剖取肝脏,称重记录,计算肝指数(肝湿重/体重×100%)。
2.3 对CCl4致小鼠急性肝损伤的影响
60只雄性昆明小鼠随机均分为6组:空白组、模型组、水飞蓟素组(60 mg/kg)、灵芝孢子糖肽低剂量(65 mg/kg)、中剂量(130 mg/kg)、高剂量(260 mg/kg)组。各组灌胃给予相应的药物,空白组和模型组每天灌胃等体积CMC-Na,给药体积为0.01 mL/g,每日1次,连续14 d。各组末次给药1 h后,除空白组外,其余各组均按10 mL/kg的剂量腹腔注射0.5%CCl4大豆油溶液[15]。24 h后,腹腔注射水合氯醛(400 mg/kg)麻醉,摘眼球取血,静置2 h后,4℃3 500 r/min离心10 min,分离血清,测定ALT和AST含量。小鼠处死后置于冰上迅速开腹,剖取肝脏,称重记录,计算肝指数。
2.4 对CCl4致小鼠慢性肝损伤的影响
60只雄性昆明小鼠随机均分为6组:空白组、模型组、水飞蓟素组(60 mg/kg)、灵芝孢子糖肽低剂量(65 mg/kg)、中剂量(130 mg/kg)、高剂量(260 mg/kg)组。除空白对照组外,其余所有小鼠腹腔注射0.1% CCl4大豆油溶液(10 mL/kg),每周2次,连续6周[16];各组灌胃给予相应的药物,空白和模型组每天灌胃给予等体积CMC-Na,给药体积为0.01 mL/g,每日1次,连续给药6周。24 h后,腹腔注射水合氯醛(400 mg/kg)麻醉,摘眼球取血,静置2 h后,4℃3 500 r/min离心10 min,分离血清,测定ALT和AST含量。小鼠处死后置于冰上迅速开腹,剖取肝脏,称重记录,计算肝指数。
将肝脏左叶固定、脱水、石蜡包埋、切片,苏木精-伊红(HE)染色后于光学显微镜下观察小鼠肝脏病理改变并进行病理学评分[17],肝脏剩余部分按每克肝组织加入生理盐水9 mL匀浆后,根据ELISA试剂盒方法,检测肝组织炎症因子IL-6、TNF-α、iNOS含量。
2.5 统计学方法
数据统计软件为SPSS 22.0,多组间比较方差齐性时采用单因素方差分析进行数据统计,两两比较;采用ANOVA检验,两组间比较采用t检验,P<0.05表示有统计学意义。
3 结果
3.1 灵芝孢子糖肽对乙醇致小鼠急性肝损伤的影响
与空白组相比,乙醇模型组小鼠的体重、肝指数、血清AST和ALT含量明显升高(P<0.01)。与乙醇模型组相比,灵芝孢子糖肽给药14 d,低、中、高剂量组和水飞蓟素组均可显著降低肝损伤小鼠肝指数、血清AST和ALT含量(P<0.01)。结果见表1。
Table 1 Effects of Ganoderma lucidum spore glycopeptides(GLSG)on weight,liver index,serum AST and ALT in mice with acute liver injury induced by ethanol(±s,,n=10)

Table 1 Effects of Ganoderma lucidum spore glycopeptides(GLSG)on weight,liver index,serum AST and ALT in mice with acute liver injury induced by ethanol(±s,,n=10)
AST:Aspartate aminotransferase;ALT:Alanine aminotransferase*P<0.05,**P<0.01 vs model group
Group Control Model Silymarin GLSG Dosage/(mg/kg)60 65 130 260 Liver index/%4.59±0.23**5.70±0.37 4.60±0.40**4.90±0.53**4.76±0.39**4.65±0.27**AST/(U/L)23.74±5.65**172.27±33.74 74.42±7.38**105.23±8.45**94.87±10.66**73.97±8.77**ALT/(U/L)3.11±0.96**120.42±6.36 44.83±2.81**75.88±5.35**70.33±3.05**50.45±3.56**
3.2 对CCl4致小鼠急性肝损伤的影响
与空白组相比,CCl4致急性肝损伤模型组小鼠的肝指数、血清AST和ALT含量明显升高(P<0.01)。与模型组相比,灵芝孢子糖肽低、中、高剂量组和水飞蓟素组均可显著降低小鼠的肝指数、血清AST和ALT含量(P<0.01)。结果见表2。
3.3 对CCl4致小鼠慢性肝损伤的影响
与空白组相比,CCl4致慢性肝损伤模型组小鼠的肝指数、血清AST和ALT含量明显升高(P<0.01)。与模型组相比,灵芝孢子糖肽中、高剂量组和水飞蓟素组均可显著降低小鼠肝指数和血清AST(P<0.05);灵芝孢子糖肽低、中、高 剂量组和水飞蓟素组均可显著降低小鼠血清ALT含量(P<0.05,P<0.01)。结果见表3。肝脏HE染色结果(图1)所示,空白组肝小叶结构正常,肝细胞条索样分布,无肿胀变性。模型组肝细胞肿胀,呈脂肪变性和气球样变性,炎细胞呈局灶性浸润,病理评分较空白组显著升高(P<0.01)。水飞蓟素组中肝组织可见炎性细胞灶性分布,有小部分细胞呈气球样变,病理评分较模型组显著降低(P<0.01)。灵芝孢子糖肽低、中、高剂量组则未见明显的脂肪变性,肝细胞气球样变或炎性病灶减少,病理评分较模型组显著降低(P<0.05,P<0.01)。病理评分结果见表4。与空白组相比,模型组肝组织匀浆IL-6、TNF-α和iNOS含量明显升高(P<0.01)。与模型组相比,灵芝孢子糖肽低、中、高剂量组和水飞蓟素组均可显著降低IL-6、TNF-α含量(P<0.05,P<0.01),灵芝孢子糖肽中、高剂量组和水飞蓟素组显著降低iNOS含量(P<0.01)。结果见表5。
Table 2 Effects of GLSG on weight,liver index,serum AST and ALT in mice with acute liver injury induced by CCl4(±s,,n=10)

Table 2 Effects of GLSG on weight,liver index,serum AST and ALT in mice with acute liver injury induced by CCl4(±s,,n=10)
**P<0.01 vs model group
Group Control Model Silymarin GLSG Dosage/(mg/kg)60 65 130 260 Liver index/%3.96±0.17**6.44±1.23 4.00±0.18**4.43±0.33**4.40±0.37**4.07±0.39**AST/(U/L)9.54±0.34**42.45±2.66 15.47±1.38**30.34±3.37**26.55±2.78**22.76±0.98**ALT/(U/L)2.38±1.05**55.99±4.28 3.45±0.96**25.20±2.43**10.27±0.72**3.01±0.76**
Table 3 Effects of GLSG on liver index,serum AST and ALT in mice with chronic liver injury induced by CCl4(±s,,n=10)

Table 3 Effects of GLSG on liver index,serum AST and ALT in mice with chronic liver injury induced by CCl4(±s,,n=10)
*P<0.05,**P<0.01 vs model group
Group Control Model Silymarin GLSG Dosage/(mg/kg)60 65 130 260 Liver index/%3.98±0.17**6.03±0.39 4.07±0.38*4.80±0.81 4.44±0.46*4.23±0.24*AST/(U/L)32.49±8.88**103.95±30.18 58.21±13.78*89.65±16.50 75.52±12.85*62.13±10.29*ALT/(U/L)0.75±0.27**83.54±7.74 38.40±4.06**62.54±4.17*56.42±11.04*47.37±5.25**

Figure 1 Liver histopathological characteristics of mice with chronic liver injury induced by CCl4(×200)
Table 4 Effects of GLSG on liver histopathological score in mice with chronic liver injury induced by CCl4(±s,,n=6)

Table 4 Effects of GLSG on liver histopathological score in mice with chronic liver injury induced by CCl4(±s,,n=6)
*P<0.05,**P<0.01 vs model group
Group Control Model Silymarin GLSG Dosage/(mL/kg)60 65 130 260 Score 0.00±0.00**6.50±0.55 1.33±0.42**4.17±0.31*2.00±0.37**1.50±0.22**
4 讨论
目前,临床上肝病治疗仍是一大难题。一方面,肝脏中存在大量代谢酶,参与机体营养物质的代谢过程,药物可因代谢问题在肝脏蓄积而致毒;另一方面,可用于治疗的药物十分短缺,药物治疗仍以中药及复方居多。但由于中药成分复杂,作用机制不明确,若使用不当,也可造成肝损伤[18]。因此,迫切需要寻找安全有效的治疗肝损伤的中药。
Table 5 Effects of GLSG on liver IL-6,TNF-αand iNOS in mice with chronic liver injury induced by CCl4(±s,,n=6)
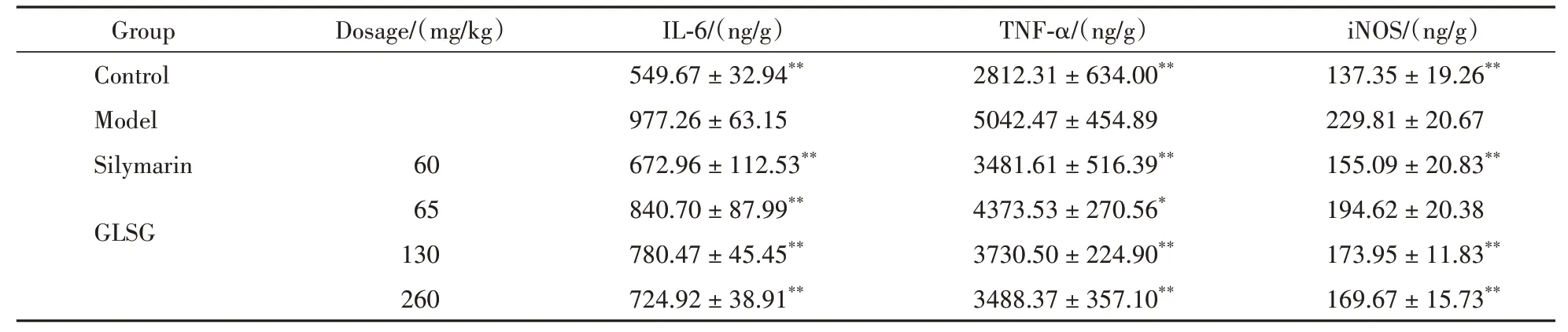
Table 5 Effects of GLSG on liver IL-6,TNF-αand iNOS in mice with chronic liver injury induced by CCl4(±s,,n=6)
*P<0.05,**P<0.01 vs model group
Group Control Model Silymarin GLSG Dosage/(mg/kg)60 65 130 260 IL-6/(ng/g)549.67±32.94**977.26±63.15 672.96±112.53**840.70±87.99**780.47±45.45**724.92±38.91**TNF-α/(ng/g)2812.31±634.00**5042.47±454.89 3481.61±516.39**4373.53±270.56*3730.50±224.90**3488.37±357.10**iNOS/(ng/g)137.35±19.26**229.81±20.67 155.09±20.83**194.62±20.38 173.95±11.83**169.67±15.73**
灵芝孢子是灵芝子实体在成熟期集中喷发后采收制备而成的棕褐色固体粉末[19],目前已被浙江、安徽等省份列入中药炮制规范品种。灵芝孢子粉及其提取物目前也是研究开发的热点之一。以灵芝孢子为原料,经过破壁脱脂、水提、醇沉等工艺制备而成的灵芝孢子糖肽[12,20],是灵芝孢子中提取富集的有效部位群,其多糖含量大于等于40%,多肽含量大于等于20%,同时包含几丁质、纤维素等成分。目前,有多篇文献报道来源于灵芝子实体的灵芝多糖肽的药理活性广泛,其针对抗肿瘤[21]、护肝[22]、心脏血管疾病预防及治疗[23]等领域,具有很好的功效,而且安全性高,未发现不良反应。灵芝孢子与灵芝子实体的活性物质相似,而且灵芝孢子糖肽与灵芝多糖肽的制备工艺高度相似。因此,可以推断灵芝孢子糖肽可能具有与灵芝多糖肽相似的药理活性,当前关于灵芝孢子糖肽的研究报道较少,值得进一步深入研究。
本研究建立乙醇致小鼠急性肝损伤以及CCl4致小鼠急性和慢性肝损伤的模型,各模型组小鼠体内肝指数、AST和ALT含量显著增加,灌胃给予低、中、高剂量的灵芝孢子糖肽显著降低3种肝损伤模型小鼠的肝指数、血清ALT和AST含量,减少肝细胞脂肪变性、炎性病灶及气球样变减少,改善肝脏组织病理学损伤。以上结果提示灵芝孢子糖肽具有保肝活性,对该品种的深入研究具有良好的市场前景。
肝损伤往往伴随炎症反应的发生,结果表明灵芝孢子糖肽可以显著降低CCl4致慢性肝损伤小鼠肝组织匀浆炎症因子IL-6、TNF-α和iNOS含量,说明灵芝孢子糖肽可能通过抑制炎症反应而降低肝损伤,从而发挥保肝作用。
本研究应用3种肝损伤模型对灵芝孢子糖肽的护肝、抗炎活性进行了基础药效学的研究,结果表明灵芝孢子糖肽可能通过抑制炎症反应发挥保肝作用,具体的分子机制仍需进一步探讨。
