Anti-PD-L1&CXCR4双特异性纳米抗体的纯化与活性
2021-11-07徐舒怡李雅贤边延林朱建伟吴明媛
徐舒怡,李雅贤,胡 海,张 莉,边延林,朱建伟,吴明媛*
(1上海交通大学药学院细胞工程及抗体药物教育部工程研究中心,上海 200240;2上海交通大学分析测试中心,上海 200240)
纳米抗体(nanobody,Nb),即重链单域抗体(variable domain of heavy chain of heavy-chain antibody,VHH),是在骆驼体内发现的一种纳米尺寸的天然抗体,相对分子质量约为15 kD,是常规抗体的十分之一[1]。纳米抗体仅含有3个互补决定区(CDR),其中CDR3区域呈明显的长环状结构,有利于与隐蔽的抗原表位结合[2]。纳米抗体的尺寸较小,可以穿过机体组织生理屏障或者狭小区域到达靶器官;具有良好的热稳定性和水溶性,可在大肠埃希菌、酵母等表达系统中大规模生产[3];同时,纳米抗体制备简单,可用于构建多种分子结构,包括具有双特异性或双功能的抗体,能够避免重链和轻链的错配,从而简化分离、纯化步骤以提高质量和产率[4],已成为抗体药物研发领域的热点。2018年,第1个纳米抗体药物Caplacizumab获欧洲药物管理局批准上市,由针对血管性血友病因子的VHH二聚体组成,用于治疗成人获得性血栓性血小板减少性紫癜(aTTP)[5]。
过去数十年中,免疫检查点抑制剂改写了肿瘤治疗的历史,将晚期肿瘤的药物治疗向前推进了一大步。免疫检查点疗法的靶点主要包括细胞毒性T淋巴细胞相关蛋白4(CTLA-4)、程序性死亡蛋白-1及其配体(PD-1/PD-L1)[6]。PD-1由活化T细胞表达,而PD-L1常在肿瘤细胞上表达。肿瘤细胞会利用其表面过表达的PD-L1,抑制T细胞的活化,引起T细胞凋亡,从而躲避免疫监视和免疫攻击[7]。拮抗负调控信号PD-1/PD-L1,有利于T细胞持续活化,杀伤或抑制肿瘤细胞生长[8-9]。目前,抗PD-1/PD-L1免疫检查点疗法的响应率仍然较低,其中肿瘤微环境中T淋巴细胞浸润不足是限制临床疗效的关键因素[10],肿瘤周围的免疫抑制性微环境也阻止了活化的淋巴细胞进入肿瘤部位[11]。有证据表明,肿瘤微环境中的趋化因子CXCL12能够支持肿瘤基质的生长,募集肿瘤相关巨噬细胞(TAM)、肿瘤相关成纤维细胞(CAF)等,形成物理屏障,保护肿瘤细胞免受药物和免疫系统的杀伤[12]。其受体CXCR4在多种肿瘤中高表达,如胰腺癌、乳腺癌和转移性结直肠癌等。CXCR4/CXCL12信号轴在肿瘤的生长、血管生成、侵袭转移和化疗耐药中起到关键作用[13],而CXCR4拮抗剂以多种作用模式影响肿瘤微环境,包括诱导免疫细胞迁移、增加效应T细胞的浸润、减少肿瘤微环境中免疫抑制细胞,提高了胰腺癌等恶性肿瘤对免疫检查点抑制剂和化疗药物的敏感性[14-15]。因此,拮抗CXCR4/CXCL12和PD-1/PD-L1的药物组合能够逆转免疫抑制性肿瘤微环境,增强了免疫系统对肿瘤细胞的杀伤效果[16]。
本研究针对PD-L1和CXCR4两个靶点,设计并构建了anti-PD-L1&CXCR4双特异性纳米抗体的重组表达载体,通过大肠埃希菌表达系统,设计不同的纯化策略,来获得纯度和产量较高的目的蛋白,体外实验证明具有特异性的双抗原结合能力和生物学活性,为进一步研究双特异性纳米抗体的抗肿瘤免疫治疗提供了依据。
1 材料
1.1 试 剂
Ficoll-Paque PLUS淋巴细胞分离液(美国GE公司);重组人白细胞介素-2(IL-2,上海华新生物高技术有限公司);小鼠抗多组氨酸标签单克隆抗体(美国Proteintech Group公司);异硫氰酸荧光素(FITC)标记的小鼠抗多组氨酸标签单克隆抗体(美国Thermo Fisher Scientific公司);小鼠抗人PDL1单克隆抗体(北京义翘神州科技有限公司);重组兔抗人CXCR4单克隆抗体(美国Abcam公司);Alexa Fluor 488标记的驴抗小鼠IgG第二抗体、Alexa Fluor 647标记的羊抗兔IgG第二抗体、过氧化物酶标记的羊抗小鼠IgG第二抗体(上海翊圣生物科技有限公司);BCA蛋白浓度测定试剂盒(碧云天生物技术有限公司);乳酸脱氢酶(LDH)杀伤活性检测试剂盒(美国Promega公司);其他试剂均为市售分析纯。
1.2 仪 器
Tanon-5200Multi凝胶成像分析系统(上海天能科技有限公司);Infinite M200 PRO多功能酶标仪(瑞士Tecan公司);Cytoflex型流式细胞仪(美国Beckman Coulter公司);蛋白分离纯化系统ÄKTA Start、HisTrap FF亲和色谱柱(美国GE公司)。
1.3 菌株和细胞株
感受态大肠埃希菌BL21(DE3)菌株(上海唯地生物技术有限公司);人白血病T淋巴细胞株Jurkat、人神经胶质瘤细胞株U251-MG、人转移胰腺癌细胞株AsPC-1购自中科院上海生命科学研究院细胞资源中心;健康志愿者外周血由上海长海医院输血科提供。
2 方法
2.1 重组表达质粒的构建和转化
anti-PD-L1和anti-CXCR4的纳米抗体基因序列均由文献获得[17-18],两部分由linker(3个G4S短肽)连接起来,C端加入多组氨酸标签(6×His标签),组装为anti-PD-L1&CXCR4双特异性纳米抗体(简称为BsNb PX4)的基因序列。将该基因序列转入到pET-22b(+)载体中,酶切位点为NcoⅠ与EcoRⅠ,构建BsNb PX4的重组质粒,以上均由南京金斯瑞公司合成。
2.2 目的基因的诱导表达
将重组表达质粒pET22b-BsNb PX4转化E.coliBL21(DE3),筛选阳性克隆并抽提质粒,经过DNA测序确认。接种于含氨苄青霉素(Amp)的LB培养基5 mL中,37℃,220 r/min摇床培养过夜后全部转接至含Amp的TB培养基500 mL,继续培养至菌液A600达到0.6~0.8,加入IPTG至终浓度为0.1 mmol/L,25℃诱导18 h后收集菌液。
2.3 anti-PD-L1&CXCR4双特异性纳米抗体的纯化
离心收集菌液500 mL,向菌体沉淀加入破菌缓冲液(PBS)25 mL,冰浴超声重悬,高压匀质仪多次循环充分破碎菌体,即机械裂解法破菌;或向菌体沉淀加入高浓度蔗糖-三羟甲基甲胺基乙磺酸(TES)溶液25 mL,冰上充分振摇1 h后,再加入原浓度1/4的蔗糖-TES溶液50 mL,继续冰浴振摇45 min,即低温渗透压休克法提取周质空间蛋白。菌体裂解后的样品12 000 r/min,4℃,离心30 min,收集上清液。菌体裂解后上清液通过亲和色谱纯化,结合缓冲液(pH 7.4)平衡HisTrap FF柱,上样结束后用洗脱缓冲液进行分部梯度洗脱,收集洗脱峰。菌体裂解方式、裂解缓冲液、结合缓冲液和洗脱缓冲液如表1所示。

Table 1 Cell disruption techniques and buffers of 3 purification methods
考马斯亮蓝R-250染色和Western blot对洗脱峰样品进行鉴定。将目的蛋白在4℃透析24 h,去除咪唑;使用超滤离心管,4 000 r/min,4℃,离心30 min,浓缩蛋白,使用BCA试剂盒测定蛋白浓度。
2.4 anti-PD-L1&CXCR4双特异性纳米抗体的抗原结合能力分析
分别取对数生长期的悬浮细胞Jurkat和贴壁细胞U251-MG、AsPC-1,用含2%FBS的PBS溶液重悬洗涤2次,1 200 r/min离心5 min。吸弃上清液,加入含2%FBS的PBS溶液200µL重悬细胞,分别在细胞样品中加入BsNb PX4 1µg作为一抗,FITC标记的小鼠抗多组氨酸标签单克隆抗体作为荧光二抗,分别选用小鼠抗人PD-L1单克隆抗体与重组兔抗人CXCR4单克隆抗体作为阳性对照的一抗,Alexa Fluor 488标记的驴抗小鼠IgG第二抗体、Alexa Fluor 647标记的羊抗兔IgG第二抗体作为对应的荧光二抗。4℃避光孵育30 min后,用PBST洗涤2次,重悬于2%FBS的PBS溶液,终体积为100µL。流式细胞仪检测肿瘤细胞PD-L1和CXCR4的抗原表达情况,分析BsNb PX4的抗原结合能力。
2.5 anti-PD-L1&CXCR4双特异性纳米抗体的生物活性检测
2.5.1 人外周血单核细胞(PBMC)的分离 取新鲜健康志愿者外周血,与DPBS按1∶7比例稀释混匀后,加入到Ficoll-Paque PLUS淋巴细胞分离液,1 200 r/min,20℃梯度离心30 min,吸取中间白雾层,分别用DPBS和含10%FBS的RPMI 1640培养基洗涤两次,调整细胞浓度至每毫升1×106个细胞备用。
2.5.2 LDH法检测PBMC对胰腺癌细胞的杀伤将生长状态良好的胰腺癌细胞AsPC-1用0.25%的胰酶消化、计数,用含10% FBS的RPMI 1640培养基重悬,调整细胞浓度为每毫升3×104个细胞。将AsPC-1细胞均匀铺于96孔板,每孔100µL,置于37℃,贴壁培养12 h。取新鲜分离的人PBMC用含10%FBS的RPMI 1640培养基重悬,调整细胞密度,铺于96孔板,每孔50µL,使效应细胞与靶细胞的比例为10∶1或15∶1,共培养24 h,然后加入IL-2(工作浓度100 IU/mL),置于37℃培养箱,继续培养24 h。BsNb PX4分别用含2% FBS的RPMI 1640培养基稀释,每孔加入50µL,终浓度为0.5µmol/L,对照组加入等体积含2% FBS的RPMI 1640培养基,继续孵育48 h。检测前,在靶细胞最大释放组中添加10%Triton X-100裂解液,每孔20µL,置于37℃培养箱继续孵育20 min。水平离心后,转移上清液50µL至全新的96孔板中,每孔加入LDH基质液50µL,室温孵育20 min,每孔加入终止液50µL终止反应并记录A490。
杀伤率(%)=(实验组吸收度-效应细胞释放组吸收度-靶细胞释放组吸收度)/(靶细胞最大释放组吸收度-靶细胞释放组吸收度)×100。
2.6 统计学处理
应用SPSS 23.0统计软件对实验数据进行单因素方差分析(One-Way ANOVA),组间比较采用Tukey检验,实验数据以±s,表示,P<0.05具有统计学意义。
3 结果
3.1 anti-PD-L1&CXCR4双特异性纳米抗体的构建和表达
如图1-A所示,选取pET-22b载体,构建anti-PD-L1&CXCR4双特异性纳米抗体的重组质粒,由上海生工生物工程技术服务有限公司测序,序列正确。anti-PD-L1&CXCR4双特异性纳米抗体基因序列全长1 263 bp,编码421个氨基酸,相对分子质量为43.8 kD。
将测序正确的重组表达质粒pET22b-BsNb PX4转化E.coliBL21(DE3),TB培养基用于菌体扩增和蛋白表达。当菌液A600为0.6~0.8时,加入IPTG诱导目的蛋白表达。将诱导培养18 h的重组大肠埃希菌破碎处理,经SDS-PAGE和Western blot检测,如图1-A和图1-B所示,诱导后的全菌液在44 kD附近出现条带,符合预期产物的相对分子质量大小,并且能与抗多组氨酸标签单克隆抗体特异性地结合,说明anti-PD-L1&CXCR4双特异性纳米抗体能够在大肠埃希菌中经IPTG诱导表达。
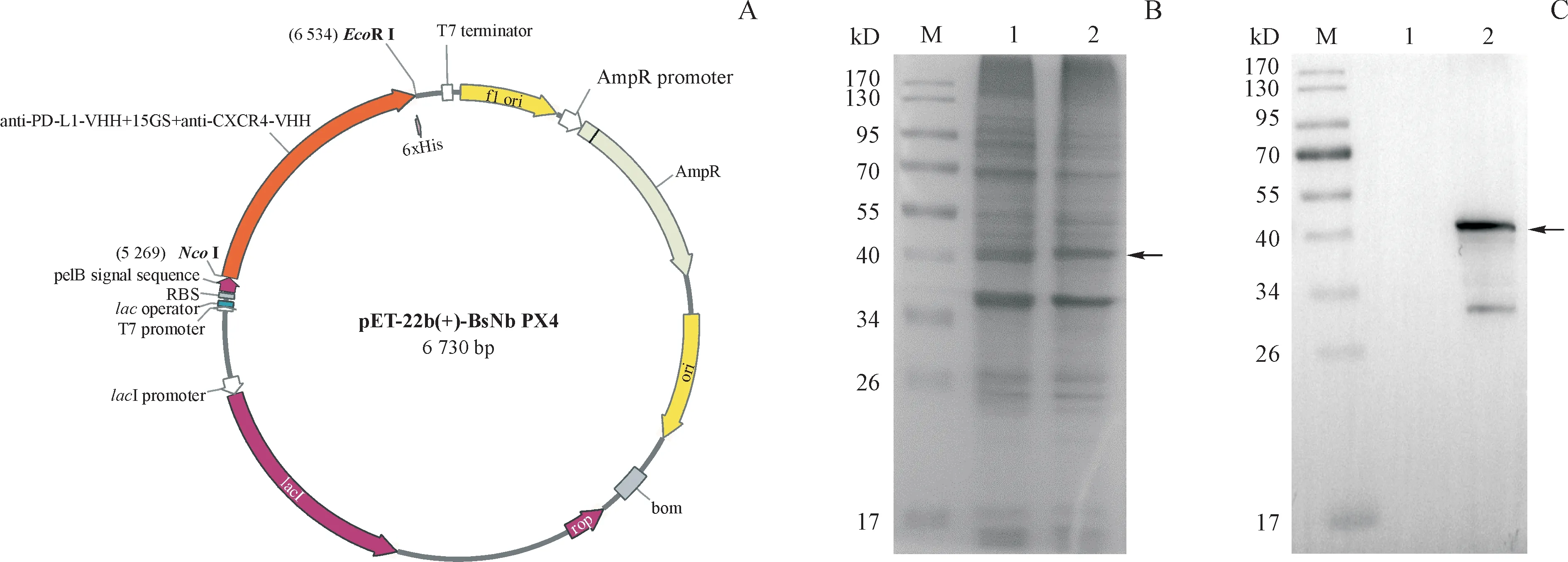
Figure 1 Construction and expression of recombinant protein
3.2 anti-PD-L1&CXCR4双特异性纳米抗体的亲和纯化
如图2-A所示,采用方法(1)纯化后的色谱图谱共出现6个峰,经SDS-PAGE证实前4个峰所得到的样品杂蛋白较多,但在50%和100%洗脱缓冲液(图中以50% B和100% B表示)中,得到相对分子质量约44 kD的目的条带,纯度较高,基本无杂质被洗脱。如图2-B所示,含目的蛋白的上清液经方法(2)进行亲和色谱,在用20%洗脱缓冲液洗脱时,BsNb PX4被大量洗脱且洗脱峰独立,杂蛋白含量较少。如图2-C所示,方法(3)只出现一个洗脱峰,但与方法(2)相比,20%洗脱缓冲液的洗脱峰显示有多个杂带。因此,收集方法(1)的50%和100%洗脱缓冲液的洗脱峰,分别合并方法(2)和方法(3)的20%洗脱缓冲液的洗脱峰各管样品,透析去除咪唑,超滤浓缩。

Figure 2 Affinity purification process of BsNb PX4
SDS-PAGE和Western blot检测透析后得到的目的蛋白相对分子质量和特异性,如图3所示,在44 kD出现特异性条带,与预期的双特异性纳米抗体相对分子质量相符。但是在30 kD左右存在一条杂带,推测其为C端带有多组氨酸标签的anti-CXCR4-VHH(二价纳米抗体),可能是双特异性纳米抗体表达分泌过程中由宿主蛋白酶降解得到的产物。
用BCA法对3种目的蛋白进行定量分析,结果如表2所示,方法(1)获得的BsNb PX4产量约1.12 mg/L,凝胶成像系统扫描显示目的蛋白纯度在97%以上;方法(2)获得的BsNb PX4产量约1.34 mg/L,纯度接近90%;方法(3)获得的BsNb PX4产量约7.0 mg/L,但样品中仍含有较多的杂蛋白。因此,后续选择方法(1)制备得到纯度最高的BsNb PX4进行抗原结合和体外生物学活性检测。
3.3 anti-PD-L1&CXCR4双特异性纳米抗体的抗原结合能力
流式分析双特异性纳米抗体结合抗原的能力,如图4所示,U251-MG细胞株针对PD-L1抗原显示出明显的荧光信号偏移,呈高阳性表达,而兔抗人CXCR4 IgG抗体和羊抗兔IgG-FITC荧光抗体组合相较于单染羊抗兔IgG-FITC荧光抗体的阴性对照并无变化;Jurkat细胞株为CXCR4阳性细胞株,在静息条件下其细胞膜表面PD-L1抗原无表达,实验结果与文献报道一致[19]。

Figure 3 SDS-PAGE and Western blot detection of the dialyzed main elution peak sample

Table 2 Yield and purity of products obtained by 3 purification methods
由于双特异性纳米抗体带有6×His标签,可用FITC偶联的anti-6×His标签抗体作为荧光标记。如图5所示,BsNb PX4在U251-MG细胞上(PD-L1+、CXCR4-)均能够检测到与PD-L1分子结合后产生的荧光信号偏移;在Jurkat细胞上(PDL1-、CXCR4+)也具有与CXCR4抗原的结合能力,证实了纯化得到的双特异性纳米抗体对两个靶点均具有结合活性。此外,BsNb PX4与同时表达PD-L1和CXCR4抗原的AsPC-1细胞也有较为明显的结合。

Figure 4 Detection of PD-L1 or CXCR4 expression in tumor cell line by flow cytometry
3.4 anti-PD-L1&CXCR4双特异性纳米抗体的抗肿瘤活性
在anti-PD-L1&CXCR4双特异性纳米抗体0.5µmol/L条件下,PBMC与靶细胞AsPC-1继续孵育48 h后进行LDH释放检测,分析PBMC对AsPC-1细胞的杀伤效应。如图6所示,与空白对照组相比,BsNb PX4单独作用于共孵育体系,PBMC的杀伤活性有所增强,推测可能是双特异性纳米抗体识别了PBMC中T细胞表面的CXCR4,同时与AsPC-1细胞上的PD-L1结合,可以将效应T细胞募集到肿瘤细胞周围,增强其细胞毒性[20]。另一方面,当PBMC与AsPC-1细胞数之比为10∶1和15∶1时,BsNb PX4联合IL-2能够显著提高PBMC对肿瘤细胞的杀伤,与IL-2组相比有统计学差异,具有协同效应。这些结果与文献结论是相符的,IL-2可刺激CD8+T细胞、NK细胞等扩增,同时细胞表面的PD-L1表达增高,证明其与PD-L1抑制剂具有潜在协同作用机制[21];而通过抑制CXCR4可以导致CD8+T细胞迁移到癌细胞富集的区域,然后阻断PD-1/PD-L1通路能够重新激活对癌细胞的杀伤作用,以上表明PD-1/PD-L1和CXCR4/CXCL12轴的联合阻断有望成为胰腺癌的新型治疗策略[22]。

Figure 5 FACS analysis of BsNb PX4 binding to tumor cells

Figure 6 In vitro cytotoxicity of peripheral blood mononuclear cells(PBMC)with IL-2 and BsNb PX4 treatment using lactate dehydrogenase(LDH)released assay(±s,,n=3)
4 讨论
在本研究中设计的anti-PD-L1&CXCR4双特异性纳米抗体基因上游含有编码细菌pelB蛋白的信号肽序列,可引导融合蛋白分泌至大肠埃希菌的周质空间中,并以可溶形式存在;通过改变破菌提取蛋白的方法,调整纯化缓冲溶液中盐离子浓度和咪唑浓度,使用3种不同方法对BsNb PX4进行纯化,以纯度为判断标准,确定了合适的纳米抗体制备方案。治疗性抗体的工艺相关杂质(宿主细胞蛋白质等)不仅影响药物的稳定性和活性,而且还可能导致有害的免疫反应[23]。因此,抗体的纯化条件必须优化,例如采用分部或者线性梯度洗脱、确定结合和洗脱过程中合适的盐离子浓度和pH。在用亲和色谱纯化His标记的蛋白质时,通常将咪唑添加到结合缓冲液中以调节非特异性结合。但是,在分析亲和色谱图和洗脱峰的SDSPAGE电泳结果后,发现方法(1)将结合缓冲液更换成不含咪唑的低浓度NaCl溶液,同时在洗脱缓冲液中增加咪唑的含量并提高溶液的pH,通过分部梯度洗脱可以将目的蛋白和杂质几乎完全分开,BsNb PX4的最终纯度达到97%以上。对比同样使用机械裂解法提取蛋白的方法(3),降低结合缓冲液中的咪唑和盐离子浓度可能提高了目的蛋白的挂柱率,而洗脱液的pH和咪唑浓度影响了目的蛋白的洗脱效果,导致不同方法获得的BsNb PX4纯度有明显区别。方法(2)中高浓度蔗糖-TES溶液介导的低温渗透压休克法提取蛋白,虽然出峰过程简单,产量相近,但目的蛋白的纯度下降至87%,后续仍需增加离子交换或分子筛色谱处理,过程相对繁琐。
因此,方法(1)得到的anti-PD-L1&CXCR4双特异性纳米抗体纯度满足了临床前的研发要求,流式检测证明其与细胞表面的两个靶抗原特异性结合,说明该结构的双特异性纳米抗体能够正确折叠形成抗原结合域并保持分子完整性。同时,生物学活性结果也表明洗脱条件温和,不会导致目的蛋白失活。该方案的设计是一步纯化法,具有操作简单,成本低等优点,也适用于含His标签等多种类型的蛋白质纯化,具有广泛的应用价值。
当然,在纳米抗体的纯化过程中也存在诸多问题,如产量和回收率还相对较低。如何在保证高纯度的前提下实现抗体产量的最大化,一直是生物制药领域的难题,需要进一步摸索和优化工艺。此外,双特异性纳米抗体增强PBMC对肿瘤细胞杀伤效应的机制也亟待深入探究和验证。
