抗氧化物原花青素对人未成熟卵母细胞体外成熟的影响
2021-11-06易疆莺滕文顶王芳王雪梅鲜红张攀
易疆莺,滕文顶,王芳,王雪梅,鲜红,张攀
体外受精-胚胎移植(in vitro fertilization-embryo transfer,IVF-ET)是目前治疗不孕症的主要手段。对于一些特殊原因的不孕患者,如多囊卵巢综合征(polycystic ovarian syndrome,PCOS)、高龄妇女及卵巢早衰患者,其不成熟卵母细胞占比更高,如何将未成熟卵母细胞体外成熟(in vitro maturation,IVM)培养使其具有受精和发育潜力,是广大研究者一直探讨的热点[1-4]。IVM技术虽然很早就运用于临床治疗,但尚未达到真正的成熟阶段,与正常体内成熟的卵母细胞相比,IVM卵母细胞受精后的胚胎发育潜力较低。影响IVM的因素很多,其中活性氧(reactive oxygen species,ROS)是主要因素之一。ROS是一种强氧化剂,能破坏一系列的大分子物质从而引起氧化性损伤导致胚胎发育停滞甚至死亡。原花青素是一种主要在葡萄皮、葡萄籽和绿茶中被发现的类黄酮物质,作为天然的抗氧化物,被广泛应用于食品、制药和化妆品行业[5]。研究表明,原花青素的氧自由基吸收能力远强于维生素C和维生素E[6],能够明显降低自由基诱导的DNA损伤,保护细胞免受氧化应激反应的影响,从而提高其发育潜能。但有关原花青素对人类卵母细胞IVM及胚胎发育的影响鲜有报道。本研究通过在IVM培养液里添加原花青素以培养卵胞浆内单精子注射(intracytoplasmic sperm injection,ICSI)周期中人未成熟卵母细胞,探讨原花青素能否改善人未成熟卵母细胞IVM及胚胎发育潜能,为 IVM 培养体系的优化和临床应用奠定基础。
1 资料与方法
1.1 资料来源
选取2019年1月至2020年12月在成都市妇女儿童中心医院生殖健康与不孕症科进行ICSI治疗周期321例。纳入标准:夫妇染色体正常,控制性促排卵采用黄体中期长方案,卵丘卵母细胞复合物经剥除颗粒细胞后镜下观察确定为未成熟卵母细胞,且每周期获卵数大于5枚、不成熟卵母细胞占比小于30%;排除内分泌疾病(高泌乳素血症、甲状腺功能异常、糖尿病等)、传染病及吸烟、酗酒、吸毒等不良嗜好。共收集未成熟卵母细胞(GV和MI)837枚,随机分为对照组和原花青素组。对照组和原花青素组患者在平均年龄、不孕年限、不育因素及超排卵方案等方面比较,差异均无统计学意义(P>0.05),详见表1。ICSI注射精子来源于我院因单纯女方因素行IVF-ET周期的男性患者,精液量约2~6 mL,浓度约60×106/mL,活率≥70%,活力(a+b)≥55%。本研究所用未成熟卵母细胞及精液经患者充分知情后自愿捐献,并经医院伦理委员会讨论批准(审查号:科研伦理预审【2020】46),所有患者均签署知情同意书。
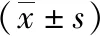
表1 两组患者一般资料比较
1.2 方法
1.2.1 体外成熟培养液的制备 IVM基础培养液(成都艾伟孚生物科技有限公司),原花青素(Sigma,USA)溶于蒸馏水中,配制 10 mM 储备液。对照组:在基础IVM 培养液中加入0.075 IU/mL卵泡刺激素(follicle-stimulating hormone,FSH)和0.075 IU/mL黄体生成素(luteinizing hormone,LH);原花青素组:在基础IVM培养液中加入0.075 IU/mL FSH、0.075 IU/mL LH和20 μM的原青花素储备液。
1.2.2 未成熟卵母细胞的获得 所有研究对象 ICSI周期均采用黄体中期长方案控制性促排卵。当至少1个主导卵泡直径>20 mm 或 3 个达 18 mm 时,注射人绒毛膜促性腺激素(human chorionic gonadotropin,hCG)8 000~10 000 U,36~37 h后经阴道超声引导下穿刺取卵。收集患者的卵母细胞,在37 ℃,6% CO2的培养箱中预培养2~4 h后,用透明质酸酶去除卵母细胞周围的颗粒细胞,收集未成熟的卵母细胞(包括MI期和GV期)用于本研究。
1.2.3 未成熟卵母细胞的体外成熟和胚胎培养 采用微滴培养,50 μL/滴,1枚/滴,各组培养液在使用前提前一天配制置于37℃,6% CO2的培养箱中平衡过夜。将不成熟卵母细胞(包括MI期和GV期)随机分配到两组培养液里培养,在对照组培养液里,GV期卵母细胞208枚,MI期卵母细胞198枚;在原花青素组培养液里,GV期卵母细胞221枚,MI期卵母细胞210枚。于 37℃ 6% CO2培养箱中培养24 h后倒置显微镜下观察卵母细胞形态,以第一极体排出为卵母细胞成熟的标志。GV期卵母细胞:可见生发泡;MI期卵母细胞:生发泡破裂消失,第一极体尚未排出;MII期卵母细胞:已排出第一极体。对成熟卵母细胞(MII期卵母细胞)按我院常规行ICSI,ICSI 操作后置于Vitrolife卵裂期培养液(Vitrolife,Sweden)中培养,16~18 h后进行受精观察,48 h及72 h后分别进行卵裂期胚胎观察评级。受精后约72 h将胚胎转入囊胚培养液(Vitrolife,Sweden)中继续培养,96~120 h 后观察囊胚形成情况。
1.2.4 相关评价标准 ICSI后48 h和72 h卵裂期胚胎评级参考2009年Racowsky等[7]将细胞数、碎片、卵裂球均一度3个指标整合在一起的评级形式,在胚胎发育速度正常的前提下形态学评分标准为:Ⅰ级:细胞大小均匀,形状规则,透明带完整,胞质均清晰,无颗粒及多核现象,碎片<5%;Ⅱ级:细胞大小略不均匀,形状略不规则,透明带完整,胞质可有颗粒,碎片<20%;Ⅲ级:细胞大小明显不均匀,可有明显的形状不规则,胞质可有颗粒现象,碎片<50%;Ⅳ级:细胞大小严重不均,胞质可有严重颗粒现象,碎片≥50%。Ⅰ级与Ⅱ级胚胎为优质胚胎,Ⅰ级、Ⅱ级和Ⅲ级胚胎为可利用胚胎。
囊胚期胚胎观察、分期和评级参照1999年Gardner等[8]分期和评分:D5或D6对3、4、5、6期囊胚进行评级,1期和2期不评级。内细胞团(inner cell mass,ICM)评级:A-ICM包裹紧密,很多细胞;B-ICM细胞较分散,仅少数细胞;C-ICM很少细胞;滋养层评级:A-很多细胞形成连续的上皮;B-较少的细胞形成疏松的上皮;C-仅很少几个大细胞。
参照“人类辅助生殖技术胚胎实验室数据质控专家共识”,ICSI受精率=(2PN卵子数+1PN卵子数+多PN卵子数)/注射卵子总数×100%;可利用胚胎率=可利用胚胎数/卵裂胚胎数×100%;囊胚形成率=2期及2期以上囊胚数/行囊胚培养的卵裂期胚胎总数×100%。
1.2.5 荧光染色 对两组孵出囊胚的胚泡用荧光染料Hoechst33342进行染色,参照Pursel等[9]的方法进行细胞核计数,比较两组中胚泡细胞总数的差异。
1.3 数据统计分析
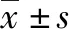
2 结果
2.1 两组GV期卵母细胞体外成熟及发育情况比较
原花青素组的成熟率、可利用胚胎率、囊胚形成率均比对照组显著提高,差异均有统计学意义(P<0.05),但两组受精率、卵裂率比较,差异无统计学意义(P>0.05)。详见表2。
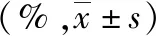
表2 两组GV期卵母细胞体外成熟及发育情况比较
2.2 两组MI期卵母细胞体外成熟及发育情况比较
原花青素组的成熟率、可利用胚胎率、囊胚形成率均比对照组显著提高,两组差异均有统计学意义(P<0.05),但两组受精率、卵裂率比较,差异无统计学意义(P>0.05)。详见表3。
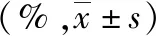
表3 两组MI期卵母细胞体外成熟及发育情况比较
2.3 两组胚泡总细胞数荧光染色比较
胚泡经Hoechst33342染色后,在Nikon荧光显微镜下进行细胞记数。结果显示,不论是GV期还是MI期卵母细胞,原花青素组孵化囊胚细胞总数均高于对照组,差异有统计学意义(P<0.05)。详见表4。
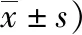
表4 两组囊胚胚泡细胞总数比较(个,
3 讨论
辅助生殖技术中促排卵的目标是诱发多卵泡发育,在不引起卵巢过度刺激综合征(ovarian hyperstimulation syndrome,OHSS)的前提下获得适量的成熟卵母细胞。卵母细胞IVM培养作为一项新的辅助生殖助孕技术,不仅能够提高IVF和ICSI技术中未成熟卵母细胞的利用率,而且对于PCOS的不孕患者而言,还能够减少OHSS的发生率,是一种治疗PCOS不孕症的有效方法[10-11]。同时对于赠卵、女性肿瘤及癌症患者的生育力保存,提供了更多的方法及保障,具有较好的发展前景[11-13]。卵母细胞成熟包括细胞核成熟和细胞质成熟两方面。生发泡破裂,同源染色体分裂,卵周间隙出现及第一极体排出是细胞核成熟的标志。细胞完成蛋白的磷酸化及去磷酸化以及细胞器的重新排列是细胞质成熟的标志。卵母细胞成熟过程受多种因素的影响,然而传统生殖技术与体内自然状态下卵母细胞的成熟环境不同,未成熟卵母细胞在体外成熟率、受精率、优质胚胎率及妊娠率等方面存在不足,所以还需要更多的研究来进一步提高未成熟卵母细胞体外的成熟率,增加其利用率,为辅助生殖患者提供更多的可利用胚胎,提高累计妊娠率。
与体内自然状态卵母细胞及胚胎的成熟环境相比,体外的培养环境氧分压比较高,会导致ROS的生成增加,ROS是氧的衍生分子,属于强氧化剂,能与任何分子发生氧化反应,从而改变后者的结构与功能[14]。在体内存在着有效去除ROS的酶促机制和非酶促机制,但在体外缺乏这样的保护机制,因而造成了氧化应激反应的发生。氧化应激是一种不平衡状态,当机体抗氧化防御能力与ROS产量之间不平衡时,就会产生氧化应激[15]。因氧化应激与脂质、蛋白质及DNA损伤有关[16],有可能导致卵母细胞基因表达异常,影响细胞核和细胞质成熟,造成卵母细胞成熟阻滞,使受精率和发育能力下降,进而引起胚胎发育不良、流产、出生缺陷及儿童期癌症[17-20],所以备受研究者的广泛关注。在培养液中加入抗氧化剂可以减少氧化应激损伤,Zavareh 等[21]在培养液中加入a-硫辛酸,降低了ROS含量,提高了抗氧化能力,促进了卵母细胞IVM。Mokhber 等[22-23]的研究结果表明,适宜浓度的藏红花素(100 g/mL)及藏红花水提取物(40 g/mL)可以增加谷胱甘肽浓度,保护卵母细胞,显著提高卵母细胞成熟率和受精率。Paula-Lopes等[24]认为体外培养过程中过量氧自由基的产生是造成胚胎体外囊胚发育率低的主要原因。Truong等[25]研究认为,在卵母细胞及胚胎的培养液中添加抗氧化物质,能够提高其培养效率。胚泡的平均细胞数是决定胚胎能否在子宫内膜着床并继续发育的主要因素。如何降低自由基诱导的DNA损伤以保护细胞不受氧化应激作用,找到优化IVM技术的突破点,对抗氧化物质的研究就成为了热点。
原花青素是一种抗氧化物质,本研究中,为确定抗氧化物质原花青素对人未成熟卵母细胞IVM、受精及胚胎发育的影响,我们在人未成熟卵母细胞IVM培养液中添加20 μM的原花青素,结果显示无论对于GV期还是MI期卵母细胞,原花青素均能显著提高其体外成熟率、增加可利用胚胎率及囊胚形成率,且原花青素组孵化囊胚细胞总数显著高于对照组,这与Awaga等[26]在不育男性精液中添加原花青素有助于精子体外培养的研究结果一致。原花青素能显著提高人类卵母细胞体外成熟率及胚胎的体外发育潜能,其原因可能是原花青素通过阻止或减少过氧化反应链中游离氧自由基的形成使氧化链中断,从而阻止细胞膜中脂质的过氧化和由此引起的一系列损害进而抑制其凋亡来实现的。
综上所述,本研究的结果表明原花青素是一种有效的抗氧化物质,添加原花青素能够促进人类卵母细胞IVM,提高胚胎的体外发育潜力,增加胚泡细胞总数,为进一步优化体外培养体系提供了重要线索,具有一定的临床应用价值。我们将扩大样本量进一步探讨其对 IVM 临床妊娠率及后代安全性等方面的影响,对开发新的 IVM培养液及改善 IVF 临床结局有重要意义。
