蒸发材料用高纯金的制备研究
2021-11-06赵家春阳岸恒吴跃东童伟锋裴洪营董海刚
赵家春,阳岸恒,吴跃东,朱 勇,童伟锋,裴洪营,董海刚
(昆明贵金属研究所,贵研铂业股份有限公司稀贵金属综合利用新技术国家重点实验室,昆明 650106)
高纯金是电子行业如集成电路、半导体器件等的重要蒸发镀膜基础材料之一。随着集成电路产业的不断发展,金蒸发材料要求金的纯度(质量分数,下同)在99.999%以上,且要保证材料的清洁性。因此,合格的高纯金原料的制备十分重要[1-3]。目前,高纯金的制备方法有电解法、溶剂萃取法和化学还原法等[4-8]。
电解法包括粗金在阳极上的溶解和纯金在阴极上的析出,在适合的条件下可制备出纯度大于99.999%的高纯金。不足之处是生产周期长,对原料适应性差,积压资金。化学还原法是将粗金用王水或者氯气、盐酸等溶解,然后用还原剂选择性还原金,可制备出纯度大于99.999%的高纯金,生产周期短,原料适应性强,适用于各种规模生产。萃取法通常将金原料溶解造液,再用萃取剂萃取,反萃后,再经过还原,得到高纯金。萃取剂多为有机溶剂,存在安全生产及环保问题。
前期本课题组采用电解法制备的高纯金作为原料加工成蒸发材料分析测试后,蒸发材料的清洁性差,表面有黑色污染物,碳等杂质含量高,达不到集成电路芯片制造用金蒸发材料要求。结合化学还原法的特点,本文提出采用盐酸+氯酸钠溶解-沉淀除杂-还原-洗涤联合工艺制备蒸发材料用高纯金并进行应用性能分析。
1 实验部分
1.1 基本原理
在盐酸+氯酸钠溶液溶金的过程中,金及杂质金属转化为配离子或离子形式进入溶液。溶液添加氢氧化钠调整pH值,使杂质生成氢氧化物沉淀除去;除杂后的金溶液加入还原剂S还原,得到的金粉用硝酸盐酸煮洗、去离子水洗涤至中性,干燥后,得到99.999%高纯金产品。可能发生的化学反应如下:
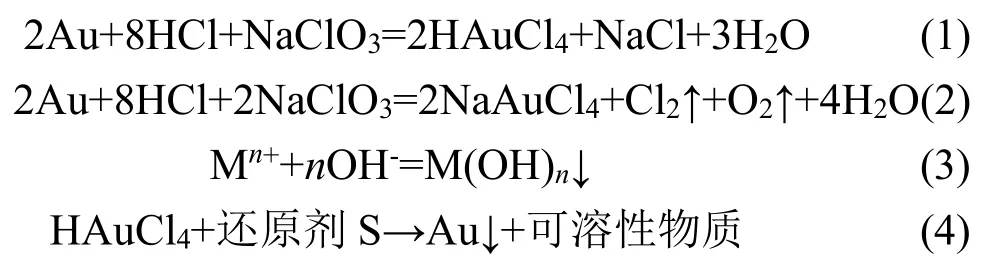
1.2 实验原料及流程
实验所用的原料为贵研铂业股份有限公司提供的标准金锭,金纯度99.95%,其他试剂包括硝酸、盐酸、氢氧化钠、还原剂S均为优级纯试剂,去离子水电阻率不小于18兆欧。实验流程如图1所示。主要包括溶解造液、沉淀除杂、还原、洗涤等过程。

图1 实验流程Fig.1 Experimental flowchart
2 结果与讨论
2.1 高纯金制备
2.1.1 金的溶解
传统王水溶金过程容易产生有害的NOx,污染环境,同时还需要进行赶硝操作。本研究采用盐酸+氯酸钠溶液溶解金,方法简单,原料适应性强,劳动条件较好。此过程需要控制氯酸钠的加入量及速度、反应温度等,最好在通风橱中用密闭容器进行溶解,以避免氯气溢出。具体操作:将金锭轧成厚度<0.5 mm的薄片,剪成10 mm×10 mm的方形。取100 g置于2000 mL三颈瓶中,加入500 mL 6 mol/LHCl,加热至70℃,搅拌,将800 mL 200 g/L氯酸钠溶液在4 h内缓慢加入反应器中,继续保温1 h,充分溶解,过滤洗涤,获得金溶液A,定容溶液体积2 L,测定该金溶液杂质成分,结果列于表1。

表1 金溶液主要杂质含量Tab.1 Impurity contents in the gold solution /(mg/L)
由表1可以看出,溶液中杂质金属主要为Fe、Sn、Al、Co、Cu等,含量较高,尚不能直接用于制备高纯金,需要通过一定的除杂处理,去除杂质元素,才可能获得高纯金。
2.1.2 沉淀除杂
盐酸+氯酸钠氧化溶解得到的金溶液中,杂质金属离子均以高价态形式存在,例如Fe3+、Sn4+、Al3+、Co3+、Cu2+等。因此,选择采用氢氧化钠进行沉淀除杂,此过程的关键是选择合适的pH值范围,确保杂质金属离子能够有效沉淀。结合氢氧化物沉淀的溶度积常数Kosp(如表2所列)、溶液中杂质金属离子的浓度,可以为沉淀过程pH值的选择提供理论指导。
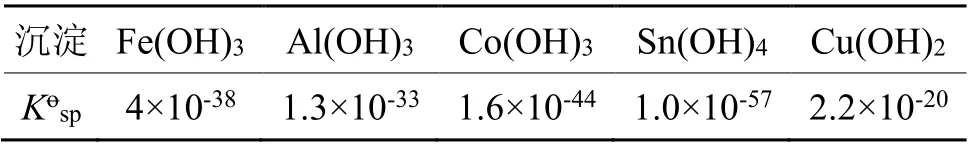
表2 几种氢氧化物沉淀的溶度积常数(20℃)Tab.2 Kospof several hydroxide precipitations (20℃)
氢氧化物沉淀溶度积常数和pH分别为:

根据金溶液中杂质金属离子的浓度,利用式(1)可以计算出氢氧化物沉淀在溶液中达到沉淀溶解平衡时的OH-浓度;再通过式(2)计算出杂质金属离子沉淀时的pH值,结果见表3。

表3 金属离子沉淀时的pH值(20℃)Tab.3 pH value of metal ions as precipitation(20℃)
由表3可以看出,控制沉淀过程溶液体系pH值为3,可以有效分离Fe、Sn、Co等杂质。对于酸性金溶液,若沉淀除杂时选择溶液pH值过高,就需要添加大量的氢氧化钠,且溶解得到的金溶液中钠离子浓度较高,过多的钠离子会影响后续金粉的质量。因此,沉淀过程选择保持溶液pH值为3。同时,由于溶液中杂质金属离子浓度低,生成的沉淀微粒极细,容易穿滤;通过静置足够的时间,使微细粒级沉淀粒子聚集,达到过滤分离的要求,然后采用微孔滤膜微负压抽滤,有效分离杂质沉淀。具体操作为:将金溶液A加入10%氢氧化钠溶液,调整溶液体系的pH值为3,搅拌2 h,静置24 h,采用微孔滤膜过滤,得到金溶液B,其杂质金属离子含量如表4所列。

表4 金溶液主要杂质含量Tab.4 Main impurity contents in the gold solution /(mg/L)
2.1.3 金的还原
为了得到高纯度的金,需要选择合适的还原剂选择性还原,而其他杂质离子不被还原。选择性还原是本工艺最关键的环节,需严格控制工艺参数。具体操作为:将除杂后的金溶液B用去离子水稀释至8 L,反应过程用氢氧化钠保持溶液pH值为4,搅拌,缓慢加入优级纯还原剂S,确保Au与还原剂S的摩尔比为1:3,反应2 h,然后加热溶液至80℃反应1 h,冷却,过滤,去离子水洗涤至中性,得到金粉95.42 g,金还原率95.42%;金还原尾液用水合肼还原得到粗金粉4.48 g,返回溶解段,金的损耗率0.1%。
2.1.4 金粉洗涤
通常还原得到的金粉中夹杂有一定量的杂质,需要进一步通过洗涤方式去除。将金粉分别采用500 mL质量浓度20%的硝酸、10%的盐酸,加热沸腾煮洗各1 h,用80℃去离子水充分洗涤至中性,真空干燥,获得高纯金95.24 g,高纯金成品率95.24%。3种洗涤尾液合并后用草酸还原处理,得到粗金0.15 g。全流程金的损耗率0.13%。
洗涤前后的金粉采用Element GD型辉光放电质谱(GDMS)分析杂质含量,结果列于表5。采用美国LECO844型高精度碳硫分析仪测定高纯金中的碳和硫含量均小于1×10-6。
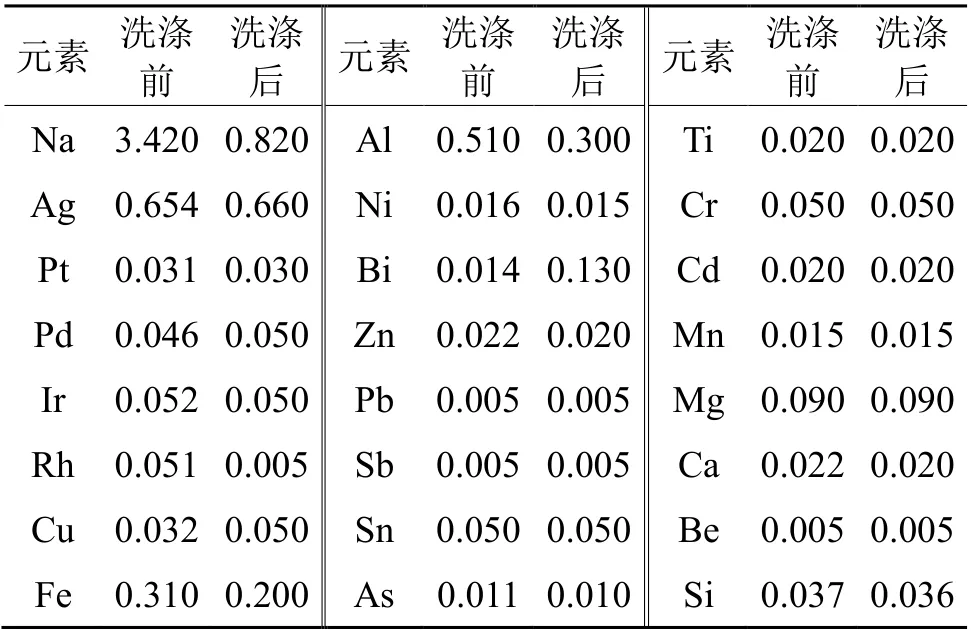
表5 金粉杂质元素质量分数Tab.5Mass fractionof impurities in gold powder /10-6
由表5可以看出,洗涤前,金粉中杂质元素含量较高,达不到高纯金的质量要求;采用硝酸、盐酸、去离子水洗涤后,钠等杂质金属被溶出,获得的高纯金中杂质元素总含量小于3×10-6(不计气态杂质元素含量),用减量法衡量,高纯金质量分数大于99.999%,符合《GB/T25933-2010 高纯金》中化学成分要求。
2.2 高纯金应用性能分析
为了进一步考察所制备的高纯金的应用性能,将高纯金通过熔炼加工制成蒸发材料颗粒进行分析,其杂质含量分析结果见表6。采用日立S-3400N型扫描电镜进行SEM及微区能谱EDAX进行选区分析,并与电解高纯金为原料熔炼加工成的蒸发材料进行比较,结果如图2所示。

表6 高纯金蒸发材料杂质元素质量分数Tab.6 Mass fraction of impurities in high purity gold evaporation materials /10-6

图2 不同方法制备的高纯金蒸发材料的SEM图像(左)及能谱图(右)Fig.2SEM (left) and EDAX (right) of high-purity gold evaporation materialpreparedbydifferentmethods
由表6及图2可以看出,以电解高纯金为原料制备高纯金蒸发材料颗粒表面有黑色物质,能谱分析结果可以看出,其中还有碳和钛等杂质元素。以本研究制备的高纯金为原料加工后的高纯金蒸发材料纯度大于99.999%,颗粒表面清洁性好,微区能谱分析未检测到碳等杂质元素,可用作制造集成电路芯片的蒸发材料。
3 结论
金锭轧片后,采用盐酸+氯酸钠溶液溶解,通过氢氧化钠调整溶液pH值进行除杂,然后用还原剂S选择性还原,得到的金粉用稀硝酸、盐酸煮洗,获得纯度99.999%以上,碳和硫含量均小于1×10-6的高纯金。高纯金成品率95.24%,全流程金的损耗率0.13%。以此高纯金为原料加工的蒸发材料的清洁性优于电解高纯金原料,满足集成电路芯片制造用蒸发材料的要求。
