绵羊附睾头、体、尾上皮细胞的培养及相关基因表达
2021-11-06栾兆进宋慧子王兆琛赵勇超张家新
杜 炜,栾兆进,宋慧子,王兆琛,赵勇超,张家新
(内蒙古农业大学动物科学学院 010018)
1 实验方法
1.1 附睾上皮细胞的分离培养
将附睾头、体、尾组织分离,分别浸泡在加入PS的DPBS中使附睾组织中的精子成分上游,用眼科手术剪刀将组织剪成2~3mm小块,并剔除其中结缔组织,移入1mg/ml胶原蛋白酶Ⅳ中,37℃水浴震荡消化30min,用孔径为0.15mm不锈钢滤网将消化液过滤,用DPBS冲洗滤网上的管状组织块,RPMI-1640培养基1350r/min离心5min清洗3次取得管状组织块,每个60皿中约放置60个块,加入3mLRPMI1640培养基(含体积分数10%胎牛血清、5µg/mL转铁蛋白、100nmol/L雄激素、50U/mL青霉素和50µg/mL链霉素)37℃、5%CO2培养箱中培养,待单层细胞融合度达80%时,去掉组织块,即得原代附睾上皮细胞[1]。
1.2 附睾上皮细胞体外传代培养
待细胞融合接近80%~90%时传代,加入0.25%胰蛋白酶(含EDTA)消化2min,光镜下观察到细胞收缩变圆或少数脱落浮起时,加入完全培养基终止消化,用移液枪轻轻吹打,使细胞基本成单个悬浮后,收集离心,重悬后接种到新的培养瓶[2]。
1.3 实时荧光定量PCR测定附睾头、体、尾上皮细胞相关基因
使用TBGreenTMPremixExTaqTMⅡ(Takara)对GPx5基因进行相对定量试验。反应条件如下:95℃、10min;95℃、30s,60℃、30s,72℃、30s,进行40个循环反应。反应体系为20μL:TBGreenTMPremixExTaqTMⅡ(2×)10μL,cDNA2μL,上 下 游引 物 各0.8μL,ddH2O6.4μL。利用2-ΔΔct法 与β-actin进行相对定量计算[3]。
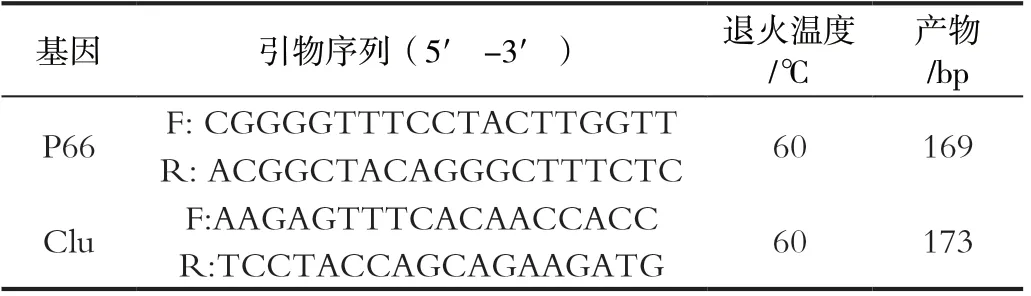
表1 P66、SERPIN1、DCXR 、AK1和Clu基因引物序列
2 实验结果
2.1 附睾头、体、尾上皮细胞的分离及传代培养
附睾上皮细胞,24h内以球状团块形式贴壁生长。36h后,细胞团逐渐变平并扩散成单层,外观呈菌落状的生长形态。原代附睾头上皮细胞、附睾体上皮细胞3d内达到融合。可以用0.25%胰蛋白酶消化传代至少8~10次(传代比率为1∶2)。相比之下,附睾尾上皮细胞培养7d才能融合。经过4~5次传代后,上皮细胞通常显示细胞体积增大,形状趋于扁平且不规则,并带有大量胞质液泡。
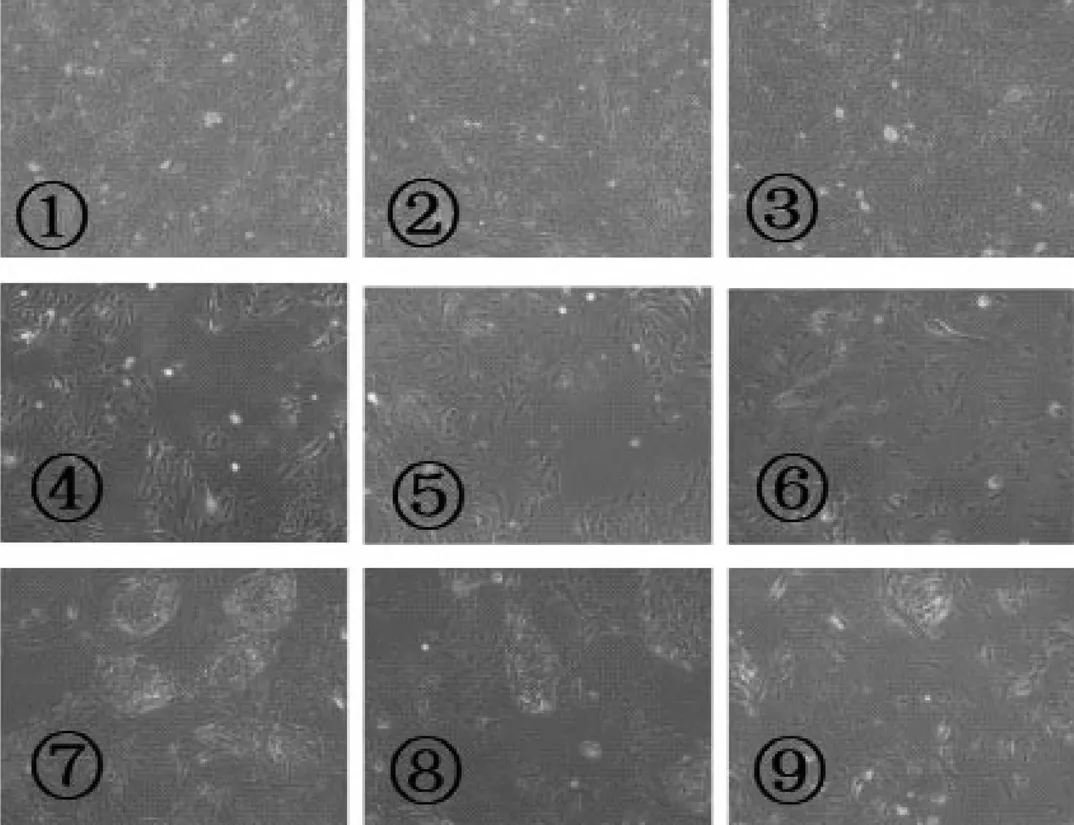
图1 上皮细胞培养图
2.2 附睾相关基因在附睾头、体、尾上皮细胞的表达差异
从p66mRNA、P34HmRNA、seRPINA1的基因表达量来看,附睾头、体、尾上皮细胞的基因表达量比较均存在显著差异,且头部>体部>尾部(P<0.01);从ak1mRNA来看,附睾头部上皮细胞基因表达量显著高于体部(P<0.05);从clumRNA看,附睾头、体部的基因表达量显著高于尾部(P<0.01)(见图2)
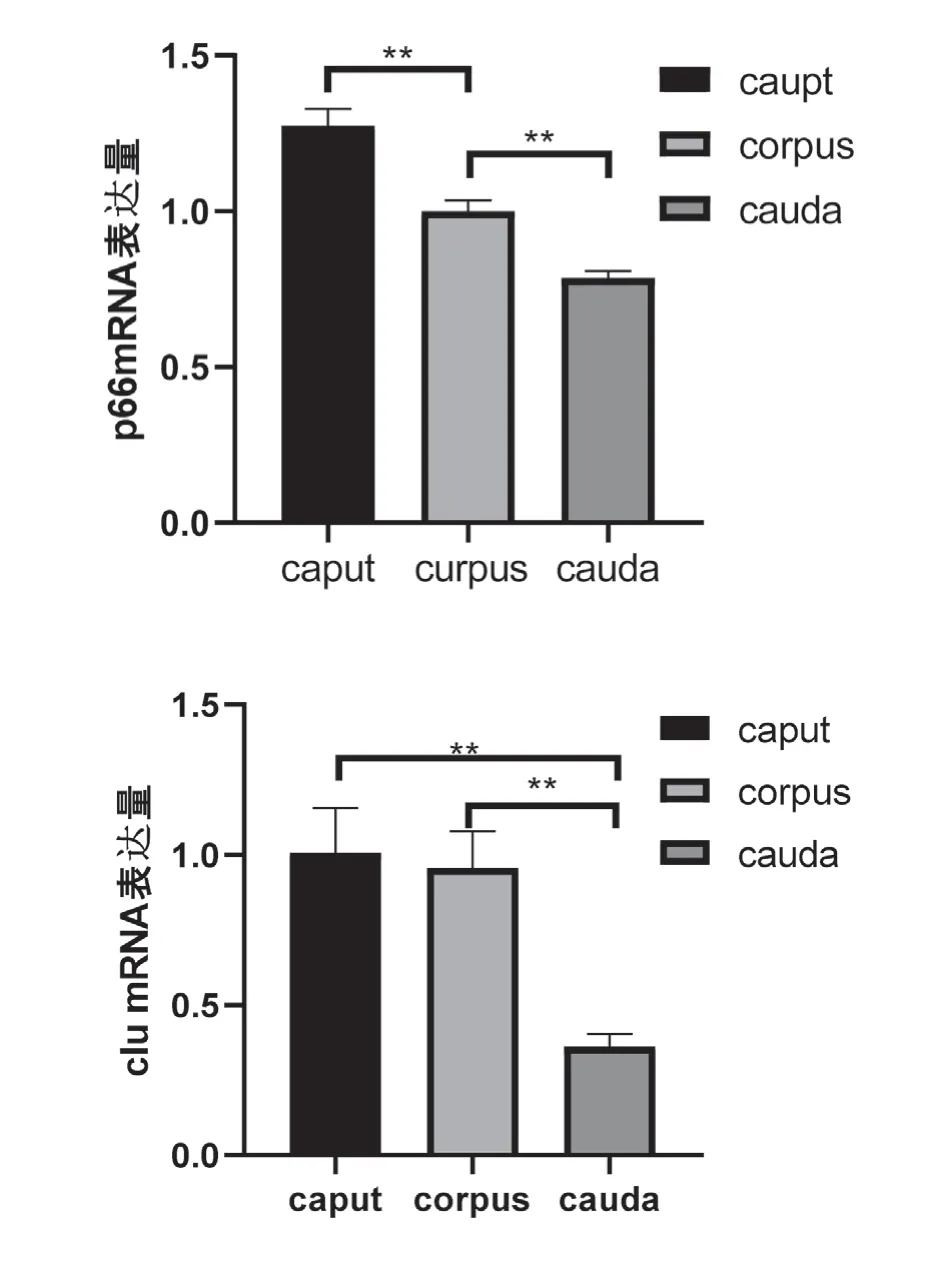
图2 附睾头、体、尾上皮细胞相关基因表达差异
3 讨论与结论
从p66mRNA,附睾头、体、尾上皮细胞的基因表达量比较均存在显著差异,且头部>体部>尾部(P<0.01);考虑p66mRNA的基因表达量在附睾的不同部位的上皮细胞间存在分布差异。在附睾头、体、尾呈递减性分布。研究显示,体外胚胎发育能力下降与胚胎暴露于氧化应激蛋白p66Shc环境下有关[4]。研究证实,绵羊合子阶段注射p66SHc siRNA会导致p66mRNA的蛋白质水平下降[5]。而敲定p66SHc 能够提升胚胎的基因激活阶段的抗氧化应激能力。从正常绵羊附睾组织获取的附睾头、体、尾组织的p66mRNA基因分布情况看,决定绵羊附睾上皮细胞的生育、细胞凋亡、抗氧化应激能力的基因物质主要集中在附睾头部。
从clumRNA看,附睾头、体部的基因表达量显著高于尾部(P<0.01)。clumRNA与多种疾病有关,CLU的功能多样,但在不同的区域承担的生物学特性有影响差异。而附睾头、体部基因表达量高于尾部,可见,绵羊附睾上皮细胞的clumRNA主要存在于附睾头、体部,在尾部含量少。综上,在不同的附睾上皮细胞中,参与附睾的功能的主要基因分布情况存在一定差异,但主要以附睾头、体部为主,尾部的上皮细胞的基因分布较低,与附睾尾端的生物功能有关。
