60Co-γ辐射对半夏愈伤组织成苗及植株特性的影响
2021-11-06赵中莹李青苗田孟良杨小倩康瑶邱玉洁张庆玲刘帆
赵中莹 李青苗 田孟良 杨小倩 康瑶 邱玉洁 张庆玲 刘帆
(1. 四川农业大学农学院,成都 611130;2. 四川省中医药科学院中药资源与种植研究所,成都 610041;3. 石棉县农业农村局,雅安 625400)
半夏(Pinellia ternata(Thunb)Brie)为天南星科半夏属多年生草本植物,该属植物野生资源丰富,分布广泛。半夏以块茎入药,含生物碱、β-谷甾醇、有机酸等,有燥湿化痰,降逆止呕,消痞散结、抗癌等功效,具有很高的药用价值[1]。半夏通常以珠芽、种子及小块茎进行繁殖,繁殖系数低,且此种繁殖方式会引起病毒积累,进而导致半夏块茎逐渐退化致使药材质量不稳定,药效降低,严重影响了半夏种植业的发展[2]。因此,利用辐射诱变技术,确定半夏半致死剂量及获得优良的突变体,为半夏育种提供切实可行的技术方法及基础性研究材料。
植物诱变技术可加快物种遗传变异,从而在较短时间内获得有利用价值的突变体,为选育新品种、新种质及相关功能基因的研究创造条件[3]。辐射诱变育种具有创造多种突变体,丰富种质资源;打破基因连锁,实现基因重组;保持优良特性,改良个别不利性状;后代稳定快,育种年限较短等特点。随着生物技术的发展,辐射诱变技术已被广泛应用于药用植物上,如红花、海州常山、白刺花、人参、阳春砂等[4-8];国内外学者普遍认为组织培养材料繁殖系数高,敏感性强,突变频率高,既能降低或避免常规处理易产生嵌合体的问题,提高突变频率,又能在人为可控的实验条件下重复多次试验,使诱变效率得到提高,因此将组织培养技术与辐射诱变技术相结合可提高育种效率[9-10]。植物经射线照射后,部分植株会表现出不同于未经辐射植株的性状,如叶片增大,增厚、叶色加深,叶形上发生改变,植株粗壮,变矮,花朵变大等[11]。植物接受辐射处理后生理生化指标会发生一定的变化,如植株体内的光合色素量、蛋白质含量、同工酶及过氧化物酶的活性和谱带等[12]。目前利用60Co-γ射线辐射愈伤组织获得突变体植株已在药用植物中有所应用,但使用60Co-γ射线辐射半夏愈伤组织的研究还鲜有报道。
由国内外的研究现状可知,辐射育种的材料都以农作物和花卉植物为主,有关药用植物的辐射生物学研究相对零散,因此对60Co-γ射线、离子束注入和空间诱变等不同辐射诱变技术在我国药用植物育种中的应用还需进行进一步的探索[10]。目前,已有人采用适当剂量的微波辐射提高菘蓝、射干、龙胆、北柴胡和丹参等种子的萌发率,缩短萌发时间,使芽的生长速度得到显著提高[13-14]。在药用植物育种研究中,张美萍等[15]利用60Co-γ射线照射西洋参的愈伤组织,获得高产细胞系。本试验以半夏叶柄为外植体,获得愈伤组织,以60Co-γ射线为辐射源,采用不同辐射剂量进行处理,筛选出半夏愈伤组织半致死剂量,旨在探究60Co-γ射线对半夏愈伤组织分化成苗及再生植株生长的影响,在短期内获得优良突变体材料。
1 材料与方法
1.1 材料
由四川喜玛高科农业生物工程有限公司提供,经四川农业大学田孟良教授鉴定为桃叶型半夏的植株。
1.2 方法
1.2.1 半夏愈伤组织诱导 以半夏叶柄为外植体,采用植物组织培养常规技术进行外植体的表面灭菌,在无菌条件下将半夏叶柄切为0.5 cm小段,接种于前期试验筛选出的愈伤组织诱导最适的培养基中,即MS+1.0 mg/L 6-BA+0.01 mg/L NAA+30 g/L蔗糖+5.5 g/L琼脂粉,pH5.8;培养20 d后得到大量质地一致的黄绿色愈伤组织用于后续试验。培养条件,温度(22±2)℃,黑暗培养10 d后进行光照培养,光照强度为30-40 μmol·m-2·s-1,光照时数14 h/d。1.2.260Co-γ射线辐射半夏愈伤组织 本试验采用单因素试验设计,辐射剂量分别为0 Gy、15 Gy、20 Gy、25 Gy、30 Gy,辐射剂量率为1 Gy/min,每处理组10瓶,每瓶5块质地相同的愈伤组织,设3次重复。辐射处理于2019年4月21日在四川省农业科学院辐照中心进行。将不同处理组的愈伤组织进行继代培养,培养条件同上。继续培养观察,待愈伤组织分化形成再生植株后,计算不同处理的分化率、成苗率及死亡率,根据死亡率得出辐射半致死剂量(LD50),即引起50%愈伤组织死亡的辐射剂量。半致死剂量(LD50)的计算方法:本试验以不同辐射剂量x为自变量,不同剂量下的死亡率y为因变量,利用直线回归方程y=a+bx和公式LD50=(50-a)/b进行计算。
芽分化率(%)=半夏愈伤组织分化数 /接种的愈伤组织块数×100%
成苗率(%)=再生植株数/接种的愈伤组织块数×100%
死亡率(%)=死亡愈伤组织数/接种的愈伤组织块数×100%
1.2.3 突变体筛选 半夏形态学考察主要包括半夏叶型、株高、珠芽数、块茎等,其中珠芽作为半夏的繁殖器官,块茎作为其营养器官为重要考察指标[16-17]。当再生植株根长达到3 cm以上时,已完全展叶,分化出珠芽及块茎等器官,即可进行观察测定。统计性状包括:株高、叶型、珠芽着生位置及珠芽数。对形态变异的再生植株进行进一步的生理生化测定,包括叶绿素含量(分光光度法)[18]、酯酶(EST)同工酶筛选(聚丙烯酰胺凝胶电泳法)[19]。
块茎大小:用游标卡尺测量半夏块茎最大直径。
突变频率(%)=筛选出的突变体株数/再生植株株数×100%
变异系数:为标准差与平均值之比;株高:用直尺测量半夏根尖到最长叶端的长度;叶型:按长宽比例及最宽的位置来确定;珠芽数:记录整个生育期内产生的珠芽数。
叶绿素含量测定:取半夏新鲜叶片中间叶片1 cm×1 cm进行测定,设3次重复,计算其平均值。计算公式:
Chla含量(mg/cm2)=(12.7OD663-2.69OD645)×V/(S×1000)
Chlb含量(mg/cm2)=(22.9OD645-4.68OD663)×V/(S×1000)
Chl总含量(mg/cm2)=(20.2OD645+8.02OD663)×V/(S×1000)
OD:测定波长下的吸光度值;V:叶绿素提取液总体积(mL);S:材料叶面积(cm2)。
1.2.4 统计分析 采用Excel 2013进行数据处理,SPSS 16.0统计软件进行方差分析及多重比较。
2 结果
2.1 辐射剂量对半夏愈伤组织分化及成苗的影响
由表1可知,在0-30 Gy随辐射剂量增加芽分化率逐渐降低,表明辐射对半夏愈伤组织分化具有抑制作用(图1),当辐射剂量为0 Gy,芽分化率最高,为100%(图2),其次是辐射剂量为15 Gy,芽分化率为72%,辐射剂量为30 Gy,芽分化率最低,为30%。辐射剂量为15-30 Gy时,与0 Gy处理比较,芽分化率差异显著。在辐射剂量15 Gy及20 Gy处理下,芽分化率差异显著。在辐射剂量25 Gy和30 Gy处理下,芽分化率差异不显著,且芽分化率较低。由此说明,辐射剂量在0-30 Gy范围内,芽分化率与辐射剂量成负相关,死亡率与辐射剂量成正相关,且芽分化率与成苗率相同,即分化出芽即可成苗。各处理再生植株生长情况如图3所示,0 Gy处理愈伤组织分化苗数最多,随着辐射剂量的增加,愈伤组织分化苗数逐渐减少,地上部分长势随着辐射剂量的增加逐渐变差。

图1 芽分化抑制Fig. 1 Inhibition of bud differentiation

图2 芽正常分化Fig. 2 Buds differentiated normally

图3 不同辐射剂量处理后再生植株生长情况Fig. 3 Growth of regenerated plants treated with different radiation doses
2.2 60Co-γ辐射半夏愈伤组织半致死剂量的确定
通过对辐照剂量与死亡率进行相关性与回归性分析,得到线性方程为y = 2.3981x - 3.566,相关系数R2=0.960 8,说明半夏愈伤组织死亡率和辐照剂量存在正相关关系。根据直线回归方程计算出半致死剂量,即半夏愈伤组织的半致死剂量为LD50为22.34 Gy。
2.3 辐射剂量对半夏愈伤组织再生植株形态影响
2.3.1 不同辐射剂量对株高的影响 由图4可知,突变频率最高为20 Gy处理,为20.0%,15 Gy次之,为16.9%,25 Gy最低,为11.8%;由图5可知,20 Gy处理株高变异程度最大,25 Gy处理株高变异程度最低。
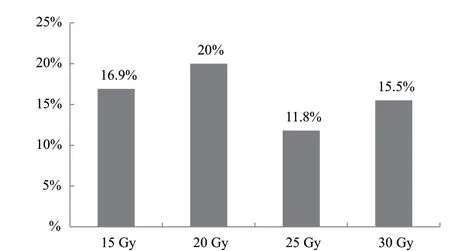
图4 不同辐射剂量处理再生植株株高突变频率Fig. 4 High mutation frequency of regenerated plants treated with different radiation doses
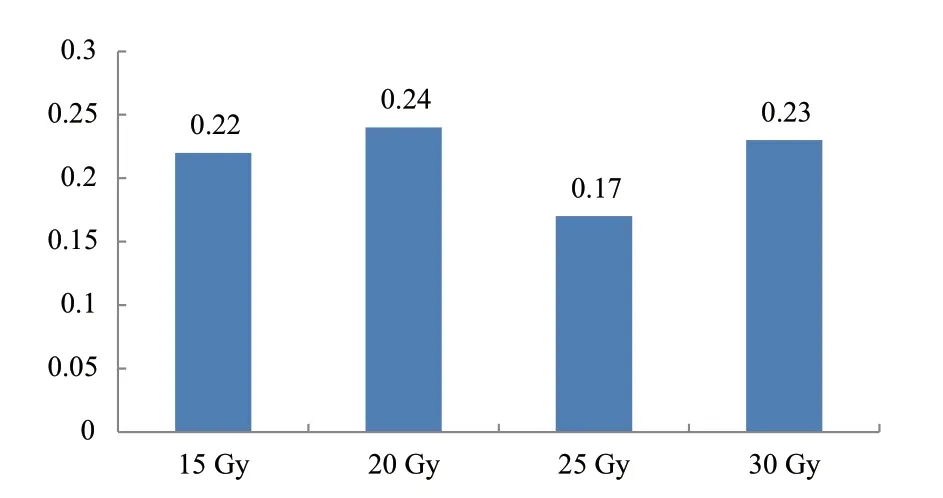
图5 不同辐射剂量处理再生植株株高变异系数Fig. 5 Variation coefficient of plant height of regenerated plants treated with different radiation doses
2.3.2 不同辐射剂量对块茎的影响 由图6可知,25 Gy处理,块茎大小突变频率最高为20.0%,20 Gy处理次之,为11.8%,30 Gy处理中未见块茎大小变异;块茎鲜重突变频率,25 Gy最高为16.8%,其次是15 Gy为13.3%,20 Gy最低为7.8%;由图7可知,25 Gy及30 Gy处理块茎鲜重变异程度最大,20 Gy处理块茎鲜重变异程度最小;25 Gy处理块茎大小变异程度最大,30 Gy处理块茎大小变异程度最低。筛选出的变异植株与未经辐射处理比较块茎大小均低于未经辐射处理;块茎鲜重表现为,未经辐射处理鲜重均在0.15-0.2 g,15 Gy处理的5株块茎鲜重在0.1 g以下,8株2.5 g以上,20 Gy处理的2株块茎鲜重在0.1 g以下,5株2.5 g以上,25 Gy处理的1株块茎鲜重在0.1 g以下,9株2.5 g以上,30 Gy处理的1株块茎鲜重在0.1 g以下,4株2.5 g以上。
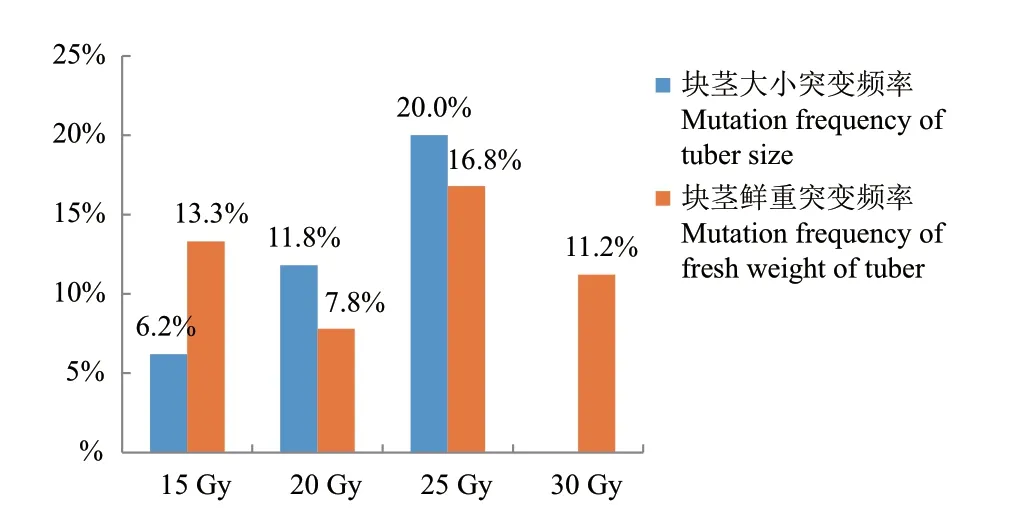
图6 不同辐射剂量处理再生植株块茎大小及鲜重突变频率Fig. 6 Tuber size and fresh weight mutation frequency of regenerated plants treated with different radiation doses

图7 不同辐射剂量处理再生植株块茎大小及鲜重变异系数Fig. 7 Variation coefficient of tuber size and fresh weight of regenerated plants treated with different radiation doses
2.3.3 不同辐射剂量对叶的影响 由图8可知,叶型突变频率最高为30 Gy处理,为15.5%,其次是25 Gy处理,为15.2%,最低为15 Gy处理,为8.2%,未经辐射处理叶型为卵形,叶端急尖(图9-a),叶型变异有阔卵形(图9-b)、披针形(图9-c)、阔椭圆形(图9-d)、阔卵形,裂叶大小不一致(图9-e)、阔卵形,叶端骤尖(图9-f)。
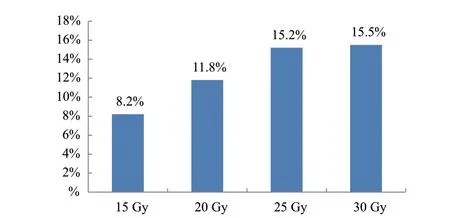
图8 不同辐射剂量处理再生植株叶型重突变频率Fig. 8 Leaf type mutation frequency of regenerated plants treated with different radiation doses

图9 辐照处理后代叶型变异情况Fig. 9 Variation of progeny leaf shape after irradiation
2.3.4 不同辐射剂量对珠芽的影响 由图10可知,突变频率最高为25 Gy及30 Gy处理,为8.6%,15 Gy与20 Gy处理为2.2%;未经辐射处理半夏株芽位于叶柄中部,且只有一个珠芽(图11-a),15 Gy、30 Gy处理变异植株珠芽位于叶片基部(图11-b),20 Gy处理1株变异植株珠芽位于叶片基部(图11-b),1株变异植株的为双珠芽(图11-c),25 Gy处理中1株变异植株珠芽位于叶片基部(图11-b),1株变异植株为双珠芽(图11-c)。
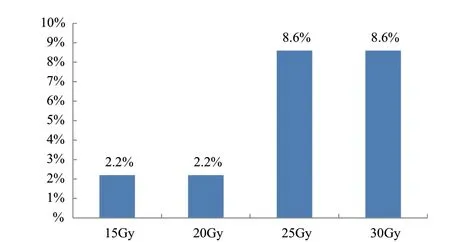
图10 不同辐射剂量处理再生植株珠芽突变频率Fig. 10 Bead mutation frequency of regenerated plants treated with different radiation doses

图11 辐照处理后珠芽变异情况Fig. 11 Variation of bead buds after irradiation
2.4 辐射剂量对半夏再生植株叶绿素含量的影响
叶绿素含量变异程度由图12可知,30 Gy处理变异程度最大,其次是15 Gy处理,25 Gy处理的变异程度最低,由表2可知,变异频率最高为25 Gy处理,变异频率为14.3%,筛选出变异植株9株,其次是30 Gy处理,变异频率为12.2%,筛选出变异植株6株,20 Gy处理变异频率最低为8.6%,筛选出变异植株8株,且4组处理间均差异不显著。
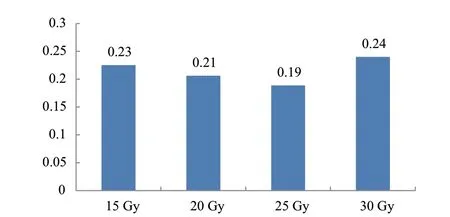
图12 不同辐射剂量处理叶绿素变异系数Fig. 12 Chlorophyll variation coefficient under different radiation doses
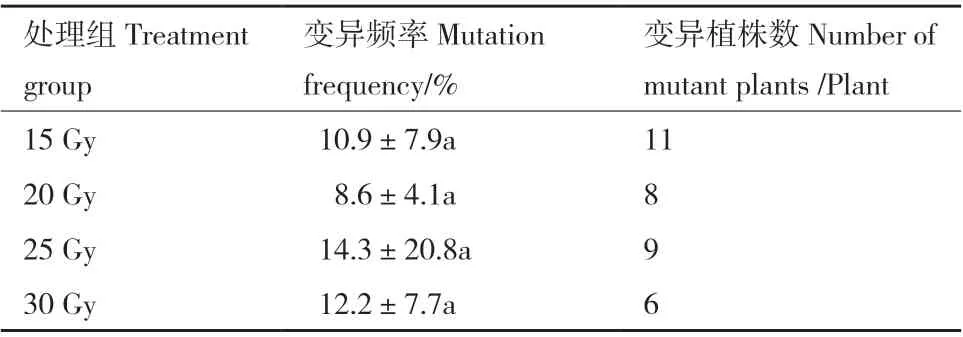
表2 不同辐射剂量处理叶绿素含量变化筛选结果Table 2 Screening results of chlorophyll content under different radiation doses
2.5 辐射剂量对半夏愈伤组织再生植株EST同工酶的影响
由表3及图13可知,经EST同工酶筛选出的变异植株与未经辐射处理的EST同工酶酶谱在迁移率、酶带数和酶带强弱差异显著。图上共显示出18条酶带,酶带的Rf值在0.09-0.95之间,筛选出的突变体材料在Rf值=0.09及Rf值=0.86处均与未经辐射处理有相同酶带。由于迁移率的差异,整个酶谱从负极到正极可划分为3个区域,即A区、B区和C区,A区Rf值=0.09,B 区Rf值在0.38-0.60,C区Rf值在0.81-0.95。A区有4条酶带,B区有9条酶带,C区有5条酶带。25 Gy与30 Gy处理酶条带数目最多,说明遗传性最为丰富。由表4可知,变异频率最高为30 Gy,变异频率为8.6%,筛选出变异植株4株,其次是25 Gy处理,变异频率为7.9%,筛选出变异植株5株,15 Gy、20 Gy处理变异频率最低,均为2.2%,各筛选出变异植株2株;经酯酶同工酶测定后共获得13株变异半夏植株(表5)。
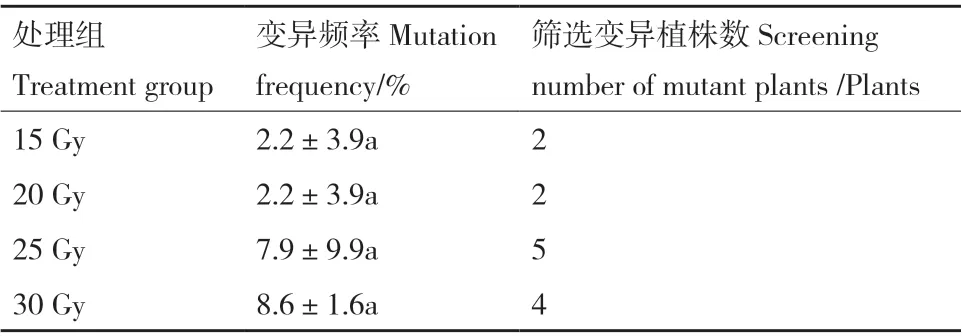
表4 不同辐射处理EST同工酶筛选结果Table 4 Screening results of EST isozymes under different radiation treatments

表5 对照处理与突变植株各变异性状测定结果Table 5 Results of different characters of mutant plants were compared with those of treatment

图13 EST同工酶图谱Fig. 13 EST isozyme map
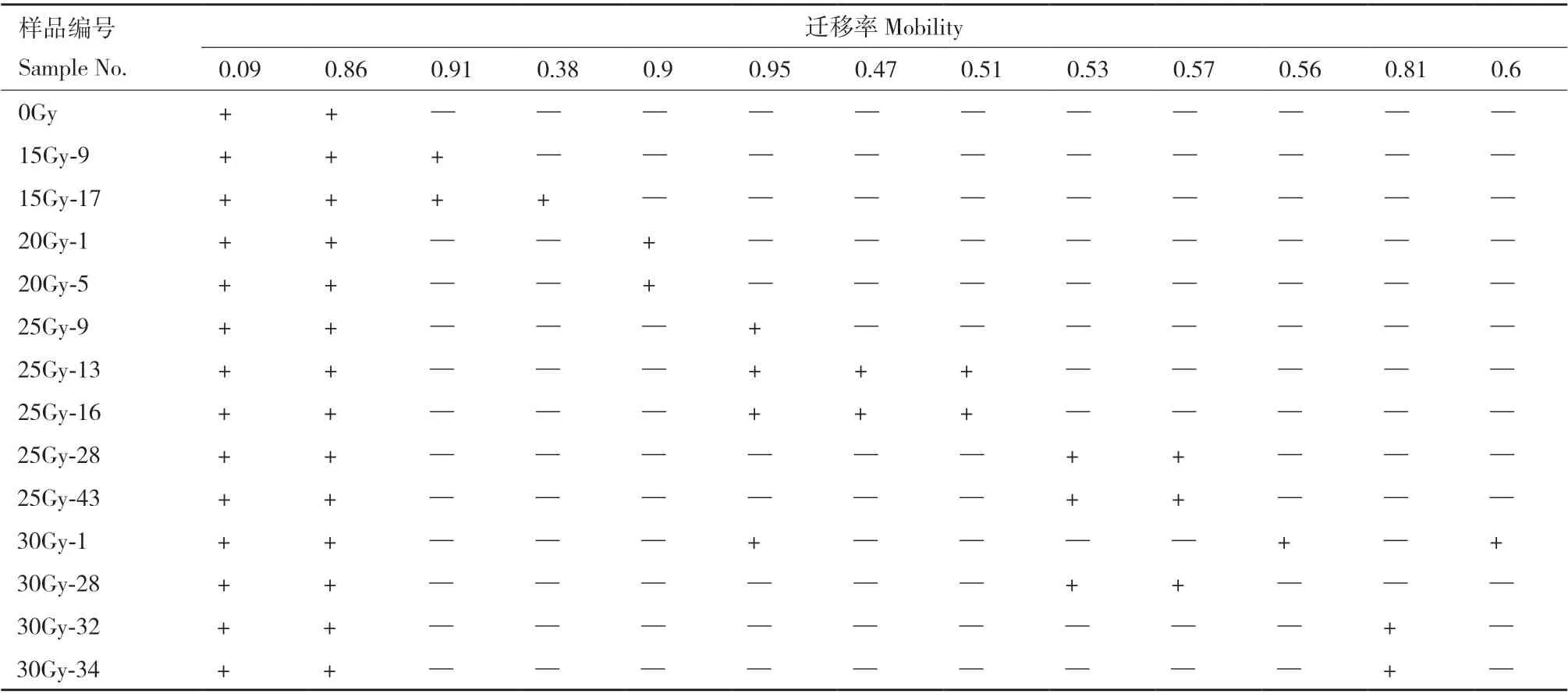
表3 变异植株EST同工酶酶带数及迁移率结果Table 3 EST isozyme band number and migration rate of mutant plants
3 讨论
目前我国半夏品种选育还处于传统的常规育种技术,远远落后于农作物和园艺植物,随着半夏中药材产业的发展,半夏生产基地由于缺乏优良品种而限制了其品质和产量的提高,辐射诱变技术可为半夏的品种改良和种质资源的创造开辟新的途径。
前人研究表明在一定剂量范围内,60Co-γ射线对愈伤组织分化的抑制作用显著,且随着辐射剂量的增加抑制作用逐步加强,如杨丽等[20]利用660Co-γ射线照射白三叶愈伤组织、尚伟等[21]利用60Co-γ射线照射红掌愈伤组织的研究结果均表现为愈伤组织分化率与辐射剂量成负相关,与本研究结果相同。
大量研究表明适宜的辐照剂量对生物体系的诱变效应至关重要,60Co-γ辐射剂量过高就会造成较高的死亡率,使辐射植株失去筛选机会;剂量不足又无法诱导显著变异,获得好的诱变效果[22-23]。由芽分化率结果表明,半夏愈伤组织的半致死剂量在20-30 Gy,与彭文君等[24]对同科植物红掌愈伤组织60Co-γ辐射得出红掌愈伤组织半致死剂量范围在20-30 Gy的研究结果一致,通过直线回归方程计算得到型半夏愈伤组织半致死剂量为22.34 Gy。
本试验中经辐射后的半夏愈伤组织部分能够继续分化,但分化率受辐射影响显著,且分化时间与0 Gy处理的愈伤组织相比,时间更长,同时会抑制叶片的分化与生根。辐射后的损伤效应潜伏期较长,随着植株生长,射线对植株的损伤才逐渐表现出来[25]。经辐射后获得的部分再生植株,形态上发生不定向变异,植株变矮、叶型、块茎、珠芽数目及其着生位置均发生变异,这些现象都符合60Co-γ射线对植物生长的诱变效应,与曾文丹[26]辐射木薯,突变植株主要变现在叶形变异或株型变异的研究结果基本一致,且在25 Gy辐射处理下有8株再生植株块茎鲜重增加,在15 Gy及20 Gy处理下各获得一株双珠芽再生植株,可进行后续栽培,以期获得性状稳定的变异植株。试验中发现,部分再生植株的叶绿素含量有所增加,此结果与范菁[27]、李瑜等[28]的研究的结论不一致,可能是因辐射诱变导致半夏再生植株的叶绿素生物合成增强,具体的作用机理有待进一步研究。但叶绿素含量的增高,有利于半夏干物质的积累。由半夏EST同工酶酶谱可以看出,变异植株与未经辐射处理比较差异显著,具体表现为迁移率、酶带数和酶带强弱差异显著,呈现出丰富的多态性,这与刘波等[29]的研究结果相似,有利于新品系的筛选。
4 结论
本研究共获得变异植株13株,在25 Gy下突变频率最高,获得变异植株5株,该辐射剂量与半致死剂量接近,为最佳辐射剂量,该研究结果可为后续的半夏育种材料的获得提供试验依据。
