胃肠间质瘤组织中第10号染色体缺失的磷酸酶张力蛋白同源物基因蛋白和磷酸化蛋白激酶B蛋白的表达及其对患者预后的影响
2021-11-06王昊,赵伟,石磊
王 昊, 赵 伟, 石 磊
(江苏省苏北人民医院/扬州大学临床医学院 胃肠外科, 江苏 扬州, 225001)
胃肠间质瘤(GIST)是胃肠道最常见的间叶源性肿瘤,可发生在胃肠道的任何部位,最常见原发部位是胃[1-2]。GIST早期临床表现无特异性,肿瘤进展隐匿且迅速,后期肿瘤转移也较常见,多数GIST患者首次就诊时已出现消化道出血、梗阻、穿孔等症状,此时肿瘤往往已发展至晚期[3]。因此,早期诊治和评估预后仍是当前GIST的研究热点。第10号染色体缺失的磷酸酶与张力蛋白同源物基因(PTEN)通过其磷酸酯酶蛋白产物行使抑癌基因作用,被称为“后p53基因时代突变率最高的肿瘤抑制基因”。通过对磷脂酰肌醇3, 4, 5-三磷酸(PIP3)的去隣酸化调节,PTEN负性控制PI3-kinase/Akt信号转导通路(该通路被认为是GIST最重要的存活通路之一),从而起到促凋亡因子的作用[4]。
磷脂酰肌醇3-激酶(PI3K)/蛋 白 激 酶 B (PKB或 Akt)信号通路作为细胞内重要的信号转导通路之一,参与细胞周期调节、蛋白质翻译和细胞程序性死亡调控等过程。该通路中的核心分子Akt是一种丝氨酸/苏氨酸蛋白双功能激酶,其功能涉及细胞周期调控、恶性增殖、血管新生和侵袭转移等诸多方面[5]。研究[6]发现, PTEN可抑制PI3K/Akt通路,降低磷酸化Akt(p-Akt)水平,从而发挥其抑癌基因的作用。对于PTEN和p-Akt在GIST中的表达意义的报道较少。本研究通过检测GIST组织中PTEN蛋白、p-Akt蛋白的表达,并分析其与GIST患者预后的关系,探讨二者对评估GIST患者预后的价值,现将结果报告如下。
1 资料与方法
1.1 一般资料
选取2014年1月—2017年1月在江苏省苏北人民医院行手术(包括开放手术、腹腔镜手术、内镜手术)治疗的GIST患者为研究对象。纳入标准: ① 经病理和免疫组织化学确诊为GIST者; ② 肿瘤组织危险度分级明确者; ③ 患者病历资料完整。排除标准: ① 合并其他恶性肿瘤者; ② 严重肝功能不全(Child-Pugh C级) 者; ③ 慢性肾脏病(CKD)临床分期标准4期及以上者; ④ 精神异常者; ⑤ 妊娠期及哺乳期女性; ⑥ 年龄<18周岁或>75周岁者。最终研究组纳入116例GIST, 同时选取相对应的瘤旁正常胃肠道组织(与肿瘤组织距离>3 cm)116例为对照组。本研究通过苏北人民医院医学伦理委员会批准(批件号: 2018KY-185)。
1.2 主要试剂
兔抗人PTEN单克隆抗体(产品批号9188P), 购自Cell Signaling Technology公司; 兔抗人p-Akt(Thr308)多克隆抗体(产品批号sc-16646-R), 购自Santa Cruz Biotechnology公司。
1.3 方法
1.3.1 样品采集:所有行GIST手术的患者手术时均留存病理组织(3 cm×3 cm), 并于液氮中速冻,之后冻存于-80 ℃冰箱中,待检。
1.3.2 PTEN、p-Akt表达水平检测:常规制作GIST组织和瘤旁正常组织石蜡切片(厚度为3~4 μm), 采用免疫组织化学法检测组织中PTEN、p-Akt的表达水平,严格按照试剂盒说明书进行操作,二氨基联苯胺(DAB)显色和苏木精复染,然后在不同梯度乙醇(75%、85%、95%、100%)中脱水,最后用中性树胶封片,显微镜观察拍照。
1.3.3 结果判定:每个实验结果均由2位病理科医生在双盲条件下完成评定。① 阳性强度评分: 无色为0分,浅黄色为1分,棕黄色为2分,棕褐色为3分。② 在显微镜下,按照阳性细胞所占百分率评分: ≤5%为0分, >5%~≤25%为1分, >25%~≤50%为2分, >50%~≤75%为3分, >75%为4分。③ 根据染色指数(即染色强度与阳性细胞所占百分率的评分乘积)将免疫组织化学结果进行等级划分: 0~1分为阴性(-), 2~4分为弱阳性(+), 5~8分为中度阳性(), 9~12分为强阳性()。其中-和+记为PTEN、p-Akt阴性,和记为PTEN、p-Akt阳性。
1.4 随访
对入选患者进行为期3年的随访,随访起始时间为手术当天。随访计划为术后第1年内每隔4个月嘱患者入院复查1次(条件不允许的每半年复查1次),术后第2、3年每6个月嘱患者入院复查1次,记录患者复发、肿瘤转移及死亡情况。
1.5 统计学分析
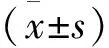
2 结 果
2.1 PTEN和p-Akt在GIST和瘤旁正常组织中情况
PTEN、p-Akt免疫组化染色阳性强度评分结果见图1、2。PTEN阳性表达为细胞浆和细胞核中出现棕黄色或棕褐色颗粒, p-Akt阳性表达为细胞浆和细胞核中出现棕黄色或棕褐色颗粒,见图3。
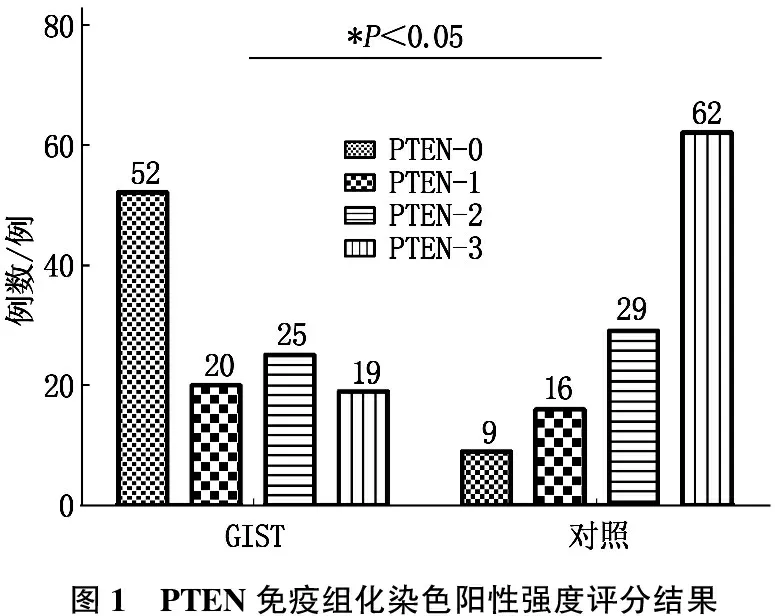
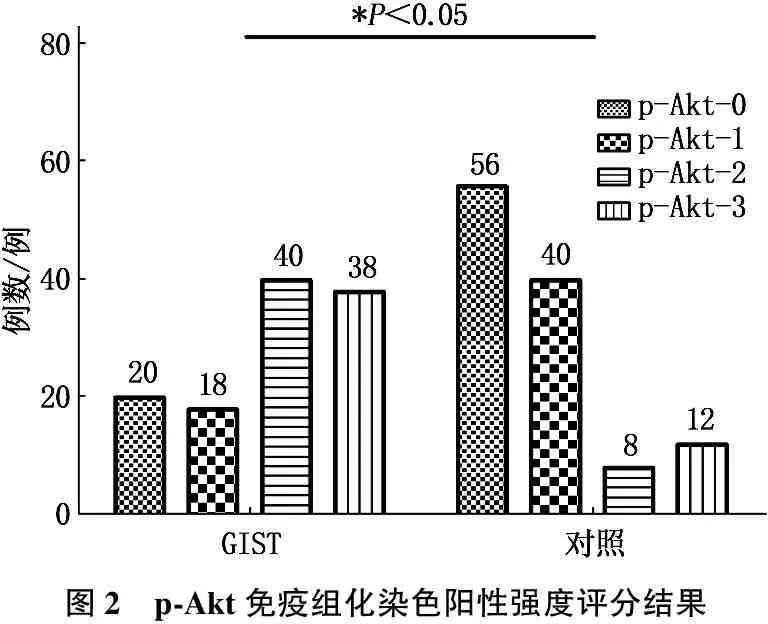
PTEN在研究组中的阳性表达率低于其在对照组的阳性表达率,差异有统计学意义(P<0.05), 而p-Akt在研究组中的阳性表达率高于其在对照组中的阳性表达率,差异有统计学意义(P<0.05)。见表1。
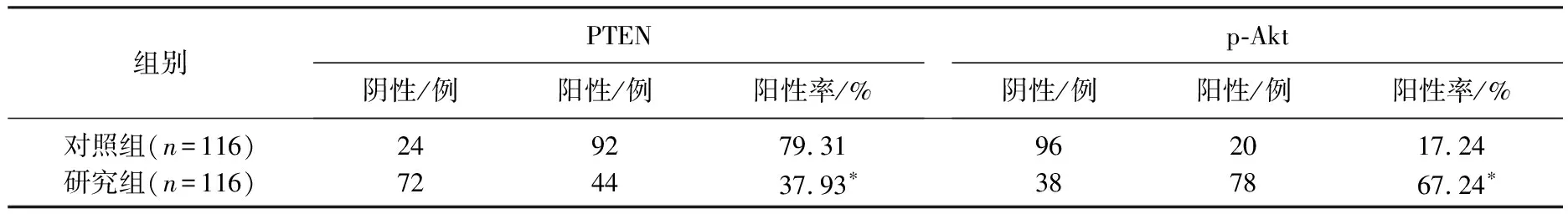
表1 PTEN和p-Akt在GIST组织和瘤旁正常组织中的表达率比较
2.2 PTEN、p-Akt表达水平与GIST临床病理特征的关系
116例GIST患者中,男64例,女52例,年龄22~70岁,平均(47.08±12.68)岁。GIST发生部位: 胃59例,直肠5例,空回肠35例,十二指肠17例; NIH危险度分级: 极低危和低危71例,中危和高危45例。PTEN、p-Akt在GIST组织中的表达情况与其病理性核分裂象、危险度分级、浸润深度有关(P<0.05),与患者的年龄、性别、肿瘤直径无关(P>0.05)。见表2。
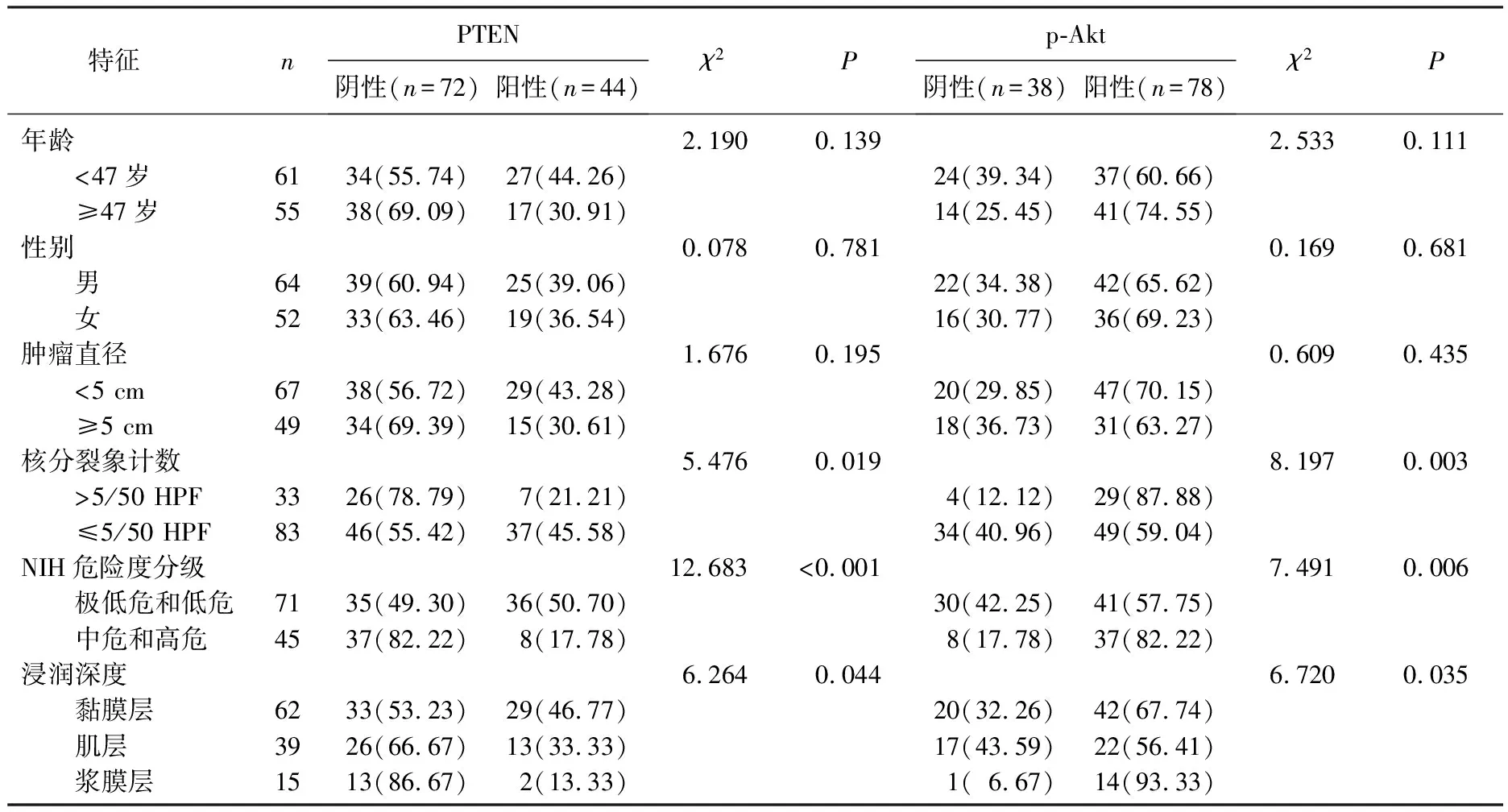
表2 PTEN、p-Akt表达水平与GIST临床病理特征的关系[ n(%)]
2.3 GIST组织中PTEN、p-Akt的相关性分析
GIST组织中PTEN与p-Akt的表达呈显著负相关(r=-0.635,P<0.001), 见表3。
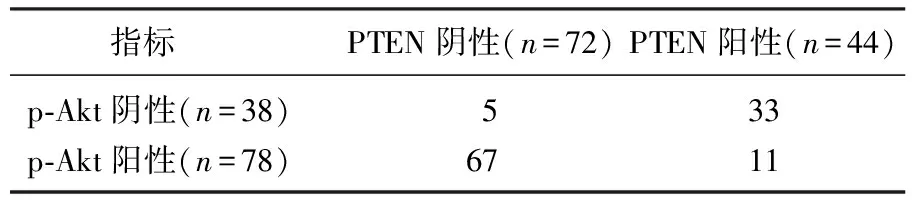
表3 GIST中PTEN、p-Akt相关性分析
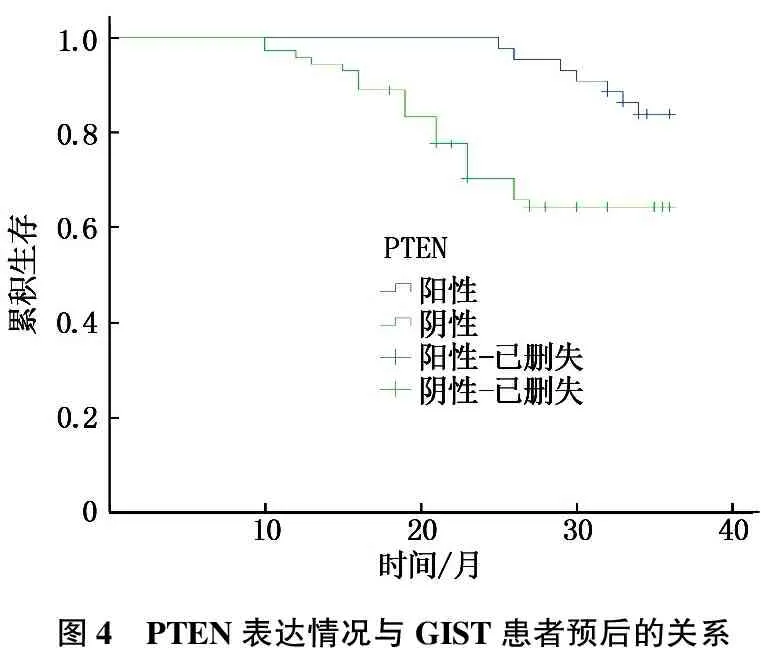
2.4 PTEN、p-Akt表达与GIST患者预后的关系
116例GIST患者中16例失访,失访率13.79%。Kaplan-Meier法单因素生存分析显示: PTEN阳性GIST患者的无复发生存时间为(34.54±0.46)个月,长于PTEN阴性GIST患者的(29.34±1.0)个月,差异有统计学意义(t=32.420,P<0.001); Log-rank检验结果:χ2=8.941,P=0.003, 见图4。p-Akt阴性GIST患者无复发生存时间为(34.83±0.40)个月,长于p-Akt阳性GIST患者(29.54±0.95)个月,差异有统计学意义(t=32.877,P=0.001); Log-rank检验结果,χ2=7.633,P=0.006, 见图5。
2.5 影响GIST患者预后的危险因素分析
单因素分析表明,年龄、危险度分级、核分裂象、浸润深度、PTEN阴性表达、p-Akt阳性表达情况均是影响GIST患者预后的因素(P<0.05)。
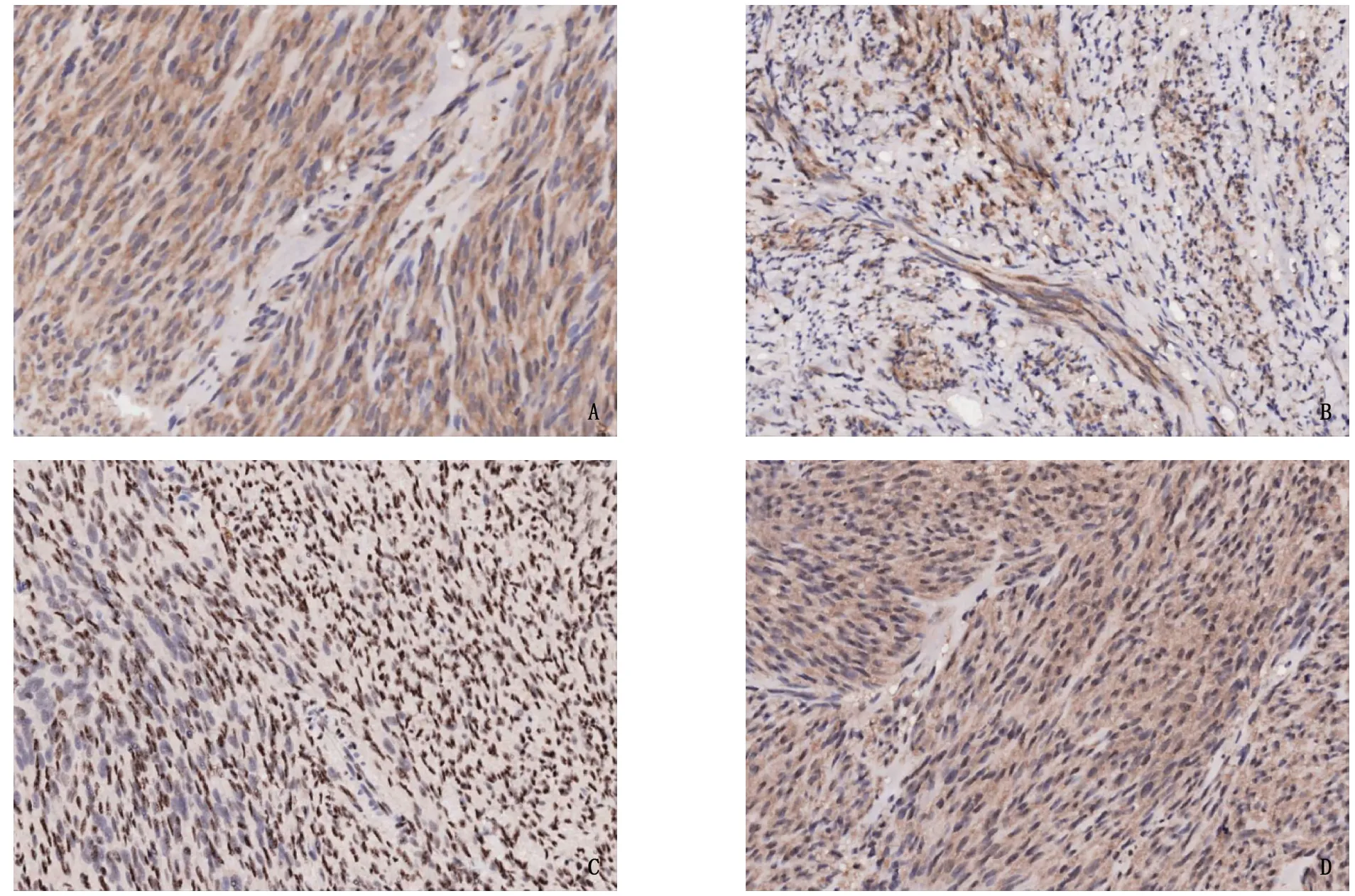
A: PTEN在GIST组织中细胞浆和细胞核的弥漫性强阳性表达; B: PTEN在GIST组织中细胞浆的弱阳性表达;C: p-Akt在GIST组织中细胞核的弱阳性表达; D: p-Akt在GIST组织中细胞浆和细胞核的弥漫性强阳性表达。
考虑到以上因素可能存在的交互作用,通过变量共线性分析,剔除危险度分级这一变量,将年龄、核分裂象、浸润深度、PTEN阴性表达、p-Akt阳性表达5个变量纳入Cox回归,多因素分析表明,核分裂象、浸润深度、PTEN阴性、p-Akt阳性表达均是导致GIST患者不良预后的危险因素(P<0.05)。见表4。
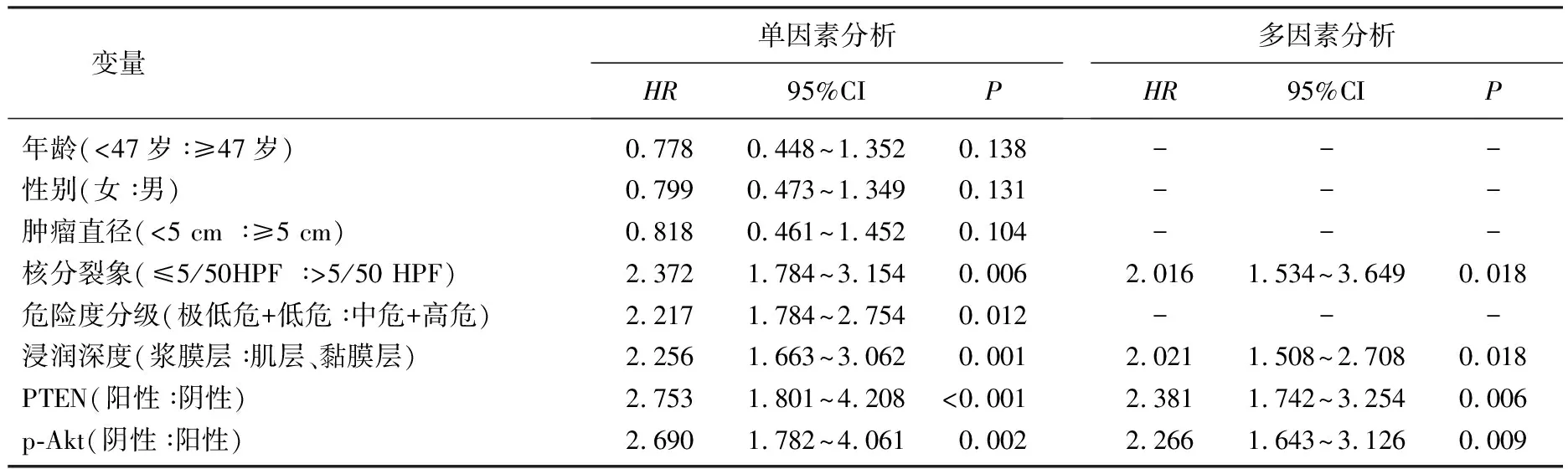
表4 影响GIST患者预后的危险因素分析

2.6 PTEN、p-Akt表达情况对GIST患者预后评估的价值
PTEN、p-Akt表达情况对GIST患者预后评估的敏感度、特异度、曲线下面积(AUC)见图6、7和表5。
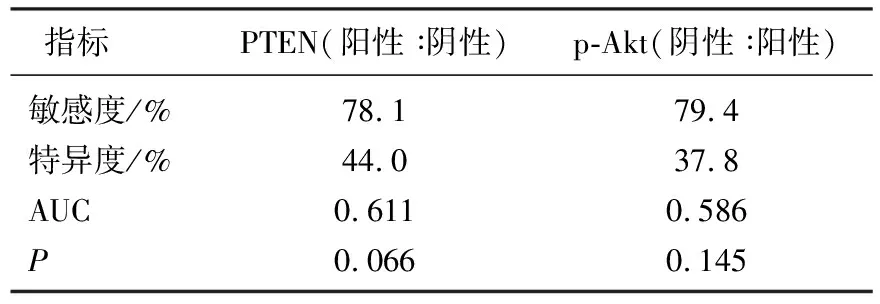
表5 PTEN、p-Akt表达情况对GIST患者预后评估的预测
3 讨 论
近年来GIST的发病率呈明显增高趋势[7]。GIST多发生于胃部(约60%), 其次为小肠(25%~30%), 少数发生于结直肠[8]。GIST的主要治疗方式是外科手术切除,但术后复发/转移率高。因此,寻找能够评估GIST发生、发展和预后的标志物非常重要。
PTEN蛋白具有脂质磷酸酶与蛋白磷酸酶2种活性,脂质磷酸酶活性是PTEN抑制肿瘤的主要功能基础[9]。人体多种正常组织中均存在PTEN蛋白的表达,但在相应的肿瘤组织中表达降低或缺失。本研究免疫组织化学分析显示, GIST组织中PTEN阳性表达率较瘤旁正常组织明显降低,其表达水平与病理性核分裂象、危险度分级、浸润深度呈负相关。相关研究[10]通过对食管癌的检测发现,晚期食管癌患者肿瘤组织中PTEN蛋白表达下调并且与病理分期和预后明显相关。
Akt蛋白激酶通过其介导的磷酸化过程调节下游分子活性,在促进肿瘤细胞增殖、存活和转移等方面发挥重要作用。研究[11-12]表明,由多种机制导致的Akt失调是众多人类恶性肿瘤(如胃癌、肺癌、卵巢癌、子宫内膜癌、乳腺癌和前列腺癌等)发生的特点之一。PI3K/Akt通路也是GIST细胞最关键的存活通路之一[4]。本研究免疫组织化学分析显示, GIST组织中p-Akt阳性表达率显著高于瘤旁正常组织,表达水平与病理性核分裂象、危险度分级、浸润深度有关,通过分析p-Akt表达变化,可能对评估GIST恶性程度有所帮助。本研究发现, GIST组织中PTEN蛋白与p-Akt蛋白的表达呈显著负相关,推测在GIST中, PTEN作为PI3K/Akt信号转导通路的一个主要负调节分子,可能通过一系列机制抑制Akt的磷酸化,从而起到抑制GIST细胞活化、增殖、侵袭的作用。当然,其具体分子机制还需要进一步研究阐明。
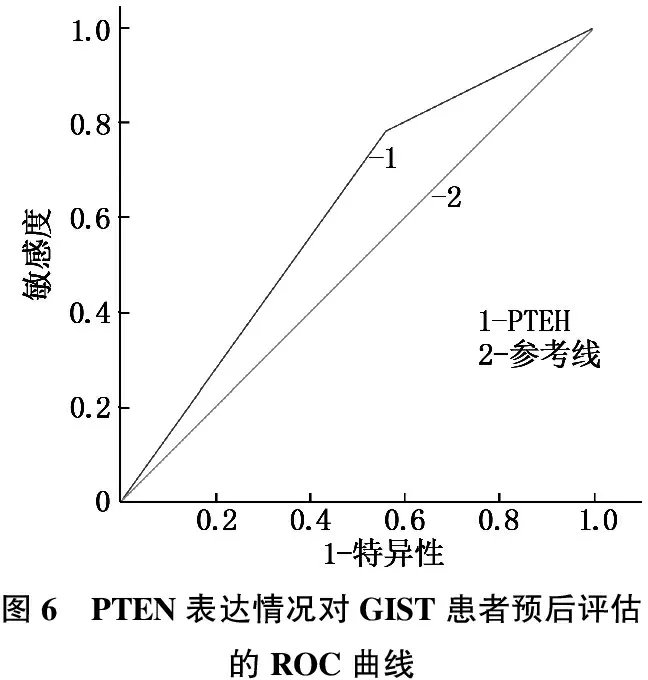
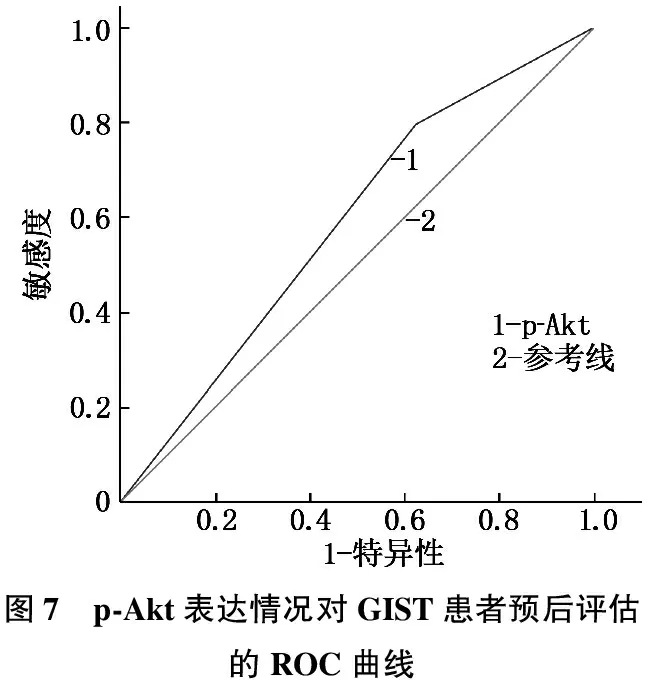
本研究同时观察到, PTEN在NIH极低危和低危组GIST肿瘤组织中表达水平相仿,而在中危和高危组中的表达水平明显下降; p-Akt在NIH极低危和低危组GIST肿瘤组织中表达水平相仿,而在中危和高危组中的表达水平显著升高(P<0.05)。单因素和多因素生存分析也显示,PTEN阴性表达和p-Akt的阳性表达是影响GIST预后的独立危险因素。这说明PTEN、p-Akt 蛋白表达水平与GIST 恶性进展及不良预后显著相关,进一步提示联合检测PTEN、p-Akt 蛋白的表达水平有利于评价病情、评估预后及指导治疗。由于本研究中ROC曲线分析未显示PTEN和p-Akt具有显著的预后预测能力,因此PTEN、p-Akt 蛋白的表达水平对GIST预后的预测能力仍有待进一步大样本量研究验证。目前正在临床试验中的Akt抑制剂包括capivasertib(AZD5363), MK-2206和ipatasertib(GDC-0068), 临床数据显示,在多种PTEN缺陷型肿瘤和异种移植模型中Akt抑制剂敏感性明显提高[13]。此外,在缺乏PTEN表达的完整或去势前列腺癌小鼠模型中, capivasertib已显示出强大的抗肿瘤作用,并提高了由PTEN/p53缺失驱动的侵袭性前列腺癌模型的生存率[14]。但目前关于此类药物在GIST中的报道较少。未来,开发恢复PTEN正常表达、抑制Akt磷酸化的药物,抑或是两类药物联合应用可能成为GIST药物治疗探索的方向之一。
综上所述, GIST组织中PTEN蛋白表达下降,而p-Akt蛋白的表达明显升高,与患者预后关系密切,可作为临床评估GIST患者预后的潜在标志物。
