疏肝化积汤对肝癌荷瘤小鼠CD4+CXCR5+ T细胞亚群和IL-6、IL-21、CXCR5的影响*
2021-11-06邹凤娇骆敏翔钱国强赵昌林
王 珍,邹凤娇,骆敏翔,钱国强,赵昌林
(1.广东祈福医院, 广东 广州 511495; 2.广东药科大学健康学院,广东 广州 510006)
肝癌是发病率和病死率均较高的恶性肿瘤,每年我国有38.3万例患者死亡,占世界肝癌死亡人数的51%[1],目前病死率仍持续上升[2]。肝癌的治疗方法包括手术治疗、介入治疗、靶向药物和免疫药物治疗等。针对肝癌癌前病变的干预和术后康复仍缺乏有效的措施,而中医药防治起着重要的作用[3]。中医药可调节机体内环境,重塑肿瘤免疫微环境。中药可调节主要组织相容性复合体(MHC)分子和Fas抗原/Fas抗原配体的表达,减弱肿瘤干细胞的致癌能力,促进树突状细胞成熟,调节辅助性T细胞1(Th1)/辅助性T细胞2(Th2)的平衡[4]。滤泡辅助性T细胞(Tfh)是CD4+T效应细胞亚群之一, CD4和趋化因子受体5(CXCR5)是其主要标记,参与慢性感染、B细胞免疫等过程,对感染性疾病的体液免疫起决定性调节作用;同时在自身免疫和肿瘤发生等疾病中具有重要作用,可激活抗肿瘤免疫细胞,增强机体的抗肿瘤作用。CXCR5是Tfh细胞表达的特有受体,Tfh 细胞通过分泌白细胞介素(IL)-21和IL-6,在促进B细胞免疫和抗肿瘤中起关键作用。临床研究表明:免疫激活和免疫耐受患者外周血中CD4+CXCR5+T细胞数量及IL-21水平明显升高[5-6];慢性乙肝患者外周血中CD4+CXCR5+T细胞升高,且与乙型肝炎病毒脱氧核糖核酸(HBV-DNA)载量呈负相关[7]。本研究观察了疏肝化积汤对肝癌移植瘤小鼠CD4+CXCR5+T细胞亚群和IL-6、IL-21、CXCR5的影响,探讨其治疗肝癌的作用机制。
1 材料与方法
1.1 动 物
无特定病原体(SPF)级C57BL/6小鼠40只,35~42 d龄,体质量(20±3)g,雌雄各半,购自广东省医学实验动物中心,动物生产许可证号为SCXK(粤)2013-0034,动物使用许可证号为44007200010001。适应性饲养1周,实验过程均遵守科技部颁发的《关于善待实验动物的指导性意见》的规定。本实验经广东祈福医院伦理委员会批准。
1.2 细 胞
H22肝癌细胞株,购自广东省医学实验动物中心。
1.3 药品、试剂与仪器
疏肝化积汤组成:柴胡10 g,党参10 g,制附片5 g,女贞子20 g,细辛5 g,桃仁10 g,红花10 g,桂枝10 g,半枝莲30 g等。药物由广东祈福医院制剂室提供并鉴定,使用前制成流浸膏,每毫升含生药0.87 g。顺铂注射粉针剂,山东齐鲁制药有限公司产品,产品批号6J015A89,10 mg/支。CD4(批号15004281)、CXCR5(批号25918541),均为美国eBioscience公司产品;反转录试剂iScript cDNA synthesis kit,美国BIO-RAD公司产品,批号1708890;定量PCR试剂ABI Power SYBR Green PCR Master Mix,美国ABI公司产品,批号1708891;苏木精-伊红(HE)染色试剂盒,北京百奥莱博科技有限公司,批号1708891BUN;IL-6、IL-21、CXCR5酶联免疫吸附试验试剂盒,上海联科生物科技公司产品,批号依次为118041125,226536078,540219677。PT-3502全自动酶标仪,北京普天技术有限公司产品;Ts2R/Ts2RFL倒置型荧光显微镜、成像系统,均为日本尼康公司产品;FACSCanto流式细胞仪,美国BD公司产品;ABI 7900 HT Sequence Detection System,美国Servicebio公司产品;包埋机,武汉俊杰电子有限公司产品。
1.4 模型的建立
将H22肝癌细胞株接种于C57BL/6小鼠腹腔,5 d后形成腹水;取乳白色腹水离心,调整细胞浓度为1×107/mL;取0.1 mL悬浮液接种于C57BL/6小鼠左侧胸部,形成肝癌移植瘤。接种5 d后,局部见硬性突起移植瘤,通过组织病理学检测,证实造模是否成功。
1.5 动物分组与给药
按随机数字表法将小鼠分为空白对照组、模型对照组、顺铂组和疏肝化积汤组,每组10只。空白对照组不进行干预,其他3组小鼠左侧胸部接种肝癌移植瘤。在造模成功48 h后开始给药,空白对照组、模型对照组给予生理盐水灌胃,5 μL/g体质量,1次/d,连续14 d;顺铂组给以顺铂腹腔注射,4 μg/g体质量,1次/d,连续3 d后停止给药。疏肝化积汤组给予疏肝化积汤5 μL/g体质量灌胃,连用14 d。
1.6 检测指标
14 d后断颈处死动物,摘除眼球取血,无菌状态下分离脾脏,剥离腋下肿瘤组织,进行检测。
1.6.1 一般情况
每天称量各组小鼠体质量,观察小鼠进食量、活动度、毛发及精神状态等。
1.6.2 瘤体生长情况
称量移植瘤的质量,并进行石蜡切片、苏木精-伊红染色,观察各组小鼠移植瘤的组织病理学变化。
1.6.3 血清IL-6、IL-21和CXCR5水平
采用酶联免疫吸附法检测。收集血清标本离心,加样,用封板膜封板后置37 ℃温育30 min,洗涤,每孔加入酶标试剂50 μL,温育,显色,每孔加终止液50 μL终止反应,上机测定。
1.6.4 脾淋巴细胞中CD4+CXCR5+T细胞亚群的数量
采用流式细胞学技术检测。脾脏剪碎,200目细胞筛上适度研磨。收集细胞混合液,以6 cm为离心半径、1 500 r/min转速离心15 min。将裂解后的悬浮细胞缓慢加在淋巴细胞分离液上。取中间的淋巴细胞,计数,定容量至1×107/mL,加1.25 μL荧光染料APC标记的CD4抗体(CD4-APC)和1.25 μL荧光染料PE标记的CXCR5抗体(CXCR5-PE),室温避光孵育30 min。另取样品加入5 μL荧光染料PE标记的CD90抗体(CD90-FE)、5 μL荧光染料PE标记的免疫球蛋白G (IgG-PE)进行对照,室温避光孵育30 min,用磷酸缓冲盐溶液洗涤2次。24 h内上机检测。
1.6.5 移植瘤中IL-6、IL-21和CXCR5的基因检测
采用实时定量荧光聚合酶链反应(PCR)检测,管家基因为β-actin,以ΔCt = Ct靶基因-Ct管家基因方法计算IL-6、IL-21和CXCR5基因的相对表达水平。引物由上海生工生物工程有限公司合成。常规提取H22肝癌移植瘤的核糖核酸(RNA)冻存。取出RNA,4 ℃下解冻,在0.2 mL PCR管中配制。将PCR管置于25 ℃ 5 min,42 ℃孵育30 min,85 ℃变性5 min,4 ℃保温。将PCR管置于PCR仪中进行反应,50 ℃孵育2 min,然后95 ℃孵育10 min;接着进行40个循环(95 ℃,15 s;60 ℃,1 min);最后进行数据分析。引物序列见表1。

表1 引物序列
1.7 统计学方法
2 结 果
2.1 各组小鼠一般情况对比
与模型对照组小鼠对比,疏肝化积汤组小鼠毛发光亮,能维持正常体质量和食欲,活动程度尚可。与空白对照组小鼠对比,疏肝化积汤组小鼠体质量、进食量、毛发和精神状态相似,但活动度有所减少。顺铂组小鼠明显消瘦,脱毛,进食量减少,活动度差。模型对照组进食量、活动度、毛发和精神状态介于疏肝化积汤组和顺铂组之间。
2.2 移植瘤的组织病理学变化及各组小鼠瘤体质量对比
移植瘤的组织病理学检查显示:细胞体积较大;核大深染,核仁清晰可见,核分裂现象多见;胞浆少,呈暗色嗜酸性染色,证实为H22肝癌移植瘤。与模型对照组对比,顺铂组和疏肝化积汤组的瘤体质量减少,差异有统计学意义(P<0.05)。疏肝化积汤组的瘤体质量与顺铂组对比,差异无统计学意义(P>0.05)。见表1。结果表明:顺铂与疏肝化积汤均可抑制H22肝癌移植瘤的生长,两者的抑制作用无显著差异。
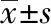
表2 各组小鼠瘤体质量对比
2.3 各组小鼠血清中IL-6、IL-21和CXCR5水平对比
与模型对照组、顺铂组和空白对照组对比,疏肝化积汤组小鼠血清中IL-6、IL-21和CXCR5水平升高,除CXCR5水平与模型对照组差异无统计学意义外,其他对比差异均有统计学意义(P<0.05或P<0.01)。与模型对照组对比,顺铂组的IL-6和CXCR5水平下降,IL-21水平升高,差异有统计学意义(P<0.05或P<0.01)。见表3。结果表明:H22肝癌移植瘤的形成引起小鼠免疫反应,表现为血清IL-6和CXCR5的水平升高;免疫细胞分泌功能下降,出现IL-21下降。疏肝化积汤可提高血清IL-6、IL-21和CXCR5的水平,而顺铂使血清IL-6和CXCR5的水平降低。两者的治疗作用机制不同。
表3 各组小鼠血清中IL-6、IL-21和CXCR5水平对比

表3 各组小鼠血清中IL-6、IL-21和CXCR5水平对比
组 别IL-6IL-21CXCR5空白对照组57.33±12.03 13.73±2.055.84±2.73 模型对照组106.15±23.7812.71±2.7810.76±3.65顺铂组81.87±22.85∗∗19.81±3.82∗∗∗6.17±2.85∗∗∗疏肝化积汤组143.23±42.15∗∗∗###△△△39.43±12.23∗∗∗###△△△14.33±4.15∗###△△△
注:与模型对照组对比,* P>0.05,**P<0.05,***P<0.01;与顺铂组对比,# P>0.05,## P<0.05,### P<0.01;与空白对照组对比,△△△ P<0.01。
2.4 各组小鼠脾淋巴细胞中CD4+CXCR5+ T细胞亚群数量对比
与模型对照组、顺铂组和空白对照组对比,疏肝化积汤组CD4+CXCR5+T细胞亚群的数量升高,差异有统计学意义(P<0.01)。与模型对照组对比,顺铂组CD4+CXCR5+T细胞亚群的数量下降,差异有统计学意义(P<0.01)。见表4。结果表明: H22肝癌移植瘤的形成引起小鼠免疫反应,CD4+CXCR5+T细胞的数量升高;疏肝化积汤可提高小鼠的免疫功能,表现为脾脏CD4+CXCR5+T细胞亚群数量的显著增加;而顺铂可导致其数量下降。
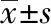
表4 各组小鼠脾淋巴细胞中CD4+CXCR5+ T细胞亚群数量对比
2.5 各组小鼠移植瘤中IL-6、IL-21和CXCR5基因表达对比
与模型对照组对比,疏肝化积汤组IL-6、IL-21和CXCR5的基因表达升高,差异有统计学意义(P<0.05)。与顺铂组对比,疏肝化积汤组IL-6、IL-21和CXCR5的基因表达升高,差异有统计学意义(P<0.01)。见表5。结果表明:经过疏肝化积汤治疗,H22肝癌移植瘤中IL-6、IL-21和CXCR5的表达升高,而顺铂治疗后肿瘤微环境中IL-6、IL-21和CXCR5的表达降低。两者治疗作用机制不同。
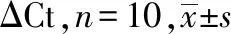
表5 各组小鼠移植瘤中IL-6、IL-21和CXCR5基因表达对比
3 讨 论
中医药可延缓恶性肿瘤的进展,延长生存时间,提高生活质量。本实验结果显示,疏肝化积汤可保持小鼠毛发光亮,维持正常体质量、食欲和良好的活动度,可抑制H22肝癌移植瘤生长,治疗效果与顺铂相似。
目前,中医药治疗肝癌的作用机制研究主要在诱导细胞凋亡和提高免疫功能等方面,如:白藜芦醇可诱导HepG2细胞凋亡[8],熊果酸、芍药醇、藤黄酸可抑制人肝癌细胞生长并诱导凋亡[9-11],复方制剂能够提高免疫抑制小鼠的体液免疫和细胞免疫反应[12]。在本项研究中,H22肝癌移植瘤形成时,小鼠脾脏CD4+CXCR5+T细胞亚群的数量升高,血清IL-6和CXCR5的水平升高,属于免疫反应;而IL-21出现下降,提示CD4+CXCR5+T细胞的功能受到抑制;疏肝化积汤可以提高小鼠脾脏CD4+CXCR5+T 细胞亚群的数量,血清IL-6、IL-21和CXCR5的水平也显著升高;而使用顺铂化疗后,肝癌移植瘤小鼠的免疫功能受抑,CD4+CXCR5+T 细胞亚群的数量下降,血清IL-6和CXCR5的水平降低。表明顺铂和疏肝化积汤的治疗作用机制不同,疏肝化积汤以提高免疫功能为主。
在肝癌移植瘤微环境中,疏肝化积汤可提高IL-6、IL-21和CXCR5的基因表达。CD4+CXCR5+T细胞表达CXCR5和Bcl-6,主要分泌IL-21[13]。CD4+CXCR5+T细胞是抗原特异性B细胞反应的重要调节因子,B细胞趋化剂CXCL13与CD4+CXCR5+T细胞在肿瘤微环境中浸润,可提高癌症生存率[14]。Tfh细胞参与抗肿瘤免疫反应,甲状腺癌远处转移患者血清中的IL-10、IL-21和CXCL13的表达明显低于健康对照人群和局部疾病患者,远处转移者血液循环中的Tfh细胞对B细胞生长和IgM分泌的支持能力较差。CD4+CXCR5+T细胞亚群功能缺陷,恶性肿瘤易出现转移[15]。研究表明,白术、黄芪、党参、柴胡等可提高机体免疫力,黄芪甲苷可显著抑制HBV抗原的分泌,对HBsAg、HBeAg均有明显的抑制作用[16]。本实验中结果表明:疏肝化积汤可以提高肝癌移植瘤中IL-21、IL-6、CXCR5的基因表达,使CD4+CXCR5+T细胞在肝癌免疫微环境中浸润,改善肿瘤的免疫微环境,起到抗肿瘤作用;而顺铂则起到抑制作用,使CD4+CXCR5+T细胞在肿瘤免疫微环境中减少。
综上所述,疏肝化积汤可提高CD4+CXCR5+T细胞亚群的数量和功能,改善肿瘤免疫微环境,从而起到抗肿瘤作用。
