RNAi沉默王浆主蛋白1(Mrjp1)基因对意大利蜜蜂工蜂学习和记忆的影响
2021-11-06蔚添添邱园妹候梦赏王天宝苏松坤李志国
蔚添添, 邱园妹, 候梦赏, 王天宝, 苏松坤, 李志国
(福建农林大学动物科学学院(蜂学学院),福州 350002)
蜜蜂作为典型的社会性昆虫,拥有与其他昆虫类似且相对简单的神经系统以及数量较少的神经元(Pahletal., 2010)。蜜蜂脑体积虽小却拥有强大认知能力,因此成为多种研究领域的模式昆虫。蜜蜂工蜂存在依赖于日龄的劳动分工,工蜂在低日龄时主要从事一些巢内的工作,达到一定日龄时转而担任外界的采集任务(Johnson, 2010),这种剧烈的内外环境变化以及职能的转变,导致不同日龄的工蜂感官能力不同,从而呈现出不同水平的认知能力(Groh and Rössler, 2020)。认知能力是蜜蜂等社会性昆虫在野外赖以生存的基本能力,例如采集蜂依靠空间认知来寻找蜜源(Zhangetal., 2000),通过气味学习来识别花的气味(Pahletal., 2010),以及联想记忆来记住花的颜色或形状(Bittermanetal., 1983; Horietal., 2006)等,甚至巢内的蜂群正常秩序也必须依靠蜜蜂识别各种调节信息素来维持(Kucharskietal., 1998)。在蜜蜂认知能力中,基于伸吻反应(proboscis extension response, PER)的蜜蜂嗅觉学习,已被广泛应用于研究与蜜蜂学习相关的神经生理机制及研究生物和非生物因子胁迫对蜜蜂嗅觉学习的影响(Laloietal., 2001; Matsumotoetal., 2012; Wuetal., 2017)。
蜂王浆是蜂王和蜜蜂幼虫的主要食物,分为水溶性蛋白和非水溶性蛋白(Simúth, 2001)。蜂王浆由蜜蜂工蜂咽下腺与上颚腺所分泌,具有抗高血压,抗感染和抗氧化作用(Kimuraetal., 1996; Watanabeetal., 1998)。蜂王浆的主要营养成分为王浆主蛋白(major royal jelly proteins, MRJPs),MRJPs家族目前为止有9个成员(MRJP1~MRJP9)。MRJPs是多功能蛋白,主要参与蜜蜂生理、发育和行为等的调控(Buttstedt,etal., 2014)。研究显示,蜂王浆可提高人体U-937细胞(Watanabeetal., 1998)和小鼠肝细胞的增殖速率,也可促进小鼠肝细胞DNA的合成(Kamakuraetal., 2001)。随后,Majtan等(2010)证明MRJP1可以促进角质细胞的增殖,表明MRJP1可能是王浆中促进细胞增殖的主要作用因子。蜂王浆是促进幼虫发育成蜂王的主要食物,其中王浆中的MRJP1被证明是幼虫发育成蜂王的关键调控因子(Kamakura, 2011)。王浆主蛋白1(major royal jelly protein 1, MRJP1)占蜂王浆水溶性蛋白含量的48%(Srisuparbhetal., 2003),是蜂王浆的主要蛋白组分。研究表明,MRJP1在蜜蜂体内分布广泛,除在哺育蜂和外勤蜂的咽下腺中大量表达之外,在雄蜂和蜂王体内也检测到Mrjp1基因表达(Drapeauetal., 2006; Huangetal., 2012)。 同时,MRJP1也在蜜蜂脑细胞间隙中表达,说明MRJP1很可能以一种分泌蛋白的形式存在(Lietal., 2019)。MRJP1在蜜蜂脑部可能作为蛋白质合成的储备氨基酸,在哺育蜂向采集蜂发育过程和行为转变过程中合成王浆主蛋白发挥作用(Tamuraetal., 2009)。随着对MRJP1的深入研究发现,MRJP1除了具有丰富的营养价值外,还具有多种生物学功能和保健功效(Tamuraetal., 2009),并可能参与调控蜜蜂行为。有研究表明,脱离蜂群饲养的蜜蜂学习能力低于蜂群中蜜蜂学习能力,检测发现脱离蜂群饲养的蜜蜂体内Mrjp1表达降低(Lietal., 2019)。同时,前人研究发现MRJP1也在蜜蜂脑部的蘑菇体中高表达,蘑菇体正是涉及蜜蜂学习与记忆的神经中枢(Kucharskietal., 1998)。受吡虫啉胁迫蜜蜂的嗅觉学习能力下降,同时,其大脑中的Mrjp1表达显著下调(Desneuxetal., 2007; Lietal., 2019)。
目前关于MRJP1在蜜蜂中的功能与作用研究已有一定进展,但是关于MRJP1表达在蜜蜂学习与记忆过程中起到的确切作用的研究却鲜有报道。利用RNA干扰(RNA interference, RNAi)技术将Mrjp1基因表达沉默后,研究Mrjp1基因表达与蜜蜂嗅觉学习之间的关系,进一步挖掘和验证MRJP1的潜在生物学功能,为蜜蜂学习的分子机制提供佐证。
1 材料与方法
1.1 供试材料
供试意大利蜜蜂Apismelliferaligustica(简称“意蜂”)取自福建农林大学动物科学学院(蜂学学院)实验蜂场。从蜂场4个不同蜂群分别取出1张健康封盖子脾,放入4个限王产卵器中,在恒温恒湿培养箱中培养(温度34±1℃,相对湿度40%±10%,黑暗),每天用不同颜色的油漆笔对刚出房的蜜蜂工蜂胸部进行标记,连续标记4 d。标记后的蜜蜂放入蜂群中,待蜜蜂达到12日龄时从蜂群中取出,用于后续试验。
1.2 蜜蜂脑部总RNA提取
对3头蜜蜂样本进行解剖,获得完整、干净的脑。将3个脑置于1.5 mL离心管中,加入700 μL的Trizol试剂和两颗磁珠,于组织破碎仪中震荡研磨;研磨后继续加入300 μL的Trizol试剂,室温静置10 min;加入200 μL氯仿,于旋涡振荡器剧烈振荡数十秒,使两相彻底混匀,室温静置3 min后,4℃ 12 000 g离心15 min;将上清液转移至1.5 mL离心管,加入500 μL异丙醇,室温静置10 min后,4℃ 12 000 g离心10 min,弃上清;加入1 mL预冷75%乙醇[无水乙醇∶DEPC=3∶1(v/v)配制],轻弹悬浮沉淀,上下颠倒充分洗涤,4℃ 7 400 g离心5 min,弃上清,重复洗涤两次;将离心管置于超净工作台中风干10 min,干燥沉淀;加入30 μL RNA溶解水,反复吸打几次,55℃金属浴中加热5 min。利用NanoDrop 2000核酸浓度测定仪测定RNA的质量和浓度。OD260/OD280值在1.9~2.1之间的RNA为合格,并用1%的琼脂糖凝胶电泳检测RNA降解程度,置于-80℃保存。
1.3 RNA反转录为 cDNA
首先使用 TaKaRa PrimeScriptTMRT Reagent Kit with gDNA Eraser 试剂盒去除RNA中的基因组 DNA,按照说明书在冰上配制反应混合液,反应体系: 5×gDNA Eraser Buffer 2 μL, gDNA Eraser 1 μL, 用移液枪吸取3 μL, RNA 1 μg, 最后加入RNase-Free dH2O将反应体系补足至10 μL。42℃反应2 min。随后往上述反应体系继续加入PrimeScript RT Enzyme Mix Ⅰ 1 μL, RT Primer Mix 1 μL, 5×PrimeScript BufferⅡ 4 μL和 RNase-Free dH2O 4 μL混合均匀。37℃反应15 min,85℃反应5 s 后4℃保存。
1.4 基因引物设计和扩增
通过NCBI确定Mrjp1基因的CDS区域,利用Primer Premier 5.0设计扩增该基因引物,经RT-PCR(reverse transcription PCR, RT-PCR)扩增,获得基因序列长度为654 bp。增强绿色荧光蛋白(enhanced green fluorescent protein, EGFP)基因与蜜蜂无同源基因,作为对照基因,扩增出的基因序列长度为720 bp,序列片段位于6 895-7 614 bp。引物序列信息见表1。

1.5 dsRNA合成与纯化
将cDNA进行PCR扩增,反应产物使用1%琼脂糖凝胶进分离,随后通过Wizard DNA Clean-up System (Promega)试剂盒切胶回收纯化后,将扩增的Mrjp1基因片段克隆到质粒载体pEASY-T3中,并根据试剂盒说明书将重组质粒转化到Trans1-T1感受态细胞中。通过琼脂糖凝胶电泳分析和测序筛选出携带含有Mrjp1基因片段的重组质粒的阳性克隆。 根据说明书使用T7 RiboMAXTMExpress RNAi试剂盒(Promega)将含有Mrjp1的重组质粒和T7启动子标签的Mrjp1引物用于Mrjp1 dsRNA合成。使用相同的方法,使用pGFP载体和T7启动子标签的EGFP引物合成EGFPdsRNA。相关引物序列信息见表1。合成后纯化dsRNA:沉淀dsRNA,向离心管中按照dsRNA∶NaAC=10∶1(v/v)添加4 μL 3 mol/L NaAC(pH 5.2),按照dsRNA∶异丙醇=1∶1的比例(v/v)添加40 μL异丙醇,混合均匀后在冰上放置5 min,在NaAc和异丙醇沉淀作用下出现混浊;清洗沉淀,微型离心机高速旋转10 min,在离心管底部可见白色沉淀,弃上清,向离心管中加入0.5 mL冰浴过的70%乙醇,13 000 g离心5 min,此步骤重复两遍;干燥,在通风橱中室温干燥15 min,除掉残余的乙醇;溶解,将RNA沉淀重新悬浮在Nuclease-Free Water中。用1%琼脂糖凝胶检查dsRNA的完整性,然后用Nuclease-Free Water进一步稀释以获得最终浓度5 μg/μL,-80℃储存用于后续注射实验。
1.6 RNAi干扰时效检测
抓取12日龄意蜂工蜂,将蜜蜂单独装入小瓶中于冰上麻醉,待蜜蜂一动不动后取出进行注射。利用拉针仪处理后的毛细管吸取2 μL dsRNA(5 μg/μL)从蜜蜂的第4-5腹节节间膜注入蜜蜂血淋巴中,若被注射蜜蜂有血淋巴渗出,则丢弃该蜜蜂。对照组dsEGFP和处理组dsMrjp1分别注射60头蜜蜂,分别在24 h和48 h后液氮冻毙取样,之后进行qRT-PCR检测对照组和处理组在两个时间点的Mrjp1相对表达量,确定注射时效。反应体系: 2×SYBR Premix Ex Taq Ⅱ 5 μL, PCR Primer(F+R)(10 μmol/L) 0.8 μL, cDNA 1 μL, RNase-Free dH2O 3.2 μL(引物信息见表1)。qRT-PCR程序: 95℃ 30 s; 95℃ 5 s, 60℃ 30 s, 40个循环;添加熔解曲线: 65℃ 5 s, 95℃ 0.5 s。
1.7 dsRNA的注射
dsEGFP和dsMrjp1抓取12日龄工蜂,每25头为一组,处理组与对照组各设置3组重复。处理组注射dsMrjp1,对照组注射dsEGFP。将蜜蜂于冰上麻醉,待蜜蜂冷冻麻醉后进行注射。利用拉针仪处理后的毛细管吸取2 μL dsRNA(5 μg/μL)从蜜蜂腹部背面第4-5腹节节间膜注入蜜蜂体内,若被注射蜜蜂有血淋巴渗出,则丢弃该蜜蜂。注射完成后,在恒温恒湿培养箱中(温度30±1℃,相对湿度40%±10%,黑暗)饲养48 h后做气味联想性学习实验。
1.8 联想性学习实验
1.8.1固定蜜蜂:将蜜蜂置于特制的固定装置前,单头意蜂工蜂转移至小玻璃瓶中,并冰上冷冻麻醉。待蜜蜂冻晕后立即取出,将蜜蜂固定于特制铜管,只留其头部在管外,保证吻部能自由活动。为了减小冷冻和饱食对蜜蜂行为的影响,将固定好的蜜蜂重新放入恒温恒湿培养箱(温度30±1℃,相对湿度40%±10%,黑暗)中2 h。
1.8.2气味联想性学习:参考Bitterman等(1983)描述的方法对意蜂进行气味联想性学习实验。选择对50%(w/v)蔗糖溶液有伸吻反应的意蜂工蜂作为实验对象。实验过程中呈现1-壬醇和己醇两种不同的气味,1-壬醇(条件刺激,CS)与糖水奖励(非条件刺激,US)配对训练(CS+),己醇作为对照气味,不与糖水奖励相配对(CS-),按照ABABBABAAB顺序对每头蜜蜂分别进行5次联想性学习和非联想性学习。首先将蜜蜂置于空气流中适应15 s,单独通入1-壬醇3 s,用50%(w/v)糖水触碰蜜蜂触角引发PER行为;与1-壬醇联想训练1 s后,撤掉1-壬醇,奖励蜜蜂50%(w/v)糖水2 s,最后蜜蜂处于空气流中20 s,视为一次气味联想性学习。而非联想性学习则只提供己醇,蜜蜂不进行气味与糖水奖励配对训练。每头蜜蜂进行两种学习试验间隔为10 min。在单独通入1-壬醇或己醇的2 s时间内观察蜜蜂是否有伸吻反应,有PER行为的记为“+”,无PER行为的记为“-”,5次联想性学习分别为C1-C5。5次学习后的蜜蜂立即用液氮冻毙,蜜蜂样本储存在-80℃用于下一步分析。
1.8.32 h记忆测试:意蜂工蜂5次学习完成后放入恒温恒湿培养箱(温度30±1℃,相对湿度40%±10%,黑暗)中,2 h后测定蜜蜂记忆。记忆测试单独用1-壬醇气味对每头蜜蜂进行刺激,记录伸吻状况。若对1-壬醇气味刺激表现出伸吻反应,表明该蜜蜂对1-壬醇气味表现出记忆,记为“+”;若对1-壬醇气味刺激未表现出伸吻反应,表明该蜜蜂对1-壬醇气味未表现出记忆,记为“-”。2 h记忆测试完成后的蜜蜂立即用液氮冻毙,蜜蜂样本储存在-80℃用于下一步分析。
1.9 RT-qPCR验证
随机抽取2 h记忆测试后的 dsEGFP组和dsMrjp1组样本cDNA各5个,利用SYBR®Premix Ex TaqTMⅡ(TaKaRa)荧光定量PCR试剂盒检测样本脑部Mrjp1基因的相对表达量,内参基因为actin和rp49。反应体系: 2×SYBR Premix Ex Taq Ⅱ 5 μL, PCR Primer(F+R)(10 μmol/L) 0.8 μL, cDNA 1 μL(在初始cDNA基础上以1∶3稀释), RNase-Free dH2O 3.2 μL(引物信息见表1)。程序: 95℃ 30 s; 95℃ 5 s, 60℃ 30 s, 40个循环;添加熔解曲线: 65℃ 5 s, 95℃ 0.5 s。
1.10 数据分析
利用SPSS19.0软件进行数据处理。记录对照组和处理组蜜蜂在配对训练(CS+)与非配对训练(CS-)中伸吻数量,通过卡方检验分析处理组与对照组蜜蜂联想性学习与记忆差异。RT-qPCR验证时选择actin和rp49作为内参基因,利用两者的几何平均值归一目标基因的Ct值(Lourençoetal., 2008; Villar and Grozinger, 2017),计算△Ct(测试样本)=Ct(目标)-Ct(内参),△Ct(校准样本)=Ct(校准)-Ct(内参);用校准样本的△Ct 归一测试样本的△Ct值,即△△Ct=△Ct(测试样本)-△Ct(校准样本),相对表达量=2-△△Ct。利用独立样本t检验分析对照组与处理组之间基因相对表达量差异显著性。
2 结果
2.1 dsRNA干扰时效
通过qRT-PCR检测24 h和48 h两个时间点的沉默效果。结果显示,注射24 h后dsMrjp1的干扰效果不明显,注射48 h后dsMrjp1在蜜蜂体内发挥作用,与dsEGFP注射组相比,dsMrjp1注射组的Mrjp1相对表达量显著下调(图1)。因此,选择注射后48 h作为dsMrjp1干扰效果最明显的时间点并进行后续行为实验。
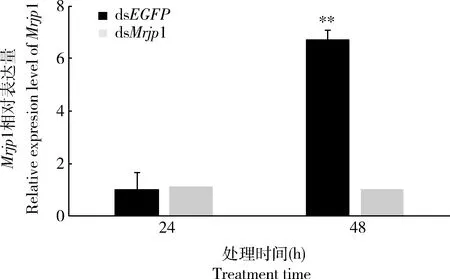
图1 意大利蜜蜂工蜂体内dsMrjp1的RNA干扰时效Fig. 1 Efficiency of RNA interference with dsMrjp1 in Apis mellifera ligustica workers over time柱上双星号表示在同一处理时间点dsMrjp1注射组与dsEGFP注射组(CK)间Mrjp1的相对表达量经独立样本t检验差异极显著(P<0.01)。Double asterisk above bar indicates extremely significant difference in the relative expression level of Mrjp1 between the dsMrjp1-injected group and the dsEGFP-injected group (CK) at the same treatment time point by independent samples t-test (P<0.01).
2.2 RNAi沉默Mrjp1对蜜蜂气味学习的影响
将蜂群中取出的12日龄蜜蜂注射dsEGFP(对照组)和dsMrjp1(处理组),48 h后检测蜜蜂学习能力,在5次联想性学习训练后,结果如图2所示。对照组和处理组蜜蜂在5次配对训练(CS+)中,从第2次训练开始,对照组蜜蜂的学习能力优于dsMrjp1组蜜蜂,随训练次数的增加,两组蜜蜂的学习能力差异增大。在第3-5次训练(C3-C5)中,对照组(n=69)伸吻反应率为67%~70%,处理组(n=79)伸吻反应率为48%~50%,两组学习结果存在显著性差异(C3: χ2=4.441,P<0.05; C4: χ2=5.369,P<0.05; C5: χ2=5.244,P<0.05)。结果表明RNAi沉默Mrjp1对蜜蜂学习产生抑制影响。
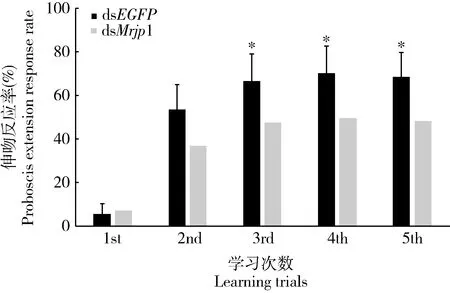
图2 注射48 h后dsMrjp1对意大利蜜蜂工蜂学习的影响Fig. 2 Effects of dsMrjp1 on learning in Apis melliferaligustica workers at 48 h after injection星号表示在第3-5次学习实验中dsMrjp1注射组与dsEGFP注射组(CK)喙伸反应率经χ2检验差异显著(P<0.05)。Single asterisk indicates that the proboscis extension response rates from the 3rd to the 5th learning experiments are significantly different by χ2 test between the dsMrjp1-injected group and the dsEGFP-injected group (CK).
2.3 RNAi沉默Mrjp1对蜜蜂记忆的影响
RNAi沉默Mrjp1对蜜蜂记忆的影响结果如图3所示,学习2 h后,dsMrjp1注射组蜜蜂对条件刺激(1-壬醇气味)的伸吻反应率比dsEGFP注射组略低。dsMrjp1注射组(n=66)记忆比率为55%,dsEGFP注射组(n=59)记忆比率为66%,dsMrjp1注射组2 h记忆结果低于dsEGFP注射组,但两者之间差异不显著(χ2=0.758,P>0.05),即RNAi沉默Mrjp1对蜜蜂记忆没有显著抑制影响。
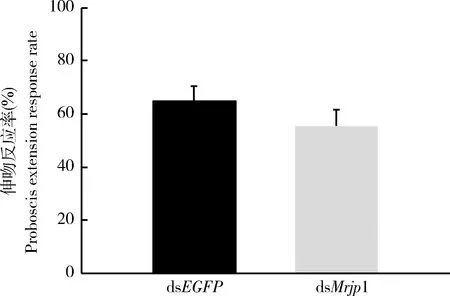
图3 注射dsMrjp1和dsEGFP 48 h后意大利蜜蜂工蜂2 h记忆的比较Fig. 3 Comparison of 2 h memory in Apis mellifera ligusticaworkers at 48 h after injection with dsMrjp1 and dsEGFP
2.4 RT-qPCR验证蜜蜂脑部Mrjp1基因的表达水平
将学习后的蜜蜂液氮冻毙后,对其脑中Mrjp1基因表达进行定量分析,结果如图4。结果表明dsEGFP注射组中Mrjp1基因的相对表达量显著性高于dsMrjp1注射组中Mrjp1基因相对表达量(P<0.05),进一步证明通过向蜜蜂体内注射dsMrjp1后,成功抑制了Mrjp1基因的表达,降低了Mrjp1基因在蜜蜂脑中的相对表达量,从而抑制蜜蜂学习。
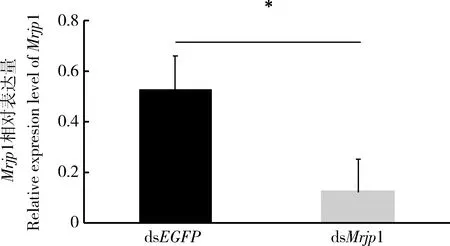
图4 注射dsMrjp1和dsEGFP 48 h后学习2 h的意大利蜜蜂工蜂脑中Mrjp1相对表达量Fig. 4 Relative expression levels of Mrjp1 in brains ofApis mellifera ligustica workers learning for 2 h at 48 h after injection with dsMrjp1 and dsEGFP柱上星号表示Mrjp1的相对表达量在dsEGFP注射组(CK)和dsMrjp1注射组间经独立性t检验有显著性差异(P<0.05)。Single asterisk above bar indicates significant difference in the relative expression level of Mrjp1 between the dsMrjp1-injected group and the dsEGFP-injected group (CK) by independent samples t-test (P<0.05).
3 讨论
研究表明蜂王浆可影响大鼠的认知行为,其空间记忆力可通过口服蜂王浆得到改善(Pyrzanowskaetal., 2014),但是尚未揭示其主要活性成分。另外,有研究发现脱离蜂群饲养的蜜蜂学习能力下降,其蘑菇体内的Mrjp1表达水平也显著下调(Hojoetal., 2010)。这些研究表明,MRJP1除了具有营养功能以外,与蜜蜂认知行为也存在一定的联系。前期研究发现,吡虫啉处理后的蜜蜂头部Mrjp1和Mrjp4基因表达受到抑制(Wuetal., 2017),气味学习能力较弱,蜜蜂脑部表现出较低的Mrjp1基因表达水平(Hojoetal., 2010)。本研究利用RNAi技术沉默Mrjp1基因后,发现蜜蜂嗅觉学习能力受损,记忆力则没有受到影响(图3)。蜜蜂的学习机制复杂,可能受到多个基因联合调控,仅沉默Mrjp1只是降低蜜蜂学习能力(图2),即处理组蜜蜂需要接受更多次数的训练才能达到与对照组相同学习结果。RNAi后两组蜜蜂的2 h记忆无显著差异(图3),这可能是由于基于RNAi的蜜蜂体内的Mrjp1干扰效果具有时效性。此外,本研究通过RNAi技术沉默Mrjp1,结果表明蜜蜂脑部Mrjp1表达下调后(图4),蜜蜂的嗅觉学习能力显著下降(图2),进一步证明MRJP1参与调控蜜蜂嗅觉学习过程。
MRJP1是王浆主蛋白中丰度最高的可溶性蛋白,在蜜蜂脑部不同区域均有不同程度的表达,其中在中间神经元的纤维和细胞周区域的表达丰度比其他区域更高(Peixotoetal., 2009),因此推测MRJP1可能参与了蜜蜂神经系统的发育。此外,蜜蜂在脑部蘑菇体中高表达,其表达水平随着蜜蜂年龄的变化而变化(Kucharski and Maleszka, 1998)。蜜蜂蘑菇体的主要感觉输入区(花萼)较大,主要接受嗅觉和视觉感官的输入(Giurfa, 2013; Groh and Rössler, 2020)。蜜蜂的嗅觉联想性学习主要是通过整合蘑菇体中的感官信息建立的(Menzel, 1999; Giurfa, 2007)。研究表明,蜜蜂在职能转变的过程中,其蘑菇体结构发生显著的变化(Schulz and Robinson, 1999)。这种结构的变化同时伴随着MRJP1表达水平的变化,表明MRJP1可能参与调控蘑菇体的发育。蘑菇体是由密集排列的平行神经元组成,这些神经细胞构成了处理蜜蜂大脑中信息和记忆的大脑中心,称为Kenyon细胞(Peixotoetal., 2009)。蜜蜂脑部大约有368 000个Kenyon细胞,占脑神经元总数的40%以上(Strausfeld, 2002)。MRJP1可在Kenyon细胞内特定表达,但是其具体功能尚不清楚(Kucharski and Maleszka, 1998)。此外,蜜蜂在嗅觉学习过程中会涉及大脑的特定区域(Farooquietal., 2003),还需要进一步的研究来确定在蜜蜂嗅觉学习时MRJP1在脑部的高表达区域,从而进一步深入挖掘相关的调控通路,探索其调控分子机制。另外,当蜜蜂到达采集日龄时,除了嗅觉学习以外,蜜蜂的学习还包括食物定位、归巢导航、食物信息传递等。因此,MRJP1是否参与蜜蜂相对高级的学习过程,还需要进一步的探索。
