新型冠状病毒感染者咽拭子病毒载量与抗体水平的动态分析
2021-11-06胡金曹沈瀚陶月李雷张永臣宁明哲
胡金曹,沈瀚,陶月,李雷,张永臣,宁明哲
(1.南京大学医学院附属鼓楼医院 检验科,江苏 南京 210008; 2.南京中医药大学附属南京医院/
2019年12月以来,严重急性呼吸综合征冠状病毒2(severe acute respiratory syndro me coronavirus 2, SARS-CoV-2)感染引发的新型冠状病毒肺炎(coronavirus disease 2019, COVID-19)在全球范围内迅速蔓延。2020 年 3 月 3 日,国家卫健委发布的《新型冠状病毒肺炎诊疗方案》(试行第八版修订版)[1],增加了抗体血清学检测作为辅助诊断病毒感染的依据之一。全面了解SARS-CoV-2病毒载量及其针对不同抗原的特异性抗体在COVID-19患者疾病进展中的动态变化,探讨病毒载量和抗体水平的相关性,有助于了解抗体在病毒清除和疾病进展中的作用。
本研究回顾性分析19例COVID-19患者从发病当天到发病第50天期间咽拭子SARS-CoV-2的病毒载量及血清针对SARS-CoV-2不同抗原的IgM、IgG抗体水平。
1 材料与方法
1.1 材料
选取南京市第二医院汤山分院收治的19例COVID-19患者,收集患者不同时间点采集的208份咽拭子及72份血清标本,采集时间为发病后第0~50天。同时收集2019年10月份的健康体检志愿者的血清标本45份。
1.2 仪器与试剂
瑞士Roche公司生产的Cobas LC 480全自动荧光定量PCR分析仪,美国Bio-Rad公司生产的iMark酶标仪。所用试剂为硕世生物科技有限公司生产的新型冠状病毒核酸检测试剂盒(荧光PCR法,批号:20200108)。
1.3 方法
1.3.1 临床资料 回顾性分析COVID-19患者的人口学特征(性别和年龄)、流行病学史、主要临床症状和体征、实验室检查结果等。本研究已经通过医院伦理委员会的批准(2020-023-01)。
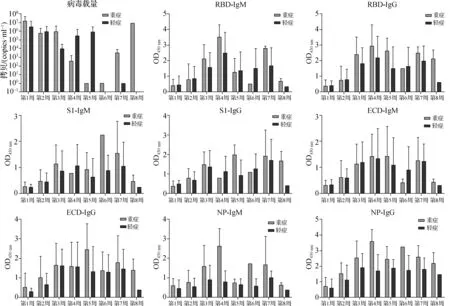
1.3.2 SARS-CoV-2核酸检测 采用实时荧光逆转录聚合酶链反应(RT-PCR)进行核酸检测。扩增基因为 ORF-1ab 基因和 N 基因,对应扩增通道为 FAM 和 VIC,CY5 通道为内标。反应参数:(1) 50 ℃逆转录30 min,1个循环;(2) 95 ℃预变性5 min,1个循环;(3) 95 ℃变性10 s,55 ℃退火、延伸检测40 s,45个循环,收集荧光信号。结果判读:阳性样本参考值为FAM、VIC两个通道同时满足待测样本结果Ct值≤35,曲线呈S型;阴性样本参考值为两个通道结果Ct值>38或未检出;可疑样本有一个通道结果Ct值≤35,其他一个通道35 1.3.3 酶联免疫吸附法(ELISA)检测特异性抗体IgM/IgG 首先,每孔中加100 μl 质量浓度为1 μg·ml-1的体外重组表达并纯化的SARS-CoV-2病毒核衣壳蛋白(nucleocapsid protein,NP蛋白)、S蛋白受体结合域蛋白(receptor binding domain,RBD蛋白)、刺突糖蛋白S1亚基(spike glycoprotein S1 subunit,S1蛋白)、刺突蛋白细胞外结构域(ectodomain of spike glycoprotein,ECD蛋白),4 ℃包被过夜。第2天弃液,加入200 μl·孔-1磷酸盐吐温缓冲液(PBST),浸泡1 min,重复3次。用5%脱脂奶粉(PBST稀释)200 μl·孔-1封闭,37 ℃孵育1 h。随后再次洗板。将患者血清及阴性对照血清(2019年健康体检者血清)用PBST缓冲液1∶200稀释后,每孔加样100 μl,37 ℃孵育1 h。再次洗板。加入1∶10 000稀释的羊抗人IgM-辣根过氧化物酶(HRP)或IgG-HRP,37 ℃孵育1 h。再次洗板。每孔加入100 μl 3,3′,5,5′-四甲基联苯胺(TMB)显色液,室温避光显色5 min。最后,每孔加入100 μl终止液(1 mol·L-1H2SO4),5 min内比色。用酶标仪读取OD450 nm值。以2019年疫情暴发前收集的45份健康人的血清作为阴性对照,以检测的OD450 nm均值加2SD作为cuf-off数值。 应用统计软件SPSS 22.0进行数据分析。计数资料用频数或百分数表示,组间比较采用χ2检验。符合正态分布的计量资料用均数±标准差表示,组间比较采用独立样本t检验和单因素方差分析;非正态分布的计量资料用中位数和四分位数来表示,组间比较采用Mann-WhitneyU法进行非参数检验。相关性分析采用Pearson相关性分析。P<0.05为差异具有统计学意义。 入组COVID-19患者19例(男8例,女11例),平均年龄47岁。依据《新型冠状病毒肺炎诊疗方案》(试行第八版修订版)[2],将COVID-19患者分为COVID-19重症组(7例中男3例,女4例,年龄31~56岁)和COVID-19轻症组(12例中男7例,女5例, 年龄42~63岁)。重症COVID-19患者年龄较轻症COVID-19患者显著大(P=0.006)。咳嗽、发热及肌痛是出现最多的临床症状。14例患者的胸部CT图像出现斑片影或磨玻璃影,4例患者呈间质改变或实变。见表1。 表1 重症与非重症COVID-19患者的流行病学特征 利用4种新冠病毒蛋白(S1、ECD、RBD和NP)作为抗原,采取ELISA法检测COVID-19患者及健康志愿者血清中针对这些蛋白的IgM和IgG水平(图1)。结果显示,健康体检志愿者的血清中针对4种新冠病毒蛋白的IgM和IgG的OD值均显著低于COVID-19患者。以阴性对照组的检测平均数±2SD作为阳性cut-off值),利用4种蛋白作为包被抗原,结果显示72.2%~93.1%的COVID-19血清标本呈阳性(表2)。其中在IgM抗体中,ECD IgM阳性检出率最高(93.1%);而在IgG抗体中,RBD IgG阳性检较高,检出率为83.3%。 图1 利用ELISA法检测血清中针对4种不同新型冠状病毒抗原的IgM和IgG水平 表2 72份标本针对不同抗原检测的IgM/IgG抗体定性结果 重症患者咽拭子标本中的病毒载量普遍较高,大部分患者对应的抗体随病程发展有显著的上升(图2、3)。所有患者病毒载量与抗体之间大致分为4种情况:(1) 重症患者(a、b、c、f)和轻症患者(n、o、q、s)体内高病毒载量与高抗体水平同时存在,发病3周后,病毒载量大幅度降低,甚至消失。这提示尽管患者体内产生了高水平针对新型冠状病毒的抗体,但是却无法有效地降低病毒载量。(2) 重症患者(d、e)和轻症患者(s)体内病毒载量在抗体出现的初期就已经大幅降低或消失;(3) 重症患者(f)和轻症患者(k、l、r)体内的病毒载量一直较高,抗体的出现也较为迟缓,发病第3周后体内才清除病毒;(4)重症患者(g)和轻症患者(m)体内抗体水平上升较为缓慢,而体内的病毒载量在发病1周内就已经下降或消失。总体而言,重症患者和轻症患者的病毒载量及抗体出现的模式并没有显著区别。 图2 动态检测7例重症COVID-19患者(a~g)自发病当天到第50天咽拭子标本中新型冠状病毒的病毒载量以及针对4种新型冠状病毒抗原的抗体(IgM和IgG)水平的变化情况 在整个病程中,重症患者病毒载量比轻症患者的病毒载量高,特别是在第1周和第3周(P值分别为0.035、0.032)。在抗体方面,重症患者和轻症患者血清中刺突蛋白相关的抗原(RBD蛋白、S1蛋白、ECD蛋白)特异性抗体水平相当;另一方面,整个病程中,重症患者的NP蛋白特异性抗体水平也较轻症患者高,特别是在第4周(P=0.001 7)和第6周(P=0.03)。见图4。 图4 重症和轻症新冠肺炎患者病毒载量与血清抗体水平的动态比较 SARS-CoV-2是一种新型β属冠状病毒,为一组高度多样的、包膜的、线性的单股正链RNA,属于已知可感染人类的第7类冠状病毒[3-4]。冠状病毒结构形态上类似皇冠而得名,膜表面有4种糖蛋白,即刺突糖蛋白(spike glycoprotein,S蛋白)、包膜蛋白(envelope protein,E蛋白)、膜糖蛋白(membrane protein,M蛋白)和NP蛋白[5]。RBD蛋白和NP蛋白是SARS-CoV-2抗体检测的主要抗原位点[6]。目前商业化的试剂盒多采用单一的抗原(NP蛋白或RBD蛋白),针对多种SARS-CoV-2抗原的特异性抗体的动态监测联合病毒载量的变化尚未见报道。 图3 轻症COVID-19患者从当天到第50天咽拭子标本中新型冠状病毒载量与针对4种新型冠状病毒抗原的抗体水平(IgM和IgG)的变化情况 本研究所选取的主要抗原位点也是S蛋白相关的3种抗原(S1、RBD和ECD)和NP蛋白。S蛋白是一种糖蛋白,由1 160~1 400个氨基酸残基组成,并含有多个N-糖基化位点,是介导冠状病毒识别、侵染宿主细胞的重要元件[7]。S蛋白通常在病毒组装过程中被剪切为球状的S1亚基和棒状的S2亚基。S1亚基暴露于包膜表面,是识别、结合宿主细胞表面受体的重要部位;S2 亚基嵌于包膜内,是介导病毒包膜与宿主细胞膜融合、实现病毒入侵的关键结构[7]。其中S1亚基头部尖端含有RBD,可以与人类受体—血管紧张素转化酶2(ACE2)结合[8]。对72份COVID-19患者的血清标本进行分析发现,S1蛋白的抗体相比于针对RBD蛋白的抗体,具有较高的检出率;由于ECD抗原包括S1亚基和S2亚基,针对ECD抗原的抗体的检出率略高于RBD蛋白和S1蛋白。因此,考虑利用ECD抗原作为抗体检测试剂盒的包被抗原,可能提高早期COVID-19患者抗体检出的敏感度。 作为病毒颗粒的核心成分,NP蛋白在冠状病毒中含量丰富,不仅参与了病毒基因组的形成,也与冠状病毒复制周期以及宿主细胞对病毒感染的反应有关[9]。NP蛋白位于病毒的内部,针对NP蛋白的抗体检出率也略低于针对其他3个蛋白的抗体检出率,但针对4种不同抗原的抗体检出率之间差异无统计学意义(P>0.05)。 针对4种不同抗原的特异性抗体,重症患者中IgM出现最早的是抗RBD-IgM和抗NP-IgM[10],IgG出现最早的是抗NP-IgG;轻症患者中,IgM出现最早的是抗RBD-IgM和抗ECD-IgM,IgG都出现在病程的第3周。针对S蛋白的抗体可能是具有保护性功能的中和抗体[11],而针对NP蛋白的抗体并没有中和病毒的能力。因此,虽然重症患者血清中针对SARS-CoV-2的特异性抗体较高,但基本是针对NP蛋白的特异性抗体,可能在COVID-19疾病进展中起到一定作用。 对COVID-19患者整个病程期间的病毒载量和抗体动态变化模式进行分析发现,不同患者的病毒载量和抗体水平差异较大:有的患者血清中特异性抗体水平不断升高,病毒载量水平也同时呈现明显下降趋势甚至检测不出,可见特异性抗体表现出明显的保护作用;而有的患者体内抗体水平上升较为缓慢,体内的病毒载量在发病早期(第1周)就已经下降或消失,此类患者是否存在再次感染的风险,有待加大样本量后的持续研究。 在发病第1周和第3周,重症患者的SARS-CoV-2载量显著高于轻症患者,提示病毒载量可能是COVID-19重症化的重要因素之一。通过重症患者与轻症患者的新冠抗体比较发现,总体上重症患者血清中NP IgG和S1 IgG抗体水平高于轻症患者,而轻症和重症患者血清中其他检测的抗体水平相当,这可能由于重症患者体内的病毒载量过高,导致新冠特异性抗体水平较高。此外,本研究还发现,个别康复期轻症患者IgM和IgG抗体水平较低,此类患者是否存在再次感染的风险,有待后续的长期观察。 本研究有一定的局限性,入组患者的数量仅有19例,且本地未出现新冠死亡病例,故入组患者缺乏死亡病例。但针对4种不同抗原检测其抗体,并结合患者体内病毒载量的动态水平进行分析,这些数据可为SARS-CoV-2的抗体检测、基于抗体的COVID-19患者治疗策略以及疫苗的研发提供参考。1.4 统计学处理
2 结果与分析
2.1 COVID- 19患者的临床资料

2.2 ELISA法检测IgM/IgG抗体


2.3 动态检测重症和轻症COVID- 19患者咽拭子病毒载量以及针对4种抗原的IgM、IgG抗体水平的变化情况
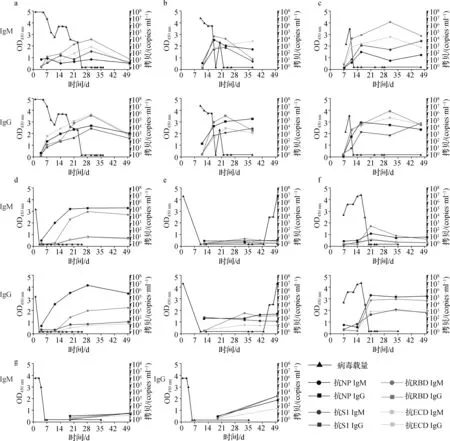
2.4 重症及轻症COVID- 19患者病毒载量与血清抗体水平的动态比较
3 讨 论

