miR-223靶向RhoB抑制Aβ1-42诱导的海马神经元凋亡
2021-11-06张峪涵付晖刘翠娟廖成钜罗昊栋
张峪涵,付晖,刘翠娟,廖成钜,罗昊栋
(1.东莞市松山湖中心医院 神经内科,广东 东莞 523326; 2. 广东医科大学 药学院,广东 东莞 524023)
阿尔茨海默病(Alzheimer’s disease,AD)是一种与衰老有关的神经退行性疾病[1]。其主要病理特征是相关脑区中神经纤维缠结和由β-淀粉样蛋白(β-amyloid,Aβ)组成的老年斑沉积[2]。Aβ寡聚体沉积具有神经毒性,可促发神经元凋亡,是引发AD的重要机制之一[3]。微小RNA(miRNAs)是一类长21~23个核苷酸的内源性非编码小分子RNA,广泛存在于人类大脑组织中,与神经元凋亡、增殖、分化等有关[4]。miR-223是miRNA的一种,因在很多恶性肿瘤或炎症组织中呈低表达而受到普遍关注[5]。2020年,Serpente等[6]通过研究AD进展过程中miRNAs网络的变化发现,与健康人群相比,miR-223在AD患者脑脊液和血液样本中表达量显著下调。但是,miR-223的特异性作用机制,如AD的相关靶点和通路尚未完全清楚。本研究以寡聚态Aβ1-42诱导的海马神经元为研究模型,通过调控miR-223和RhoB的表达来观察其对神经元细胞凋亡的影响,为AD的预防或治疗提供新的作用靶点。
1 材料与方法
1.1 实验动物
SPF级新生1 d的SD雄性大鼠12只,购自山西省肿瘤研究所。实验动物许可证号:SCXK(晋)2017-0001。
1.2 主要仪器及试剂
CO2细胞培养箱购自美国Forma Scientific公司,倒置显微镜购自日本Olympus公司,流式细胞仪购自美国 Beckman Coulter公司,0.25%胰酶/EDTA、Aβ1-42、多聚右旋赖氨酸购自Sigma公司,PCR引物由上海生工生物工程技术有限公司合成,Bcl-2单克隆抗体、Bax单克隆抗体、caspase-3单克隆抗体、RhoB单克隆抗体、β-actin单克隆抗体和二抗均购自赛信通(上海)生物试剂有限公司, miR-223 mimics、mimics control、si-RhoB和si-con均购自百奥迈科生物技术有限公司,转染试剂Lipofectamine2000购自上海阳光生物科技有限公司。
1.3 方法
1.3.1 海马神经元细胞分离和培养 用体积分数75%乙醇消毒SD大鼠,腹腔注射10%水合氯醛(5 ml·kg-1)麻醉后,断头取全脑,在无菌条件下分离海马组织。本研究得到了医院伦理委员会的批准。将海马组织置于预冷磷酸盐缓冲液中,去除血管和筋膜后切成1 mm3小块。用含15% 胎牛血清的DMEM/F12悬浮海马神经元。以1 000 r·min-1离心5 min后,将海马神经元重新分散于DMEM/F12(15%FBS)中,密度为3× 105ml-1。将海马神经元接种至多聚赖氨酸预先包被的6孔细胞培养板中,置于37 ℃、体积分数5%CO2培养箱中孵育24、72 h。后更换为含有阿糖胞苷(质量浓度为2.5 mg·L-1)的新鲜培养基代替(阿糖胞苷能抑制成纤维细胞和胶质细胞的生长)。连续培养海马神经元7 d,倒置显微镜下观察其形态学变化。
1.3.2 海马神经元细胞免疫荧光染色 将海马神经元接种于6孔板中,孵育7 d后用4%多聚甲醛固定20 min。10%山羊血清白蛋白阻断非特异性结合位点30 min,4 ℃条件下用小鼠抗大鼠微管相关蛋白(microtubule-associated protein-2,MAP-2)单克隆抗体孵育12 h,加入异硫氰酸荧光素(FITC)标记的山羊抗鼠IgG二级抗体室温培养2 h。用Hoechst 33258(50 g·ml-1)逆染1 h。清洗3次,干燥过量液体后倒置荧光显微镜观察海马神经元。在同一视野内,用不同的激发光分别获得神经元和神经元核的荧光图像。使用Image Pro 6.0软件测量每个视野海马神经元的最长神经突长度。
1.3.3 细胞转染 将生长状态良好的神经元细胞随机分为空白组(不作任何转染处理)、阴性组(转染miR-NC)、miR-223-m组(转染miR-223 mimics)、miR-223-m+LV组(转染miR-223 mimics+慢病毒骨架)、miR-223-m+LV-RhoB组(转染miR-223 mimics+RhoB过表达载体)。参照脂质体 LipofectamineTM2000 说明书操作步骤转染细胞。转染后继续培养24 h,用于后续试验。
1.3.4 寡聚态Aβ1-42的制备及应用 参考文献[4]制备寡聚态Aβ1-42:取1 mg冻干粉Aβ1-42经有机溶剂HFIP室温孵育1 h处理后真空风干,用少量DMSO助溶后溶解于无血清的DMEM-F12低糖培养基中,配成100 μmol·L-1浓度的母液,4 ℃孵育24 h后,每组转染后的细胞加入Aβ1-42寡聚肽片段30.0 μmol·L-1孵育48 h。
1.3.5 MTT法检测细胞存活率 将密度为1×103ml-1海马神经元接种于96孔板上,每孔接种100 μl(含2.5 mg·L-1阿糖胞苷)。培养24 h后,用不同浓度的Aβ1-42(0、10、20、30、40、50 μmol·L-1)诱导海马神经元。以0 μmol·L-1Aβ1-42为阴性对照。培养48 h后加入20 μl·孔-1MTT溶液(5 mg·ml-1),37 ℃培养4 h,加入150 μl二甲基亚砜,振动10 min,促进紫晶完全溶解。在微板阅读器上检测每个孔490 nm的吸光度(OD490 nm)值,计算每组海马神经元的存活率。
1.3.6 流式细胞术检测细胞凋亡情况 每组转染后的细胞加入Aβ1-42寡聚肽片段30.0 μmol·L-1孵育48 h。将各组细胞用0.25%的胰蛋白酶消化后,离心收集,加入200 μl缓冲液制备细胞悬液。分别加入5 μl 的Annexin V-/FITC和PI混合均匀,室温避光孵育15 min后,再次加入200 μl缓冲液,置于流式细胞仪观察细胞凋亡情况。
1.3.7 双荧光素酶报告基因检测 构建 WT-RhoB(含RhoB 3′UTR片段)和MUT-RhoB(含RhoB 3′UTR片段突变体)的荧光素酶报告载体,采用LipofectamineTM2000分别将WT-RhoB及MUT-RhoB与miR-223 mimics、miR-223 inhibitor或miR-NC共转染。转染后培养24 h,按双荧光素酶报告基因检测试剂盒技术说明书操作,记录萤火虫荧光素酶和海肾荧光素酶激发值,以两者的比值评价RhoB基因的激活程度。
1.3.8 qRT-PCR实验 用TRIzol液裂解细胞后,提取总的RNA。取1 μg RNA按反转录试剂盒说明书用于合成cDNA。取1.0 μg cDNA用Fast Start Universal SYBR Green Master mix试剂盒进行PCR扩增,预变性95 ℃ 10 min,随后40个循环(变性95 ℃ 10 s,退火60 ℃ 20 s,延伸72 ℃ 34 s)。miR-223引物:正向5′-TCCGAAGTGTACCTCAAC-3′,反向5′-GTGCAGGGTCCGAGGT-3′。U6 mRNA引物:正向5′-CTCGCTTCGGCAGCACATATACT-3′,反向5′-ACGCTTCACGAATTTGCGTGTC-3′。RhoB mRNA引物:正向5′-AGTAAGGACGAGTTCCCCGA-3′,反向5′-GGTGAAGGGCGAACATCTGA-3′。GAPDH引物:正向5′-GGTGCTGAGTATGTCGTGGAGT-3′,反向5′-CAGTCTTCTGAGTGGCAGTGATG-3′。miR-223表达归一化为U6, RhoB mRNA表达归一化为GAPDH。采用2-ΔΔCt法对数据进行处理。
1.3.9 Western blotting实验 将细胞加入适量RIPA裂解液裂解后,提取总蛋白,并用BCA法测定神经元中的蛋白量。提取的蛋白与loading buffer充分混合后,置于100 ℃煮沸5 min,变性后进行蛋白质电泳。电泳后用转膜仪将蛋白转移至PVDF膜上,脱脂奶粉封闭2 h后,加入Ⅰ抗[caspase-3(1∶500)、Bcl-2(1∶1 000)、Bax(1∶1 000)、RhoB(1∶500)、GAPDH(1∶1 000)]4 ℃ 孵育过夜。次日,Ⅱ抗37 ℃孵育2 h后显影。
1.4 统计学处理
应用SPSS 21.0软件包进行数据分析处理,所有数据均以平均值±标准差表示。两组间比较采用双尾t检验;多组间比较采用方差分析或单因素重复测量的方差分析,然后采用SNK-q法进行两两比较。P<0.05为差异有统计学意义。所有实验至少重复3次。
2 结 果
2.1 海马神经元分离培养和鉴定
培养4~6 h,大部分海马神经元粘连形成突触。相邻神经细胞突触间的神经网络在3~7 d形成。海马神经元分布均匀,胞体完全伸展,呈锥体状,有长轴突和1~2个树突。用神经元特异性标志物(MAP-2)进行荧光标记后,显示海马神经元纯度达(94.2±3.6)%,可满足进一步实验的要求(图1)。

A. 接种后3 d、4~6 h、7 d时海马神经元形态学观察; B. 免疫荧光双染法观察大鼠海马神经元特征
2.2 Aβ1-42对海马神经元存活率的影响
经MTT法检测,不同浓度的Aβ1-42(0、10、20、30、40、50 μmol·L-1)诱导海马神经元48 h时,随着作用浓度的升高,细胞存活率逐渐降低。当浓度超过30 μmol·L-1时,海马神经元的活力明显受到抑制,存活率<80%(F=118.530,P<0.05)(图2A)。
2.3 Aβ1-42对海马神经元miR- 223和RhoB表达的影响
经qRT-PCR和Western blotting法检测,不同浓度的Aβ1-42(0、10、20、30、40、50 μmol·L-1)诱导海马神经元48 h时,随着作用浓度的升高,细胞miR-223相对表达量逐渐降低,同时RhoB蛋白表达逐渐升高(F值分别为39.849、77.243,均P<0.05,图2B和图2C)。但是当Aβ1-42≥30 μmol·L-1时,细胞miR-223表达变化不是很明显,差异无统计学意义(F=1.983,P>0.05),因此选择Aβ1-4230μmol·L-1用于后续实验。
2.4 过表达miR- 223对Aβ1-42诱导海马神经元细胞凋亡的影响
经qRT-PCR法检测,miR-223-m组细胞miR-223相对表达量较空白组和阴性组升高(F=68.215,P<0.05);而与miR-223-m组及miR-223-m+LV组相比,miR-223-m+LV-RhoB组RhoB mRNA相对表达量也升高(F=129.650,P<0.05),说明转染成功,可用于后续实验。经流式细胞术法检测,经Aβ1-42寡聚肽片段30.0 μmol·L-1孵育48 h后,与空白组及阴性组相比,miR-223-m组细胞凋亡率降低;而与miR-223-m组及miR-223-m+LV组相比,miR-223-m+LV-RhoB组细胞凋亡率升高(F=11.915,P<0.05)(图3)。
2.5 过表达miR- 223对海马神经元RhoB蛋白和凋亡相关蛋白表达的影响
Western blotting法检测,空白组、阴性组、miR-223-m组、miR-223-m+LV组和miR-223-m+LV-RhoB组RhoB、Bcl-2、Bax、caspase-3蛋白表达量比较,差异均有统计学意义(F值分别为27.815、18.790、21.331、7.843,P<0.05);与空白组及阴性组相比,miR-223-m组细胞RhoB、Bax和caspase-3蛋白表达降低,同时Bcl-2蛋白表达升高(P<0.05),而与miR-223-m组及miR-223-m+LV组相比,miR-223-m+LV-RhoB组细胞RhoB、Bax和caspase-3蛋白表达升高,同时Bcl-2蛋白表达降低(P<0.05)。见图4。
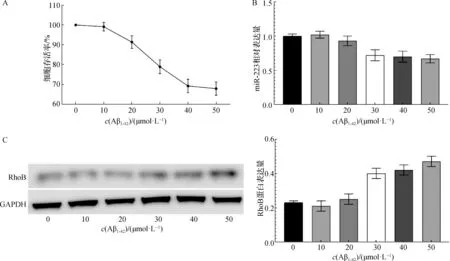
A. MTT法检测细胞存活情况;B. qRT-PCR法检测细胞miR-223相对表达量;C. Western blotting法检测细胞RhoB蛋白表达情况
2.6 miR- 223与RhoB的靶向关系
通过miRcode预测到RhoB 3′UTR存在2个与miR-223相结合的位点。双荧光素酶活性检测结果显示,与miR-NC组相比,miR-223 mimics分别和含有两个假定的miR-223结合序列的荧光素酶构建的RhoB 3′-UTR共转染后,荧光活性显著降低(F=165.73,P<0.05),同样,miR-223 inhibitor与RhoB 3′-UTR共转染后,荧光活性显著升高(F=89.435,P<0.05),表明它们之间存在直接相互作用。见图5。
3 讨 论
随着近年来对AD发病机制的深入研究,Aβ寡聚体触发的神经元细胞凋亡引起了大量学者的关注[7]。据报道,Aβ1-42主要用于建立AD细胞模型。本研究原代海马神经元被成功地分离和培养,而经Aβ1-42处理后可抑制海马神经元活动,并以剂量依赖性方式促进其凋亡。综合考虑细胞存活率、miR-223表达量的差异,选用30 μmol·L-1的Aβ1-42以成功地诱导AD细胞模型。miR-223在Aβ1-42转导的海马神经元中表达下调,同时RhoB表达上调。进一步的深入研究表明,miR-223通过靶向抑制RhoB蛋白的表达,阻止了海马神经元的凋亡。
RhoB作为GTPase信号分子家族中的一个较为独特的分子,通过与下游靶蛋白相互作用,进而诱导多种细胞反应,包括调节肌动蛋白骨架和基因转录等[8]。RhoB与RhoA及RhoC一起,共同构成Rho亚家族。Rho亚家族各成员是细胞分裂、细胞迁移、伤口愈合或免疫监视等多种细胞和生理过程中的关键介质,其功能失调与不同的人类疾病有关[9]。这3个蛋白质有高度的相似性(87%以上的氨基酸序列具有同源性)。但是与RhoA及RhoC相反,RhoB是由一个外显子编码的蛋白分子,它被认为是在脊椎动物进化过程中从RhoA反向拷贝整合而来[10]。目前关于RhoB研究最广泛的是在肿瘤领域。杨鹏春等[11]通过细胞实验证实,miR-223可能靶向作用于RhoB,进而影响结直肠癌的发展及转移。在许多类型的细胞中,RhoB基因表达是由损坏的DNA刺激引起的,说明RhoB可能参与了DNA 损伤信号机制的某些下游水平,进而成为细胞死亡效应器或死亡信号修饰器。他汀类药物与降低AD的发生风险有关,其可能机制在于抑制类异戊二烯途径,调节小GTP酶RhoA、B和C分子的活性[12]。因此,小分子RhoB可能是中枢神经系统病理反应最重要的介导因子之一。在中毒或创伤性刺激下,RhoB在神经元中的表达量会迅速上调,RhoB有望成为神经退行性疾病严重性的重要预测分子[13],但是目前关于RhoB在AD进展中的作用尚不明确。

a 与空白组相比,P<0.05; b 与阴性组相比,P<0.05; c 与miR-223-m组及miR-223-m+LV组相比,P<0.05

a 与空白组相比,P<0.05; b 与阴性组相比,P<0.05; c 与miR-223-m组相比,P<0.05

图5 miR-223和RhoB存在靶向结合关系
通过miRcode预测到RhoB 3′UTR存在2个与miR-223相结合的位点;双荧光素酶报告基因分析也进一步证实了miR-223对于RhoB表达具有一定的靶向调控作用。miR-223参与多种细胞病理过程的调节,如癌症、自身免疫性疾病和炎症性疾病。既往miR-223被认为是NLRP3炎症小体的阴性调节因子。慢性炎症体激活为神经退行性疾病的一个基本特征,是由包括淀粉样β蛋白和α-突触核蛋白在内的错误折叠的蛋白质聚集体引起的,导致促炎症细胞因子的分泌和神经炎症的传播[14]。Mancuso等[15]也通过人体血液样本证实,与健康人群相比,miR-223在AD患者、帕金森患者、轻度认知功能障碍者人群血清中表达量降低。miR-223有望成为鉴别诊断神经退行性疾病的潜在非侵入性生物标志物。在本研究miR-223对Aβ1-42诱导的海马神经元生物学行为的影响结果提示,miR-223通过抑制RhoB的表达,进而增加海马神经元活性,并抑制其凋亡,说明miR-223/RhoB轴在损伤神经元修复和再生中具有重要作用,但本研究的不足之处是还未探讨RhoB是如何调控Bax、Bcl-2和caspase-3蛋白的表达量,进而诱导细胞凋亡的。
综上所述,本研究结果表明,Aβ1-42诱导的海马神经元中miR-223表达下调,同时RhoB表达下调。miR-223通过靶向抑制RhoB表达阻止AD海马神经元的凋亡。
