三重real-time PCR同步检测黄牛、 水牛和牦牛成分
2021-11-05张明哲沈旭芳虞惠贞尹文秀张晓峰
吴 姗,张明哲,方 云,陈 哲,张 荃,孙 超,沈旭芳,虞惠贞,尹文秀,张晓峰
(浙江省检验检疫科学技术研究院,浙江 杭州 310016)
在经济利益驱动下的肉制品制假贩假事件屡禁不绝,已成为中国食品质量控制面临的重要挑战之一。牛肉一直是制假掺假的重灾区,除了用价格相对低廉的猪肉、鸡肉、鸭肉冒充牛肉外,更有甚者将狐狸、水貂等肉掺入牛肉中进行销售。此外,由于牛肉本身可分为黄牛肉、水牛肉和牦牛肉,且这3 类肉之间也存在较大的价格差异,一般来说牦牛肉价格高于黄牛肉,黄牛肉又高于水牛肉,因此往往会出现水牛肉、黄牛肉被用来冒充牦牛肉,而水牛肉还被用来冒充黄牛肉。
近年来,国家针对肉制品掺假问题加强检测监管力度,大力支持肉品检测方法的研究。目前对肉类真伪鉴别的检测技术主要包括基于蛋白的免疫技术[1-2],基于代谢物质的光谱技术[3-4]、电子鼻[5-6]、电子舌[7]技术,以及基于核酸的分子生物学技术等。由于DNA的生物学稳定性,不论是在生肉或是熟肉,或是在成分多样复杂的复合食品中,即便是在腐败变质的肉制品中,其物种特异性的DNA都能稳定存在,因此分子生物学的鉴定方法,仍是目前比较常用和可靠的鉴定方法。
早在1998年,为了防止疯牛病通过饲料传播,Tartaglia等[8]利用聚合酶链式反应(polymerase chain reaction,PCR)在饲料中进行牛源性成分的检测。此后,在PCR基础上又衍生了PCR-限制性片段长度多 态性[9-10]和PCR-单链构象多态性分析[11]等技术。实时聚合酶链式反应(real-time polymerase chain reaction,real-time PCR)的产生,免去了PCR技术后续凝胶电泳的步骤,同时能对整个PCR过程进行实时监测,因此该方法目前已成为一种较普及的用于肉制品真伪鉴别的方法[12-16]。目前用来鉴别牛肉真伪的real-time PCR方法已经较多,且建立一系列检测标准,如SN/T 2051—2008《食品、化妆品和饲料中牛羊猪源性成分检测方法 实时PCR法》[17],GB/T 25165—2010《明胶中牛、羊、猪源性成分的定性检测方法 实时荧光PCR法》[18]、SN/T 2557—2010《畜肉食品中牛成分定性检测方法 实时荧光PCR法》[19]、 SB/T 10923—2012《肉及肉制品中动物源性成分的测定 实时荧光PCR法》[20]等,但上述标准并不能区分牛的种类。虽然目前也有有关黄牛[21](参考冀德君等[22]和亐开心[23]等观点,黄牛包括普通牛(Bos taurus)和瘤牛(Bos indicus))、水牛(Bubalus bubalis)[21,24]和牦牛(Bos grunniens)[21,25]的检测方法,但上述方法存在灵敏度不高,或者覆盖度不高,即存在不能检测到种内某些品种的情况。
本研究研发具有黄牛、水牛和牦牛特异性的3 组引物探针,以实现用三重real-time PCR方法快速同步地对上述3 种牛肉制品进行真伪鉴别。以期为市场监管部门在实施相应监管措施时,提供详实可靠、可供参考的检测数据。
1 材料与方法
1.1 材料与试剂
黄牛、水牛和牦牛以及其他动植物样本购于市场或者本实验室保存,其中貉和银狐的样品采集自杭州动物园。动物样品取肌肉或骨骼、内脏和血液部分;植物样品取可食用部分。用于方法建立的黄牛、水牛和牦牛的样本真实性通过real-time PCR检测及测序确认[26-27];其余肉类样本,包括绵羊、猪、马、驴、狗、鸡、鸭、鹅等的真实性通过相关检测标准(略)鉴定,其余样本通过外观确认。
实际的深加工样品中,如肉丸、肉松等,往往存在多种肉掺杂的情况。为了模拟检测混合样品,将黄牛、水牛和牦牛3 种肉干按照表1的质量比制成混合肉样,每个混合样总质量10 g,共制成9 个样(表1, 样品A~I)。混合样品经过振荡研磨仪混合研磨 (5 500 r/min,20 s,重复4~6 次)成肉泥,取充分混合的样品进行DNA提取。
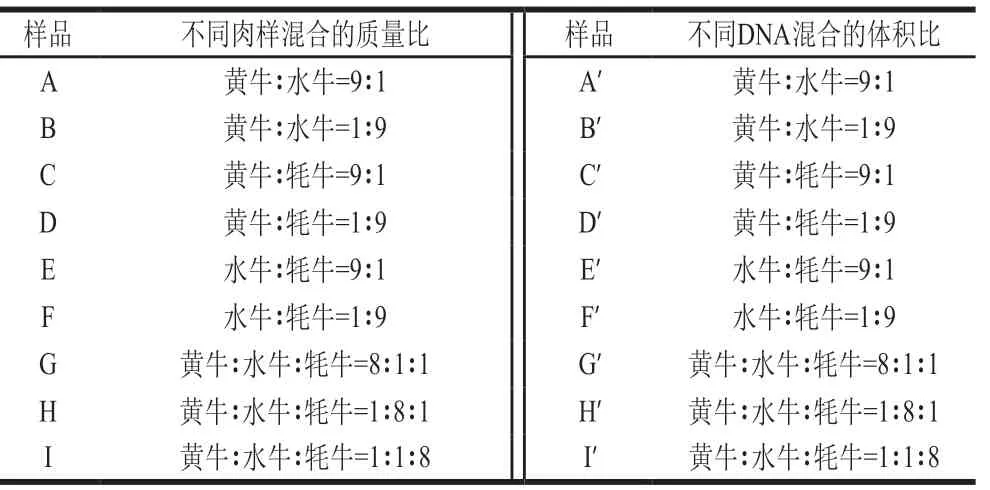
表1 黄牛、水牛和牦牛混合肉样和混合DNA样品的制备Table 1 Preparation of mixed meat samples and mixed DNA samples from yellow cattle, buffalo and yak
Premix ExTaq大连TaKaRa公司;FF3750食品抽提试剂盒 美国Promega公司。
1.2 仪器与设备
Precellys Evolution振荡研磨仪 法国Bertin Technologies公司;NanoDrop ND-1000紫外-可见光分光光度计 美国Thermo Scientific公司;Lightcycle 480荧光定量PCR仪 德国Roche公司。
1.3 方法
1.3.1 DNA抽提
取动物肌肉、骨骼、内脏、血液或者植物可食用部分100 mg或100 μL,使用FF3750食品抽提试剂盒进行DNA提取,最后抽提得到DNA溶解在20~100 μL水中,使抽提得到的DNA质量浓度大于等于10 ng/μL。在单重、双重和三重real-time PCR体系灵敏度验证实验中,将黄牛、水牛和牦牛抽提得到的DNA质量浓度均调整为25 ng/μL,然后再进行4 倍梯度稀释。同时,还制备了3 种牛的DNA混合样,取质量浓度约为10 ng/μL,纯度A260nm/A280nm为1.7~1.9,3 种牛的DNA样品,按照表1体积比制成DNA混合样,每个混合样总体积为200 μL,共制成9 个样(表1,样品A′~I′)。DNA质量浓度和纯度用NanoDrop ND-1000紫外-可见光分光光度计在260 nm和280 nm波长处进行测定。
1.3.2 引物和探针的设计
基于黄牛、牦牛线粒体12S rRNA基因(序列号分别为KF926377.1和KJ463418.1)和水牛的线粒体Cyt b基因(序列号AY488491.1),根据引物设计原则,利用Primer Express软件设计了黄牛、水牛和牦牛特异性的引物探针3 组(表2)。
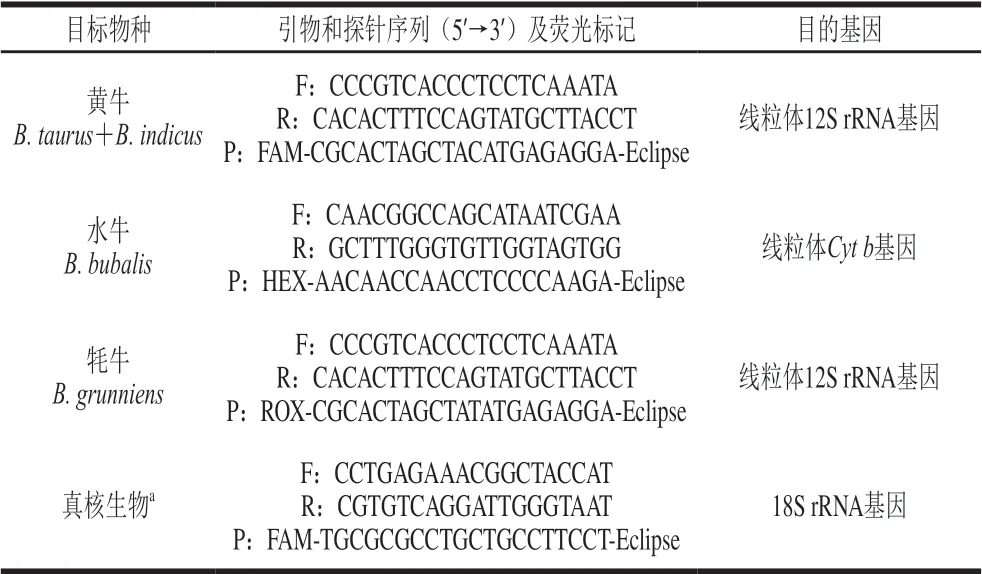
表2 检测黄牛、牦牛和水牛的引物和探针序列Table 2 Primers and probes used for the detection of yellow cattle-, buffalo- and yak-derived components
1.3.3 real-time PCR扩增检测
用于内参照引物探针的real-time PCR体系及反应条件见标准GB/T 25165—2010[18]。
用于3 种牛检测的单重real-time PCR反应体系如下:10 μL Premix ExTaq,上游引物(10 pmol/μL)0.4 μL,下游引物(10 pmol/μL)0.4 μL,探针(10 pmol/μL)0.4 μL,取上述DNA液1 μL,用水补足体积至20 μL。应用荧光定量PCR仪进行反应,反应程序为:95 ℃预变性10 s;95 ℃变性5 s,60 ℃退火延伸23 s,40 个循环。
三重real-time PCR对黄牛、水牛和牦牛同步检测时,黄牛、水牛和牦牛探针的5′端分别用FAM、HEX和ROX标记,3′端则用Eclipse标记。三重real-time PCR体系如下:10 μL Premix ExTaq,各引物(10 pmol/μL)均0.13 μL,各探针(10 pmol/μL)均0.27 μL,取对应的DNA模板各1 μL,用水补足体积至20 μL。应用荧光定量PCR仪进行反应,反应程序为95 ℃预变性10 s;95 ℃变性5 s,60 ℃退火延伸23 s,40 个循环。
FAM、ROX、HEX三重荧光补偿。荧光补偿反应程序参照Roche说明书:1)95 ℃预变性10 s;2)95 ℃变性5 s;60 ℃退火延伸23 s;40 个循环;3)95 ℃变性10 s;40 ℃退火30 s;95 ℃变性;40 ℃,1 s。补偿反应时进行单重real-time PCR,体系如下:10 μL Premix ExTaq,上游、下游引物(10 pmol/μL)各0.4 μL,探针 (10 pmol/μL)0.8 μL,取DNA 1 μL,用水补足体积至20 μL。在三重real-time PCR结束后调用该荧光补偿程序,进行荧光补偿,对补偿后的数据进行判断,确保无荧光干扰而产生的假阳性。
real-time PCR检测中,Ct值表示每个反应管内荧光信号到达设定的域值时所经历的循环数,每个实验重复 3 次,Ct值为3 次结果的平均值,并计算标准差。
1.3.4 标准曲线绘制
为确定单重real-time PCR检测体系的检出限和线性范围,对目标DNA进行梯度稀释,并利用DNA浓度和Ct值之间的相关性绘制标准曲线。将抽提得到的DNA进行4 倍梯度稀释,进行real-time PCR检测。变量相关性 公式[28]:Ct =blgCDNA+a(b为斜率,a为截距)。
2 结果与分析
2.1 引物探针的特异性
将设计得到的用于检测3 种牛的引物探针用于检测包括黄牛、水牛和牦牛在内的19 种家畜、家禽及其他动植物。结果显示上述引物探针只对目标物种呈阳性反应,其他非目标物种均未检测到Ct值(表3);而同时用检测真核生物的引物探针检测时,反应都呈阳性,说明抽提得到的DNA质量符合real-time PCR检测要求。在单重real-time PCR检测体系中,以单一的目标DNA为检测样本,设计得到的引物探针序列有较好的特异性。
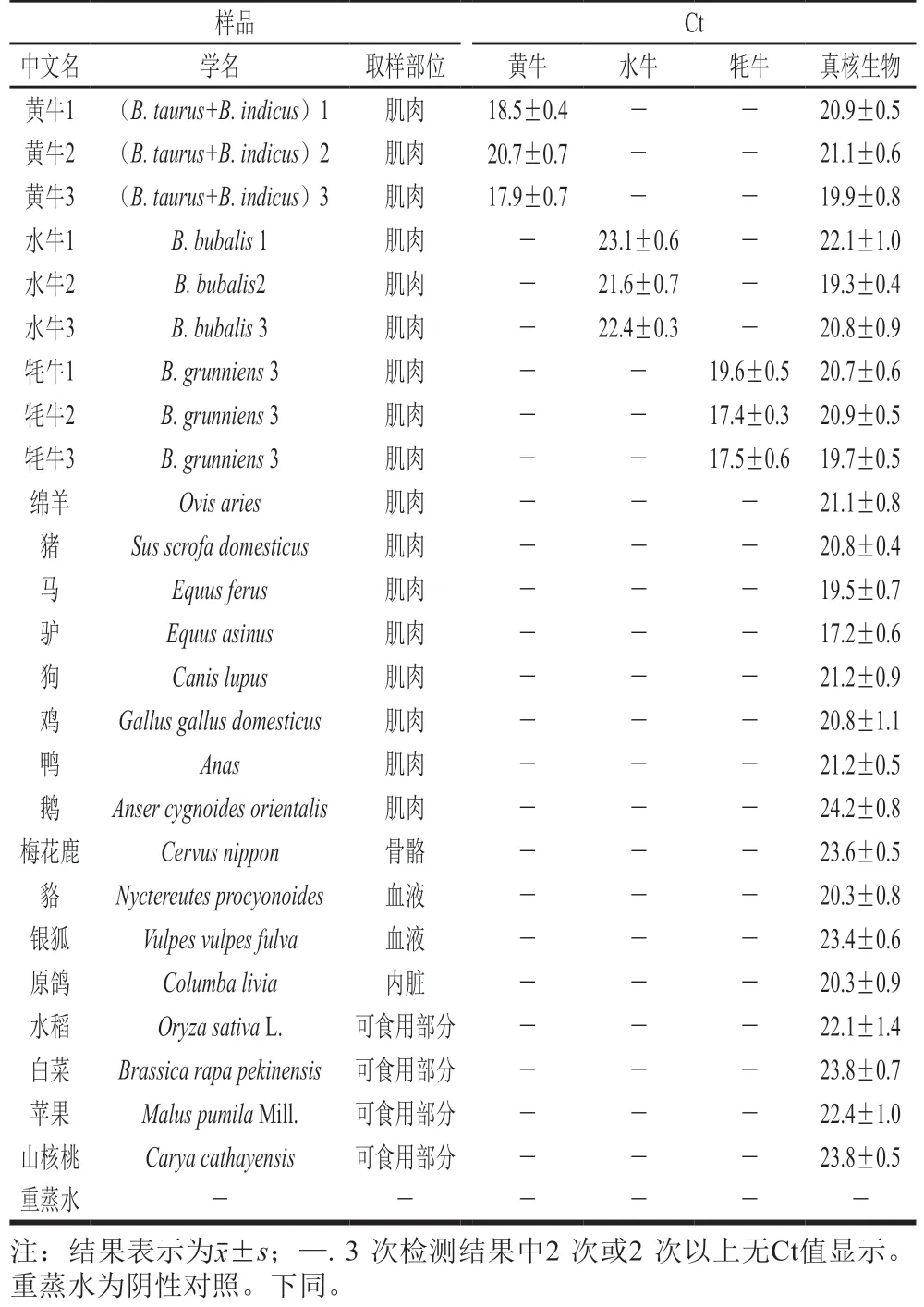
表3 黄牛、水牛和牦牛引物探针的特异性Table 3 Specificity of the primers and probes for the detection of yellow cattle-, buffalo- and yak-derived components
2.2 单重real-time PCR的检测灵敏度
将3 种牛DNA质量浓度都调节到25 ng/μL左右,再进行4 倍稀释,共形成8 个质量浓度梯度。各个DNA质量浓度单重real-time PCR的结果如表4所示,当3 种DNA质量浓度稀释到0.025 ng/μL时,3 种牛的检测都能得到Ct值小于35且阳性明显的S型扩增曲线,此时得到3 组标准曲线的R2值均大于0.99(黄牛:y=-4.270 3x+26.524,R2=0.992 3;水牛:y=-4.281 1x+27.028,R2=0.995 8;牦牛:y=-4.376 4x+24.514,R2=0.997 7);但进一步稀释后(质量浓度至0.006 ng/μL),黄牛和牦牛得到的Ct值分别为38.4和38.8,而水牛则无Ct值显示,此时黄牛和牦牛的标准曲线的R2值分别降至0.982 6 (y=-4.683 7x+26.691)和0.959 7(y=-5.166 2x+24.833);DNA质量浓度降至0.002 ng/μL左右时,则3 种牛的检测结果都呈阴性。R2值大于0.99时,说明该标准曲线所取范围内的DNA质量浓度与Ct值有较好的对应关系,Ct值能比较准确地反映对应DNA的浓度;R2值下降,说明两者间的对应关系下降,Ct值反应对应DNA质量浓度的可信度下降。

表4 单重real-time PCR检测黄牛、水牛和牦牛的灵敏度Table 4 Sensitivity of simplex real-time PCR for the detection of yellow cattle-, buffalo- and yak-derived components
因此,为方便统计,在后续3 种牛的双重及三重real-time PCR检测中,以35为Ct值的临界值,3 次检测结果中2 次或2 次以上Ct值小于35,结果为阳性(+);2 次或2 次以上Ct值大于等于35或无Ct值显示,结果为 阴性(-)。
2.3 双重和三重real-time PCR的检测灵敏度
在双重real-time PCR的检测中,将任意2 种引物探针组合按照1∶1比例混合,得到结果显示:只有黄牛的检测因为试剂间及2 种DNA间的叠加而导致其灵敏度降低至0.1 ng/μL, 而水牛和牦牛的检测灵敏度仍保持在与单重real-time PCR的水平(0.025 ng/μL)一样,并未下降(表5)。

表5 双重和三重real-time PCR同步检测黄牛、水牛及牦牛Table 5 Simultaneous detection of yellow cattle-, buffalo- and yakderived components by duplex and triplex real-time PCR
但双重变成三重real-time PCR后,结果则大不相同,即便是在最高的起始质量浓度下(25 ng/μL),黄牛和水牛的检测都未得到阳性结果,但牦牛的检测灵敏度仍然保持在0.025 ng/μL,未受到三重的影响。为了提高三重real-time PCR检测中黄牛和水牛的检测灵敏度,调整3 种引物探针组合的浓度比例。比较8 种混合比例,提高黄牛和水牛的引物探针比例有助于提高检测灵敏度,表6显示,当黄牛、水牛、牦牛3 组引物探针的比例调节为3∶3∶2时,黄牛和水牛的检测灵敏度可达到0.1 ng/μL,而牦牛的灵敏度仍可达到0.025 ng/μL,因此认为该比例较佳。

表6 黄牛、水牛和牦牛三重real-time PCR检测体系优化Table 6 Optimization of triplex real-time PCR systems for cattle-, buffalo- and yak-derived components
杨冬燕等[29]利用多重real-time PCR同时对猪、牛、马和鸭进行同步检测,在进行多重real-time PCR同步检测前,先对单重real-time PCR的检测方法进行优化,在优化后的单重反应体系中直接增加对应的引物和探针,即可用于多重real-time PCR的检测,而无需对多重realtime PCR体系进行调整也能得到较好的结果。但本研究团队在对家蚕3 种疫病病原体进行real-time PCR同步检测[30]时也发现,最佳的单重检测体系在应用到双重和多重real-time PCR时需要对体系进行调整,特别是通过不同引物探针组合间比例的调整,能达到最佳的同步检测效果。许如苏等[31]利用锁核酸探针(TaqMan-LNA)多重real-time PCR对牛、猪、鸡、鸭等成分进行同步检测,也认为通过对不同引物探针浓度比例的调整,可以得到比较好的检测结果,如上述对应物种的最佳引物终浓度比为6∶6∶3∶8,最佳探针终浓度比分别为3∶3∶1∶4;同时也发现,多重real-time PCR灵敏度会较单重低1 个数量级。
2.4 混合样中real-time PCR的检测
对制成的混合肉样用单重、双重和三重real-time PCR进行检测(表7)。单重real-time PCR结果与预设结果一致;在进行黄牛与牦牛的双重real-time PCR时,样品G(黄牛∶水牛∶牦牛=8∶1∶1)中出现了牦牛检测的假阴性;在三重real-time PCR的检测中,不论引物探针比例(黄牛∶水牛∶牦牛)为3∶3∶2或是2∶2∶1,都未在样 品G中检测到牦牛而产生假阴性,此外,样品C(黄牛∶牦牛=9∶1),在引物探针比例为3∶3∶2(黄牛∶水牛∶牦牛)的三重real-time PCR的检测中,也出现了牦牛检测的假阴性。在对混合样的检测中,所有的检测不符合的情况都出现在双重或者三重real-time PCR中的牦牛检测中,且都是假阴性。样品C和G在进行单重real-time PCR检测时,牦牛的检测结果都呈阳性,说明后续双重和三重real-time PCR检测的阴性并非样品混样不匀造成。

表7 混合肉样的real-time PCR检测结果Table 7 Real-time PCR results for mixed meat samples
同时也对混合的DNA样品进行了单重、双重和三重real-time PCR的检测(表8)。虽然DNA混合的比例和肉样混合的比例一致,但两组样品的检测结果却并不一致。在混合的DNA样品中,也出现了假阴性的结果,但都出现在黄牛的检测中:样品D’(黄牛∶牦牛=1∶9)和I′(黄牛∶水牛∶牦牛=1∶1∶8)在双重及三重real-time PCR中,都没有检测到黄牛的DNA;样品H’(黄牛∶水牛∶牦牛=1∶8∶1)的检测中,也未能在三重real-time PCR中检测到黄牛。在DNA混合样中(表8),3 种牛的DNA质量浓度均选用了10 ng/μL,将DNA质量浓度都调整为25 ng/μL,再按照表1体积比对3 种DNA进行混合,得到的结果和表8略有不同:此浓度下只有样品D’(黄牛∶牦牛=1∶9)存在检测的假阴性,即在双重和三重realtime PCR检测中都未检测到黄牛DNA,而其余样品的检测结果均与设置一致。

表8 混合DNA的real-time PCR检测结果Table 8 Real-time PCR results for mixed DNA samples
表6中得到的最佳引物探针比例是在3 种牛的DNA含量为1∶1∶1的情况下得到的,但当三者的比例存在大幅度差异的时候,特别是黄牛和牦牛的含量差异较大时,如表7中的样品C和G,表8中的样品D′和I′,含量低的物种很可能会出现假阴性的现象。但水牛的检测,并没有因为含量低至10%而出现假阴性。黄牛和牦牛都属于牛属(Bos),种属间的亲缘关系近,相比较水牛属于水牛属(Bubalus),与黄牛、牦牛的种源关系较远。在同步的多重real-time PCR检测中,若检测的目标物种种属关系亲密,同时样品为复合样品,即几种种属关系亲密的物种同时存在于一个样品中,且含量差异较大,则量少的物种可能会存在检测的假阴性。本研究没有通过调节各组引物探针的比例去克服假阴性,因为在实际检测的样品中,无法预知各种牛成分含量的比例。
杨冬燕等[29]也对混合肉样进行了三重real-time PCR同步检测,对猪、牛、马和鸭4 种成分的检出限在5%~15%之间,且检测过程中并没有出现假阴性的结果。猪、牛、马和鸭,4 种物种间的种属关系较远,可能是该三重real-time PCR成功同步检测的重要前提。
3 结 论
本研究基于具有物种特异性的线粒体基因,设计可鉴定黄牛、水牛和牦牛的引物探针各1 组,并在3 个探针上分别标记了不同的荧光信号,在优化三重real-time PCR的条件下,实现同步检测黄牛、水牛和牦牛成分。但由于三重real-time PCR对混合样中含量较低的黄牛和牦牛的检测存在假阴性的可能,因此,建议在对整块肉的样品进行检测时采用三重real-time PCR的方法同步检测3 种牛的成分,若样品为混合物,如肉丸、肉松等,则用单重real-time PCR检测更精准。
