固载离子液体修饰Fe3O4纳米酶用于 H2O2和葡萄糖的检测
2021-11-05杨培昕喻昌木汤陆扬付阳洋彭黔荣
杨培昕,喻昌木,杨 敏,,张 荣,汤陆扬,付阳洋,彭黔荣,3,
(1.贵州大学药学院,贵州 贵阳 550025;2.贵州大学化学与化工学院,贵州 贵阳 550025;3.贵州中烟工业有限责任公司技术中心,贵州 贵阳 550009)
近年来,人工模拟纳米酶由于具有与天然辣根过氧化物酶(horseradish peroxidase,HRP)类似的过氧化物酶活性而被人们广泛关注,与天然酶相比,人工模拟纳米酶具有高催化活性、稳定性好、成本低的优势[1-2]。 2007年,研究人员首次报道了Fe3O4磁性纳米颗粒具有与天然过氧化物酶类似的过氧化物酶活性[3]。但是Fe3O4磁性纳米颗粒容易聚集和氧化,改善Fe3O4纳米酶一直是研究的热点。有研究人员通过在Fe3O4表面官能化具有过氧化物酶活性的金磁微粒(Fe3O4@Au),从而提高复合纳米颗粒的过氧化物酶样活性[4]。HRP在含有水(体积分数4.53%)的一种亲水性离子液体(ionic liquid,IL) ([bmim][BF4])中可增加其活性和稳定性[5]。Walsh等[6]发现,在IL中可发生许多氧化还原反应,使其修饰的材料具有成为高性能催化剂的潜质。据了解,IL是一种由离子组成且常温下呈液态的离子化合物。与传统有机溶剂相比,IL具有热稳定性、可重复性、低毒性以及对金属催化剂、有机物、无机物和气体物质的溶解性等性能[7-9]。 在生物催化过程中,IL可提供不同的溶剂环境,使生物酶的活性增大;在反应过程中,IL和酶均可循环利用,提高酶的催化效率;并且其与部分有机溶剂互不相溶,可使酶催化产物易于分离[10-12]。在此构建IL修饰的Fe3O4@SiO2磁性纳米颗粒,在SiO2包覆的Fe3O4纳米粒子表面接枝IL涂层,获得SiO2固载IL修饰的磁性纳米粒子Fe3O4@SiO2@IL,用于葡萄糖和H2O2的检测。
葡萄糖氧化酶(glucose oxidase,GOD)在有氧条件下能专一性地催化葡萄糖氧化生成葡萄糖酸和H2O2[13]。检测H2O2和葡萄糖的方法较多,比色传感器具有操作简单、快速、方便等特点,广泛应用于生物分析、环境检测、食品检测和医疗诊断等领域[14]。将Fe3O4@SiO2@IL与GOD耦合,Fe3O4@SiO2@IL催化反应产物H2O2与过氧化物酶底物3,3’,5,5’-四甲基联苯胺(3,3’,5,5’-tetramethylbenzidine,TMB)形成蓝色产物。基于此原理,构建一种具有理想选择性和较高灵敏度的简便方法,以期为人工模拟纳米酶在食品检测中的应用提供一定的参考。
1 材料与方法
1.1 材料与试剂
牛奶 市购;GOD(98%) 北京百灵威科技有限公司;乙酸钠、三水合物(分子C2H9NaO5)(优级纯,99.5%) 苏州市麦克林医疗器械制品有限公司;3-氯丙基三乙氧基硅烷(98%) 国药集团化学试剂有限公司;N-甲基咪唑(98%) 常州市中凯化工有限公司;正硅酸乙酯(tetraethyl orthosilicate,TEOS,分析纯) 成都科龙化工试剂厂;TMB(98%)、FeCl3•6H2O、氯化铁(II)(FeCl2•4H2O)、30% H2O2等均为国产分析纯。
1.2 仪器与设备
UV-9000紫外-可见分光光度计 上海元析仪器有限公司;Nicolet iS50原位漫反射傅里叶变换红外光谱仪 美国赛默飞世尔科技有限公司;S-3400N扫描电子显微镜 日本Hitachi公司;JEM-2100透射电子显微镜 日本电子公司。
1.3 方法
1.3.1 Fe3O4磁性纳米颗粒的制备
Fe3O4磁性纳米颗粒通过共沉淀法[15]制备。将FeCl3•6H2O(0.02 mol)和FeCl2•4H2O(0.01 mol)溶解在90 mL蒸馏水中,并将所得溶液在氮气下100 ℃回流3 h。然后,将质量分数25%氨水溶液10 mL逐滴加入上述混合物中,并混合搅拌2 h。反应完成后,将混合物冷却至室温,通过使用外部磁体简单收集所得磁性纳米颗粒,然后用蒸馏水彻底洗涤,烘干备用。
1.3.2 Fe3O4@SiO2磁性微球的制备
通过溶胶-凝胶法[16],制备SiO2壳层。取上述合成的Fe3O4颗粒0.5 g,并均匀分散在乙醇(40 mL)、去离子水(10 mL)和1.5 mL浓氨水溶液(28%)的混合溶液中,并超声处理1 h。在30 ℃条件下预搅拌15 min后滴加TEOS(0.4 mL),继续搅拌6 h。收集所得微球,用乙醇和去离子水洗涤,45 ℃真空干燥12 h,得SiO2涂覆的磁性Fe3O4纳米颗粒(Fe3O4@SiO2)。
1.3.3 Fe3O4@SiO2@IL磁性纳米粒的制备
参考文献[17]并进行改进,制备IL涂层。取3-氯丙基三乙氧基硅烷(2.408 g,10 mmol)和Fe3O4@SiO2(3 g)加入到80 mL无水甲苯中,在氮气下回流12 h。冷却至室温,过滤,并用无水甲苯和无水乙醚洗涤2 次,除去未反应的反应物。然后80 ℃真空干燥6 h得到中间体Fe3O4@SiO2@(CH2)3Cl。将N-甲基咪唑(10 mmol)和Fe3O4@SiO2@(CH2)3Cl(1 g)加入到50 mL无水甲苯溶液中,并将混合物回流12 h。过滤生成的产物,并用无水乙醚洗涤以除去过量的IL,干燥,所得固体即Fe3O4@SiO2@IL。
1.3.4 材料的表征
将微量固体磁性材料溶于适量的蒸馏水,超声振荡使其均匀分散。利用扫描电子显微镜和透射电子显微镜观察材料形貌。将合成的干燥纳米粒子粉末与KBr混合,充分研磨后压片,利用原位漫反射傅里叶变换红外光谱仪分析材料结构。
1.3.5 Fe3O4@SiO2@IL过氧化物酶活性分析及条件优化
通过测定H2O2存在下过氧化物酶底物TMB的催化氧化能力,可以估算Fe3O4@SiO2@IL纳米材料的过氧化物酶活性。实验如下:将Fe3O4@SiO2@IL(300 μL,0.4 mg/mL)、H2O2(300 μL,80 mmol/L)和NaAc缓冲溶液(300 μL,50 mmol/L,pH 3)以及TMB(300 μL,8 mmol/L)混合均匀后在40 ℃下孵育20 min。然后记录在波长652 nm处(TMB的特征峰)的紫外-可见吸收。类似地,根据相同步骤研究不同pH值的NaAc缓冲溶液(pH 2~9)、孵育温度(20~80 ℃)、孵育时间(0~20 min)和催化剂质量浓度为0~0.5 mg/mL范围内Fe3O4@SiO2@IL过氧化物酶活性的变化。
1.3.6 动力学分析
首先,保持TMB浓度恒定并改变H2O2浓度(0.1~1.0 mmol/L),加入乙酸钠缓冲液(300 μL,50 mmol/L,pH 3)和Fe3O4@SiO2@IL(300 μL, 0.4 mg/mL)制成不同浓度的混合溶液,并在50 ℃下孵育20 min后,通过紫外-可见光分光光度计在波长652 nm处测定混合物的吸光度。类似地,通过在相同条件下保持H2O2浓度恒定并改变TMB浓度(0.1~1.0 mmol/L),研究以H2O2为底物的动力学分析。
通过从Michaelis-Menten方程导出的Lineweaver-Burk图以计算酶动力学参数:1/V=Km/Vmax(1/[S]+1/Km);其中,V为反应的初始速率/(mol/(L·s));Vmax为最大反应速率/(mol/(L·s));[S]为底物的浓度/(mol/L);Km可近似代表酶对底物的亲和,Km值一般在10-6~ 10-2mol/L范围内。
在此,根据Lambert-Beer定律(A=k×b×c)对Ox-TMB浓度进行定量。其中,A为吸光度;b为溶液厚度/cm;c为Ox-TMB的浓度/(mol/L);k为摩尔吸光系数,通常为39 000/(L/(mol•cm))[18-20]。
1.3.7 H2O2和葡萄糖的检测
1.3.7.1 H2O2的检测
将TMB(300 μL,8.0 mmol/L)、Fe3O4@SiO2@IL 储备溶液(300 μL,0.4 mg/mL)和不同浓度的H2O2溶液(0.001~1 mmol/L)加入到2 mL乙酸盐缓冲液(pH 3.0,50 mmol/L)中,然后将混合溶液在40 ℃温育20 min后通过紫外分光光度计测量在波长652 nm处吸光度的变化。
1.3.7.2 葡萄糖的检测
将GOD(0.2 mL,1.0 mg/mL)、1.0 mL不同浓度的葡萄糖(0.02~0.2 mmol/L)加入到1 mL磷酸盐缓冲液(pH 7.0)中混合,并在37 ℃温育30 min;之后,将Fe3O4@SiO2@IL(300 μL,0.4 mg/mL)、TMB(300 μL,8 mmol/L)和乙酸盐缓冲液(2 mL,50 mmol/L,pH 3)添加至上述葡萄糖反应溶液中,并在40 ℃下温育20 min。最后在紫外分光光度计下测量其在波长652 nm处的吸光度变化。为了测试葡萄糖检测的选择性,选择蔗糖、果糖、乳糖、麦芽糖进行对照实验,对照样品的浓度高于葡萄糖的浓度(约5 倍)。
1.3.7.3 实际样品的检测
建立的检测方法用于牛奶中H2O2的检测。样品的预处理:首先向25 mL牛奶样品中添加1%(体积分数)三氯乙酸25 mL,并超声处理20 min去除牛奶样品中的蛋白质;然后以12 000 r/min离心10 min,将上清液通过0.22 μm膜过滤,除去脂质;通过向该上清液中添加不同浓度的H2O2储备溶液,制备不同浓度的H2O2牛奶样品。取不同浓度的牛奶样品100 μL分别加入300 μL Fe3O4@SiO2@IL悬浮液(0.4 mg/mL)和300 μL TMB (8.0 mmol/L),加入到2 mL乙酸盐缓冲液(pH 3.0,50 mmol/L)中,然后在40 ℃温育20 min。根据上述1.3.7.1节方法测量吸光度的变化,重复3 次,考察检测体系的加标回收率。
2 结果与分析
2.1 材料的表征
采用共沉淀法制备Fe3O4纳米颗粒,然后以TEOS为硅源制备SiO2壳层,目的是提高纳米材料的分散性,并且保护磁铁矿芯在使用过程中不被腐蚀和氧化[16]。 加入3-氯丙基三乙氧基硅烷,经回流改性与硅胶层形成Si—O—Si键,从而表面接枝带上氯丙基,获得中间体Fe3O4@SiO2@(CH2)3Cl[21-22]。最后通过N-甲基咪唑与修饰在硅胶壳上的氯丙基反应,形成了带N-甲基咪唑氯鎓的固定化IL。IL由于相同电荷之间的排斥作用,能够有效减少聚集,增强稳定性。如图1所示,将裸露的Fe3O4磁性纳米颗粒溶于水中,大部分颗粒聚集在底部,分散性差;而IL修饰后的Fe3O4磁性纳米颗粒(Fe3O4@SiO2@IL)在水溶液中呈现出较好的分散性和顺磁性,使其可以很容易地从反应介质中分离出来,增强重复利用性。

图1 Fe3O4@SiO2@IL的合成原理示意图Fig. 1 Schematic diagram for the synthesis principle of Fe3O4@SiO2@IL
如图2、3所示,在Fe3O4的光谱中可以看到O—H在3 100~3 500 cm-1附近的伸缩振动和Fe—O在575 cm-1附近的伸缩振动(a谱)。出现在1 090 cm-1处的宽吸收峰是Si—O—Si拉伸振动的特征峰(b谱),表明形成了SiO2壳层。1 584 cm-1处的峰可归因于双键咪唑环的C=N 拉伸(c谱),表明IL已成功地修饰在Fe3O4@SiO2上。从图3A可以看出,Fe3O4纳米颗粒呈颗粒状聚集体的簇状结构,经SiO2壳层涂覆后形成较为分散的颗粒状 (图3B)。相较于图3A、B,IL修饰后的纳米材料形貌发生了变化,大多数表现为表面光滑的球状结构(图3C),说明Fe3O4纳米颗粒可能与IL发生了某种特定的相互作用。使用透射电镜进行更详细的观察,如图3D所示,证实本实验制备的Fe3O4@SiO2@IL为均一的球形,且直径约为20 nm。

图2 傅里叶变换红外光谱图Fig. 2 FT-IR spectra of Fe3O4, Fe3O4@SiO2 and Fe3O4@SiO2@IL

图3 Fe3O4(A)、Fe3O4@SiO2(B)和Fe3O4@SiO2@IL(C)的扫描电镜和Fe3O4@SiO2@IL的透射电镜(D)图Fig. 3 SEM images of Fe3O4 (A), Fe3O4@SiO2 (B) and Fe3O4@SiO2@IL (C) and TEM image of Fe3O4@SiO2@IL (D)
2.2 Fe3O4@SiO2@IL类过氧化物酶活性分析
为了研究在H2O2和底物TMB存在下Fe3O4@SiO2@IL的过氧化物酶样活性,比较有无H2O2和TMB时的比色反应。如图4所示,在对照组实验中,缺少H2O2或TMB时,曲线1和曲线2无明显的紫外吸收。而TMB与H2O2存在下,在波长652 nm处出现了一个明显的吸收峰(曲线3)。这是由于Fe3O4@SiO2@IL在H2O2存在下能氧化TMB,使溶液变蓝(如插图所示),并在波长652 nm处产生特定的吸收峰。实验表明,制备的Fe3O4@SiO2@IL具有较好的类过氧化物酶活性。

图4 不同反应体系溶液的紫外-可见光吸收图谱Fig. 4 UV-Vis absorption spectra of different reaction system solutions
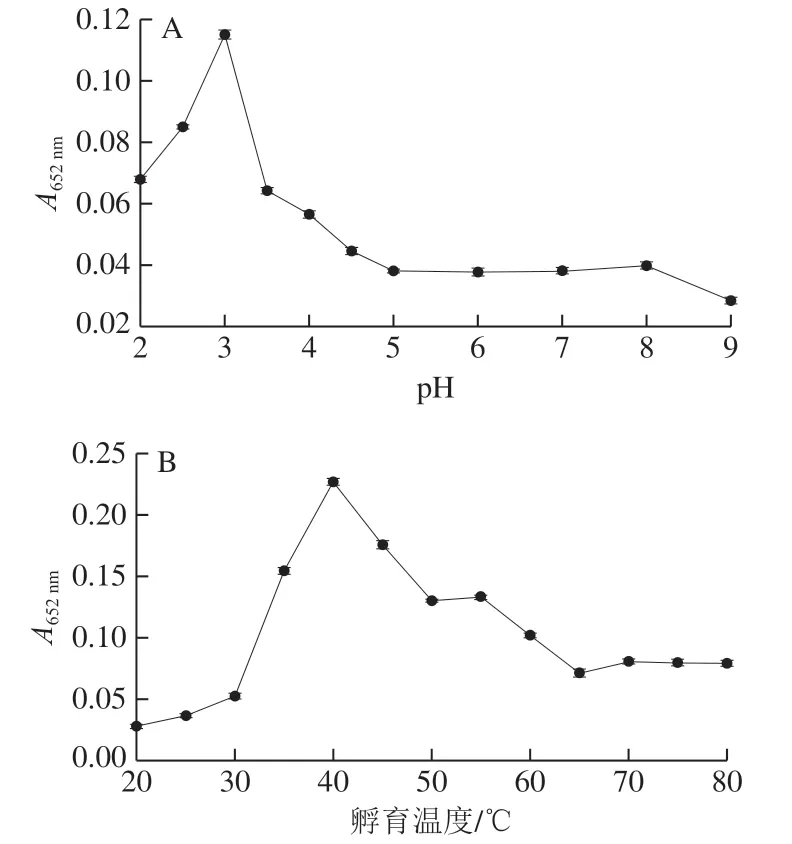
另外,类似于天然过氧化物酶HRP,基于纳米材料的过氧化物酶模拟物的酶活性受pH值和温度等条件影响。在缓冲溶液pH 2~9、孵育温度20~80 ℃的范围内研究酸度和温度对体系中显色产物吸光度的影响,结果显示pH 3、孵育温度40 ℃时达到最佳催化活性 (图5A、B)。接着研究Fe3O4@SiO2@IL质量浓度对体系中显色产物吸光度的影响,如图5C所示,在Fe3O4@SiO2@IL质量浓度为0~0.5 mg/mL范围内,显色产物吸光度随Fe3O4@SiO2@IL质量浓度增加而增加,当Fe3O4@SiO2@IL质量浓度达到0.4 mg/mL时,逐渐趋于平衡。同理,如图5D、E所示,在H2O2浓度为10~100 mmol/L和TMB浓度为1~10 mmol/L范围内,浓度增加其催化活性也随之增加,当H2O2浓度达到80 mmol/L或TMB浓度达到8.0 mmol/L时,Fe3O4@SiO2@IL催化活性趋于平衡,并且选择最佳孵育时间为20 min(图5F)。根据优化结果,选择Fe3O4@SiO2@IL 0.4 mg/mL、H2O280 mmol/L和TMB 8 mmol/L进行后续实验。

图5 pH值(A)、孵育温度(B)、Fe3O4@SiO2@IL质量浓度(C)、H2O2(D)、TMB(E)以及孵育时间(F)对酶活性的影响Fig. 5 Effects of pH (A), temperature (B), concentrations of Fe3O4@SiO2@IL (C), H2O2 (D), TMB (E) and incubation time (F) on peroxidase mimic activity
2.3 Fe3O4@SiO2@IL的稳态动力学分析
通过改变一种底物的浓度,同时保持另一种底物的浓度不变,测定一系列的动力学数据,研究催化机理,获得相应的动力学参数。如图6所示,在合适的TMB和H2O2浓度范围内观察到与酶促反应相似的典型Michaelis-Menten行为。由双倒数Lineweaver-Burk方程可得到最大初速度(Vmax)和Michaelis-Menten常数(Km)等基本参数:1/V=Km/Vmax(1/[s]+1/Km)。通过计算15 min内波长652 nm处吸光度变化斜率,得到表观反应速率,如表1所示。Km值通常被认为是酶与特定底物亲和力的指标。Km值越小,说明酶与底物的亲和力越强,所研究催化剂的效率越高。由表1可以看出,以TMB(0.107 mmol/L)和H2O2(0.245 mmol/L)为底物的Fe3O4@SiO2@IL的Km值远低于HRP(0.434 mmol/L和3.700 mmol/L),说明Fe3O4@SiO2@IL对TMB和H2O2的亲和力远高于HRP。另一方面,在不同固定TMB浓度下,TMB对H2O2的氧化反应双倒数曲线呈一组线性平行线(图6C、D),这是典型的乒乓机制[23-24]。与其他具有过氧化物酶活性的纳米材料相比,Fe3O4@SiO2@IL的Km值均具有较大优势,这进一步证实了IL修饰的Fe3O4纳米颗粒与比色底物TMB和H2O2具有较好的亲和性。

图6 Fe3O4@SiO2@IL的稳态动力学图Fig. 6 Steady-state kinetics of Fe3O4@SiO2@IL

表1 Fe3O4@SiO2@IL纳米材料与其他纳米酶和HRP的Km和 Vmax参数的比较Table 1 Km and Vmax values of Fe3O4@SiO2@IL nanomaterials, other nanozymes and HRP
2.4 H2O2和葡萄糖的检测
体系中Fe3O4@SiO2@IL表现出过氧化物酶活性,能够有效催化H2O2氧化TMB发生显色反应。TMB的显色程度与H2O2浓度呈正比。因此,考察紫外吸收光谱652 nm(TMB的特征峰)处的吸光度可有效检测H2O2。基于此,通过结合GOD与葡萄糖反应生成H2O2的原理,可间接检测葡萄糖。原理如图7所示,GOD在有氧条件下作用于葡萄糖生成葡萄糖醛酸,同时产生H2O2。Fe3O4@SiO2@IL与产物H2O2反应生成H2O和O2,然后与第2底物TMB反应生成蓝色产物TMBox[23]。

图7 葡萄糖比色测定原理图Fig. 7 Schematic diagram for the colorimetric determination of glucose
由图8A可知,体系在波长652 nm处(TMB的特征峰)的吸光度随H2O2浓度的增加而增大,然后趋于平衡。同源线性校准曲线(图8B)表现出在最佳条件下,吸光度与H2O2浓度在4~100 μmol/L范围内呈线性关系,其线性方程为y=0.049 57+0.938 17x,相关系数为 0.996 49。检出限(limit of detection,LOD)为 0.698 μmol/L。其中LOD的精确度(相对标准偏差(relative standard deviation,RSD))为0.304%(n=5)。与其他过氧化物酶模拟物相比(表2),Fe3O4@SiO2@IL具有更宽的线性检测范围和更低的LOD。

图8 H2O2浓度与吸光度的剂量-响应曲线(A)及同源性 校准曲线(B)Fig. 8 Plot of H2O2 concentration versus absorbance (A) and calibration curve (B)

表2 检测H2O2材料的性能比较Table 2 Performance comparison of various materials for detecting H2O2
如图9所示,在0.008~0.2 mmol/L范围内,吸光度与葡萄糖浓度呈良好的线性关系。LOD为2.39 μmol/L,与先前报道的其他过氧化物酶模拟物相比(表3),Fe3O4@SiO2@IL具有较低的葡萄糖LOD。

表3 检测葡萄糖纳米材料的性能比较Table 3 Performance comparison of various nanomaterials for glucose detection

图9 葡萄糖检测的剂量-响应曲线(A)和葡萄糖浓度变化的 紫外吸收光谱图(B)Fig. 9 Plot of glucose concentration versus absorbance (A) and UV-Vis spectra of varying glucose concentrations (B)

2.5 Fe3O4@SiO2@IL的干扰性
为了进一步研究该方法的特异性,选择空白样品、蔗糖、果糖、乳糖和麦芽糖进行对照实验。如图10所示,即使对照样品的浓度是葡萄糖浓度的5 倍,含葡萄糖样品的吸光度也远高于对照样品。此外,蔗糖、果糖、乳糖和麦芽糖样品中,肉眼可观察到葡萄糖样品的蓝色变化(插图)。结果表明,该比色法反应体系对葡萄糖具有较高的选择性。

图10 葡萄糖的选择性检测(n=3)Fig. 10 Selectivity for glucose detection (n= 3)
2.6 Fe3O4@SiO2@IL的稳定性
连续7 d测量Fe3O4@SiO2@IL纳米材料吸光度的变化,评估其长期贮存稳定性。如图11所示,Fe3O4@SiO2@IL在一周内具有较好稳定性,表明Fe3O4@SiO2@IL具有良好的长期贮存稳定性。

图11 Fe3O4@SiO2@IL的稳定性(n=3)Fig. 11 Stability of Fe3O4@SiO2@IL (n = 3)
2.7 实际样品的检测
H2O2通常被用作生乳中的保鲜剂,但是,过量添加H2O2不仅会降低牛奶的营养价值,还会导致胃肠道疾病,因此,检测牛奶中H2O2的含量具有重要意义。基于Fe3O4@SiO2@IL的过氧化物酶样活性比色传感器检测牛奶中的H2O2,结果如表4所示,测定牛奶样品中H2O2的回收率为94.0%~107.8%,RSD为2.24%~3.12%。表明Fe3O4@SiO2@IL纳米材料可以有效用于牛奶中H2O2的测定,并且具有较高的准确度和精密度,在实际样品分析中具有潜在的应用价值。

表4 牛奶样品中H2O2的测定Table 4 Recoveries of H2O2 in spiked milk samples
3 结 论
采用共沉淀法制备Fe3O4纳米颗粒并添加SiO2壳层,然后将3-氯丙基三乙氧基硅烷接枝在Fe3O4@SiO2纳米颗粒上并与N-甲基咪唑进一步反应,合成具有IL涂层的Fe3O4磁性纳米颗粒。研究证明,Fe3O4@SiO2@IL有效改善了Fe3O4磁性纳米颗粒的聚集。在优化条件下,Fe3O4@SiO2@IL表现出较好的过氧化物酶样活性和对底物TMB和H2O2的亲和性,在H2O2存在下可催化过氧化物酶底物TMB氧化产生蓝色反应。基于Fe3O4@SiO2@IL 的过氧化物酶性质,开发一个简单而灵敏的葡萄糖和H2O2检测平台,用于牛奶中H2O2的检测,加标回收率为94.0%~107.8%。Fe3O4@SiO2@IL具有构建低成本和简单生物传感器的巨大潜力,并为人工模拟酶应用于食品检测提供了参考。
