基于高通量测序分析感染菌核病和健康桑果 内生菌群落结构及多样性
2021-11-05彭芳芳魏召新李勋兰罗友进韩国辉
彭芳芳,魏召新,李勋兰,罗友进,韩国辉
(重庆市农业科学院果树研究所,重庆 401329)
植物内生菌是植物微生态系统的重要组成部分,能够和植物本身和谐共处。研究发现,内生菌感染植物宿主后,植物一般具有生长快速、抗逆境、抗病害等优势,比未感染内生菌的植株更具生存竞争力[1]。随着科学研究的不断深入,植物内生菌在生物防治以及生理生态方面的作用逐渐被挖掘,成为国内外农业、食品等领域的研究重点。一般果树内生菌主要集中于果树的根、茎、叶、花、果实等组织器官中,能够为宿主提供保护,产生诸如生物碱、水解酶、抗生素类物质或其他代谢产物[2],诱导植物产生抗性,达到消灭病原菌或与之形成竞争的关系,直接或间接提高果树免疫能力,起到生物防护的作用。
桑果作为一种食药兼用的特色水果,因其特殊的物质成分及保健功能[3-4],越来越受到研究者重视和消费者欢迎。菌核病是桑果产业发展中危害最为严重的病害,主要危害果实,具有发病快、范围广等特点,其病原主要有桑实杯盘菌(Ciboria shiraiana)、肉阜状杯盘菌(Ciboria carunculoides)、核地杖菌(Scleromitrula shiraiana)和核盘菌(Sclerotinia sclerotiorum)4 种[5]。目前,生产中对桑果菌核病的防治以化学农药防治为主[6], 其过量使用会导致病原菌产生耐药性[7],而且带来的农药残留以及环境污染,给桑果的绿色安全生产带来很大的威胁和风险。因此,亟需寻找安全、高效、环境友好的菌核病防治新方法,而具有抗菌特性的内生菌可作为桑果菌核病生物防治的有效选择。“以菌治菌”的生防菌制剂,不仅生防能力突出,而且可促进种子萌发、植物生长,具备一系列在合成非核糖体肽以及核糖体依赖性的tasA和细菌素中起作用的基因簇,并且这些基因簇与抗菌代谢物质的形成有关[8-11]。我国利用桑树内生菌进行病害生物防治的基础研究起步较晚,虽在研究方法和思路上已有一定的积累,但仍存在大量尚待研究的内生菌及其代谢产物。对于内生菌群落结构及多样性的研究,传统的平板分离法并不能真正反映内生菌群落特征[12-13]。 高通量测序技术为微生物多样性研究提供了更加可靠的技术支撑,目前已广泛应用于农业、工业、医疗、食品等领域[14]。此外,外部环境条件已被证实是影响微生物种群密度和生态的重要因素[15-17],熊大维等[18]研究表明,脐橙感黄龙病植株和健康植株叶片内生菌有着明显差异,黄龙病菌的存在改变了脐橙叶片原有内生细菌的群落结构,内生菌数量及多样性均发生明显变化。因此,本研究采用Illumina MiSeq二代测序技术,分析感菌核病和健康桑果的内生菌群落结构及多样性变化,探讨伴生菌与菌核病病原菌的互作关系,旨在为建立桑果微生物信息系统、桑果菌核病的病原学研究以及防治提供参考。
1 材料与方法
1.1 材料
以桑树品种“大10”的果实作为实验材料(图1),分为健康组(A组)、感病组(B组),每组3 个样品,分别记为A1、A2、A3、B1、B2、B3,以上样品均取自重庆市农业科学院桑树基地,随机选择6 株桑树,每株选择9 个长势一致的果实作为一个混合样,置冰盒带回实验室,4 ℃保存备用。

图1 健康桑果(A)与患病桑果(B)对比图Fig. 1 Healthy (A) and infected mulberry (B) fruits
1.2 方法
1.2.1 基因组DNA提取、聚合酶链式反应(polymerase chain reaction,PCR)扩增及检测
使用试剂盒对实验样品进行基因组DNA提取,具体方法参照说明书。利用1%琼脂糖凝胶电泳检测所提取基因组DNA浓度和纯度。根据测序区域,合成带有barcode的特异引物进行PCR扩增,使用AxyPrepDNA凝胶回收试剂盒(AXYGEN公司)切胶回收PCR产物,Tris-HCl洗脱,2%琼脂糖电泳检测。参照电泳初步定量结果,将PCR产物用QuantiFluor™-ST蓝色荧光定量系统(Promega公司)进行检测定量,并均一化处理。
1.2.2 Illumina PE250文库构建与测序
构建步骤:连接“Y”字形接头-使用磁珠筛选去除接头自连片段-利用PCR扩增进行文库模板的富集-氢氧化钠变性,产生单链DNA片段。文库构建后利用Illumina公司的MiSeq PE250进行高通量测序。
1.2.3 数据处理与分析
利用Trimmomatic软件、Flash软件、Usearch软件、Qiime软件以及上海元莘生物自行开发的perl程序进行序列的优化与统计,有效序列按照97%的一致性聚类成为操作分类单元(operational taxonomic units,OTU);Qiime平台、RDP Classifier对97%相似水平的OTU代表序列进行物种分类学分析[19],进而计算微生物多样性指数;R语言Vegan包,Vegdist和Hclust进行群落Heatmap图[20]、 Bray-Curtis距离计算和聚类分析;R语言进行主成分分析(principal component analysis,PCA)[21];LEfSe软件估算每个组分(物种)丰度对差异效果影响的大小。
2 结果与分析
2.1 测序数据分析
经过质控过滤、去除嵌合体,细菌和真菌分别获得535 600、717 021 条Effective Tags,碱基数分别为220 138 093、151 427 189 bp,平均长度分别为411.01、211.19 bp,内生细菌序列长度高度集于在401~420 bp范围内,内生真菌多集中在161~180 bp(图2)。将Effective Tags在97%的相似度水平下进行聚类,分别获得OTU 961、423 个,其中非重复OTU分别为281、259 个。Specaccum物种累积曲线反映出随着样本量的增加,曲线逐步趋于平缓,表明抽样充分,可以进行数据分析(图3)。
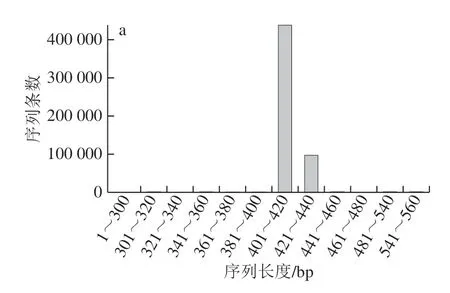
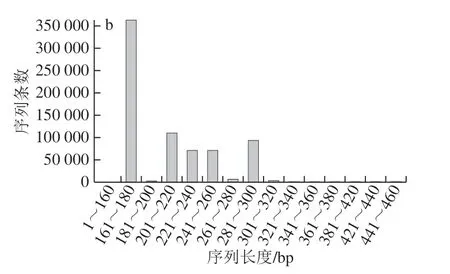
图2 内生菌序列分布Fig. 2 Sequence distribution of endophytes
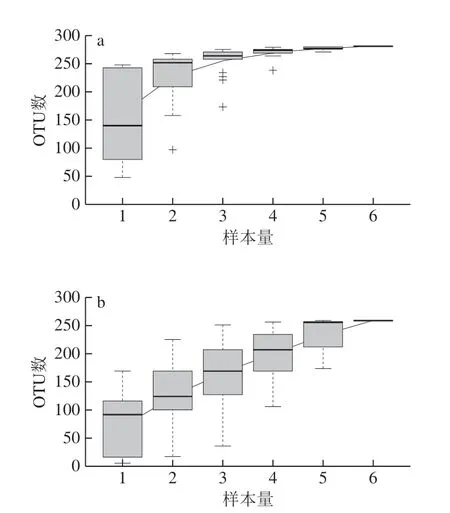
图3 内生菌的Specaccum物种累积曲线Fig. 3 Specaccum species accumulation curves of endophytes
2.2 内生菌多样性分析
2.2.1α多样性指数分析
α多样性可以反映微生物群落的丰度和多样性情况,常用的度量指标有ACE指数、Chao指数、Shannon指数和Simpson指数[22]。ACE指数、Chao指数用于表示样品内生菌丰富度;Shannon指数、Simpson指数用于表示样品内生菌多样性。其中,Simpson指数越大,说明群落多样性越低;其余指数值越大,说明相应的群落丰富度、均匀度和多样性越高。从表1可知,各样本文库的覆盖率较高(>99.9%),能够代表桑果样本中内生菌的真实信息。Chao指数、ACE指数表明,内生细菌的丰富度整体上高于内生真菌。对于A组而言,内生真菌的Shannon指数高于内生细菌,Simpson指数低于内生细菌,而B组则完全相反,内生真菌的Shannon指数低于内生细菌,Simpson指数高于内生细菌,以上表明,健康桑果中内生真菌的多样性较内生细菌有优势,而感病桑果中内生细菌多样性较内生真菌有优势。
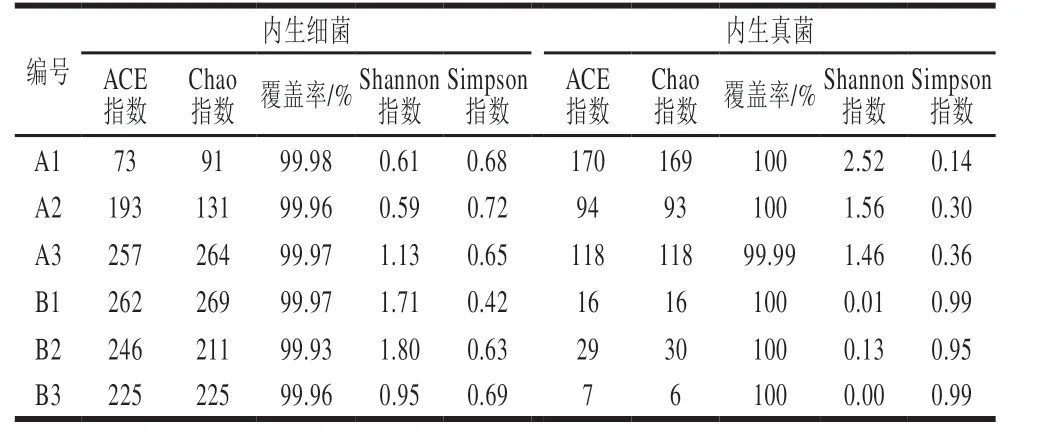
表1 桑果内生菌群落多样性指数分析Table 1 Diversity indexes of endophytic communities in mulberry fruits
2.2.2β多样性分析
采用PCA法对两组桑果内生菌的β多样性进行分析,评估其群落组成相似性及差异性情况。从图4a看出,PC1、PC2分别解释了内生细菌总变异的97.48%、1.34%,在OTU水平上,A组3 个样品距离较近,群落组成相似性较高;B组则较为分散,在PC1水平上,B3和A组样品距离较近,表明感病果实中的病原菌可能会不同程度的改变原有的群落结构。从图4b看出,PC1、PC2分别解释了内生真菌总变异的83.34%、9.91%,与内生细菌不同的是,B组3 个样品聚集明显,从内生真菌角度看,A组和B组内生真菌群落差异明显。对比图4可知,无论是内生细菌还是真菌,A组中3 个样品均表现出一定的个体独立性。
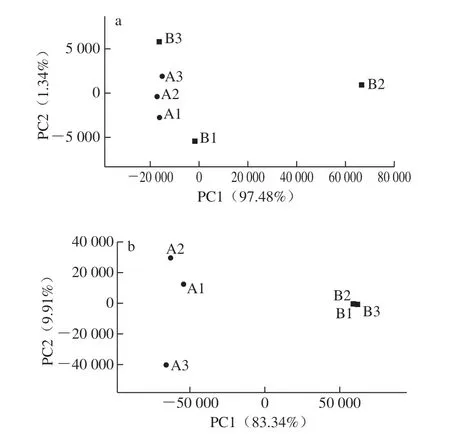
图4 内生菌群落PCA图Fig. 4 PCA of endophytic communities in mulberry fruits
2.3 内生菌群落结构组成
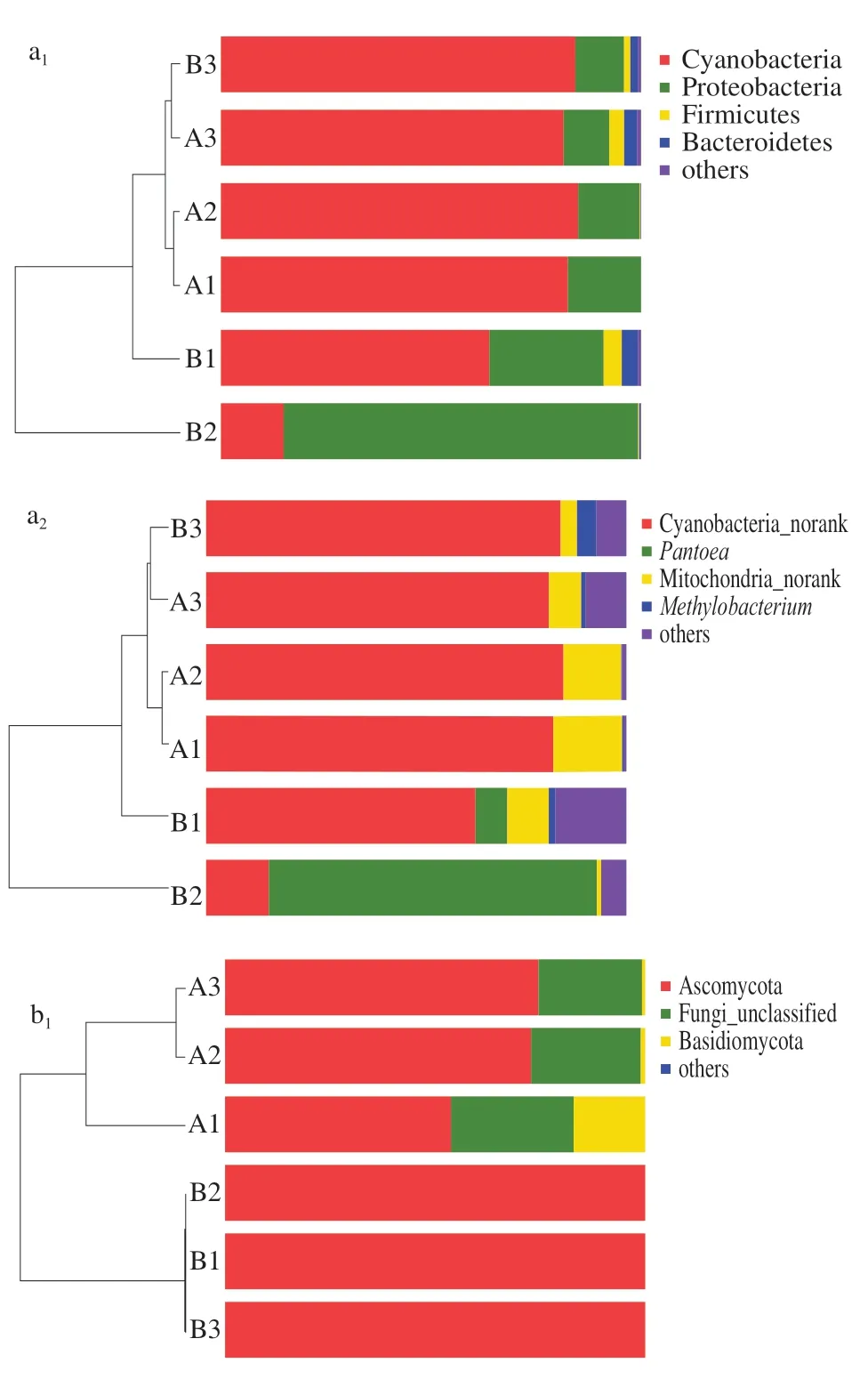
在属、科、目、纲、门水平上分别对2 组样品的群落结构进行分析。如图5a所示,内生细菌共鉴定出10 个门类,其中占比在0.3%以上的依次为蓝藻门(Cyanobacteria,68.74%)、变形菌门(Proteobacteria,27.69%)、厚壁菌门(Firmicutes,1.62%)、拟杆菌门(Bacteroidetes,1.54%)。蓝藻门为优势菌门,分支单一,包括1 纲1 目1 科1 属;变形菌门为相对优势菌门,包括2 纲5 目7 科8 属;厚壁菌门包括2 纲2 目3 科6 属;拟杆菌门包括1 纲1 目4 科4 属。在属的水平,Cyanobacteria_norank(分类学系谱中没有这个层级的科学名称,用norank作标记)为优势菌属(68.74%),泛菌属(Pantoea,14.32%)为相对优势菌属;占比超过1.0%的有Mitochondria_norank(8.75%)、甲基杆菌属(Methylobacterium,1.28%);占比在0.3%~1.0%之间的有Enterobacteriaceae_unclassified、拟杆菌属(Bacteroides)、沙雷氏菌属(Serratia)、气单胞菌属(Aureimonas)、普雷沃菌属(Prevotella_9)和根瘤菌属(Rhizobium)。此外,如图6a所示,Heatmap图可以直观地看出各样品在属分类水平上群落组成结构相似性及差异性,除A3外,A组样品的内生菌群落结构多样性明显小于B组所有样品,说明感病果实内生细菌多样性高于健康果实,与2.2.1节结果相似。Cyanobacteria_norank、Mitochondria_norank是病原菌影响最为明显的两个属,均呈下降的趋势。未发现单独存在于某一样本中的特有菌属。层次聚类的结果和β多样性分析相似。
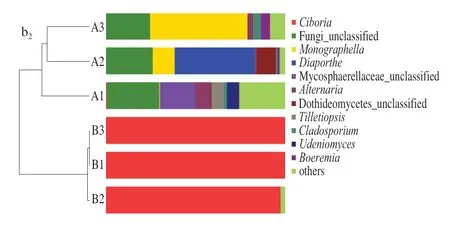
图5 不同分类水平下的内生菌主要类群Fig. 5 Main endophytic groups at different taxonomic levels in mulberry fruits
如图5b所示,内生真菌共鉴定出3 个门类,依次为子囊菌门(Ascomycota,83.52%)、Fungi_unclassified(13.34%)、担子菌门(Basidiomycota,3.14%),子囊菌门为优势菌门,包括3 纲8 目15 科18 属;Fungi_unclassified菌门几乎全部存在于A组,且为相对优势菌门;担子菌门包括3 纲4 目4 科5 属。在属的水平,杯盘菌属(Ciboria,49.64%)为优势菌属,占比超过2.0%的属有5 个,分别为Fungi_unclassified(13.34%)、Monographella(11.15%)、间座壳属(Diaporthe,7.48%)、球腔菌科(Mycosphaerellaceae_unclassified,3.31%)和链格孢属(Alternaria,2.03%);占比超过1.0%的属有5 个,分别为座囊菌纲(Dothideomycetes_unclassified)、腥掷孢菌属(Tilletiopsis)、刺盘孢属(Cladosporium)、Udeniomyces和Boeremia;在0.3%~1.0%的属有11 个。如图6b所示,B组中杯盘菌属占比高达99%以上,且内生真菌多样性远小于A组。值得注意的是,在A组也检出少量的杯盘菌属,且多数存在于A1中,同时发现A1中多数真菌丰度大于A2和A3,其中最为突出的是Mycosphaerellaceae_unclassified与赤霉菌属(Gibberella)2 个属,Mycosphaerellaceae_unclassified在A1中的丰度分别是A2和A3的2 835.93、226.67 倍,赤霉菌属在A1中的丰度分别是A2和A3的63.74、261.82 倍,此变化是否和少量病原菌入侵有关,还有待于进一步验证。此外,间座壳属、棒孢属(Corynespora)分别为A2、A3的特有菌属,这可能是由于植株(样品)个体差异,对病原菌的敏感程度及调节能力不同所致。层次聚类的结果和β多样性分析相似。
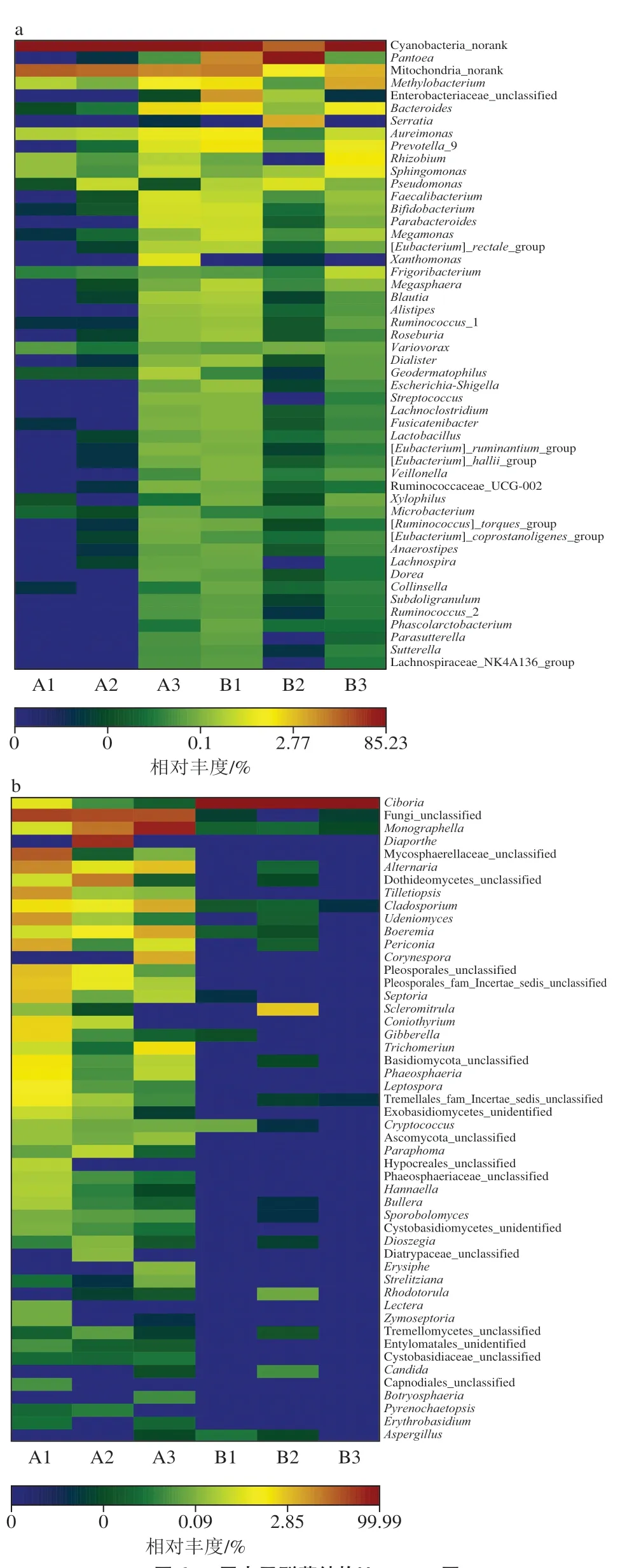
图6 属水平群落结构Heatmap图Fig. 6 Heatmap of endophytic community structure at the genus level
2.4 组间内生菌差异显著分析
采用LEfSe(LDA Effect Size)分析方法,进行感病桑果及健康桑果内生菌差异显著分析,寻找具有统计学差异的生物标识(Biomarker)。从图7a、b可知,只有B组进入了预设值。泛菌属(Pantoea)、嗜纤维菌纲(Cytophagia)及其分支嗜纤维菌目(Cytophagales)、嗜纤维菌科(Cytophagaceae)、薄层菌属(Hymenobacter)是B组中起重要作用的微生物类群,其中泛菌属(Pantoea)对其影响程度最大。

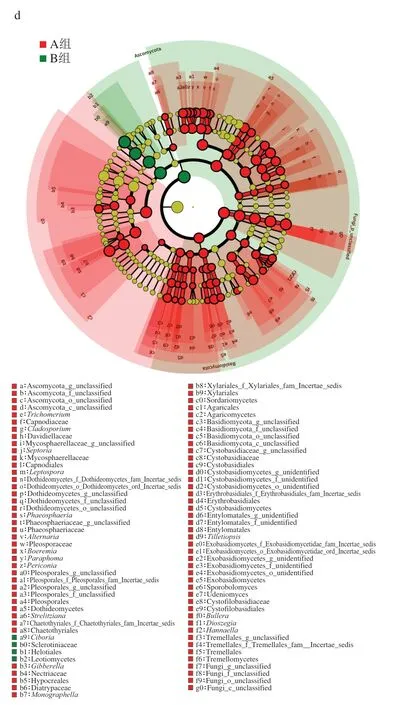
图7 LDA值与物种分支图Fig. 7 LDA scores and cladograms of endophytes
从图7c可知,A组中有差异显著的Biomarker远大于B组。结合进化分支图(图7d)可知,两组内有差异的Biomarker相对较多,包括3 门10 纲20 目25 科32 属,其中B组仅有1 门(Ascomycota)、1 纲(锤舌菌纲,Leotiomycetes)、1 目(柔膜菌目,Helotiales)、1 科(核盘菌科,Sclerotiniaceae)、1 属(Ciboria)在组间有显著差异,且丰度较高,其余的2 门9 纲19 目24 科31 属均存在于A组,其中丰度相对较高的有2 纲1 目1 科1 属,分别为粪壳菌纲(Sordariomycetes)和Dothideomycetes 2 纲、炭角菌目(Xylariales)及其分支的1 科(Xylariales_f_Xylariales_fam_Incertae_sedis)1 属(Monographella)。
3 讨 论
3.1 感病与健康桑果的内生菌多样性
目前,关于菌核病病原侵染对健康桑果内生菌群落结构及多样性造成的影响鲜见报道,本研究以桑树的感病果实和健康果实为研究对象,采用高通量测序技术,分析二者内生菌群落结构及多样性差异。从ACE指数、Chao指数、Shannon指数、Simpson指数(表1)4 个多样性指标变化可知,病原菌的入侵明显改变了桑果的内生菌群落多样性,但其对细菌和真菌的影响规律不一致。整体上看,感病果实内生细菌丰富度及多样性高于健康果,而真菌丰富度及多样性低于健康果。其中细菌的变化规律和向立刚等[23]关于感病烟株细菌变化相似,可能是菌核病严重破坏了果实组织,内部平衡被打破,导致环境中其他细菌在发病组织中定植,另一方面,植株自身的防御系统在受到外来病原菌攻击时,根部内生细菌可能会通过茎部向果实迁移;真菌变化与邓世林等[24]关于感病杨树叶围的研究相似,可能是因为病原菌的大量繁殖改变了内生真菌的生态环境,与原生真菌形成生态位竞争的关系,导致部分真菌减少甚至消失。β多样性及层次聚类分析表明,B组样品的内生细菌群落组成差异性较大,且B3和A组样品细菌组成相似性在PC1水平相对较高,可能是由于病原菌对桑果的破坏程度不同而引起内生细菌群落结构组成差异较大。
3.2 感病与健康桑果的内生细菌群落结构组成及差异
变形菌门、厚壁菌门、拟杆菌门、酸杆菌门(Acidobactria)以及放线菌门(Actinobacteria)是桑树主要的内生细菌资源[25-26]。本研究对感病和健康桑果的内生菌群落结构分析发现,蓝藻门是果实相对其茎段内生菌[26]的特有菌门,放线菌门相对较少,不含有酸杆菌门,这可能和宿主专化性及桑果内环境有关。从属水平看,除A3外,健康桑果内生细菌类群仅为患病组的45.39%,可能和3.1节讨论部分分析的原因有关。相对来说,Cyanobacteria_norank、Mitochondria_norank 2 个属在患病组含量呈现明显下降趋势,说明二者对病原菌较为敏感。LEfSe分析表明,泛菌属在B组中是重要的微生物类群,其丰富度远大于A组,而该属一分支已被证实具有致萎活性,可能会与其他病原菌发生协同作用,导致桑枯萎病[27]。目前,芽孢杆菌属被认为是具有显著生防作用的一类菌[9],且对植物生长有促进作用,但在本研究中,芽孢杆菌属几乎不存在于桑果中,这一发现为今后芽孢杆菌属在果实中的定殖研究奠定了基础。
3.3 感病与健康桑果的内生真菌群落结构组成及差异
内生真菌在门的组成水平相对简单,主要为子囊菌门、Fungi_unclassified和担子菌门,其中Fungi_unclassified、担子菌门在感病组有不同程度下降,前者几乎不存在于感病组,后者受病原菌影响较大,整体下降99.07%,说明二者为菌核病敏感指示菌门。关于健康果中也含有少量病原菌Ciboria,但未发病的现象,可能与病原菌侵染方式和气候有关,菌核病病原菌孢子特异性侵染桑雌花一般发生在春季2—3月桑雌花开放时,后致桑果染病[28],此外,采集样品时(5月初)重庆气温已经达到30 ℃以上,不利于病原菌菌丝大量繁殖,故有病原菌但并未发病。Wilcoxon秩和检验发现,健康组和感病组桑果内生真菌达到了显著性差异水平,其中杯盘菌属为感病组重要影响成分,因为该菌为桑果菌核病致病菌属中的一类;Dothideomycetes已被证明具有组织偏好性[29],可能已经纤维化的病果不利其生长;Sordariomycetes在本研究中表现的组织偏好性,与前人研究不一致[30-31],可能和样本类别不同有关,研究中未被分类的菌还有待于进一步开发。
4 结 论
本研究利用高通量测序技术,获得了大量桑果内生真菌和细菌微生物群体信息,包括一些未被分类的菌群。通过比较分析,明确了健康桑果和感病桑果的内生菌群落构成及多样性,探讨了部分内生菌在健康桑果和感病桑果中的差异和作用,筛选出一些具有显著差异的Biomarker。研究结果可以为桑果微生物信息系统构建、菌核病拮抗菌株的筛选和利用提供数据支撑。
