硅纳米颗粒诱导小鼠间充质干细胞成骨分化和迁移的体外研究*
2021-11-05黎中雪周江玲彭威侯天勇
黎中雪 周江玲 彭威 侯天勇
优异的植骨材料是临床修复骨缺损的重要手段[1]。自体骨虽然成骨活性高,但患者需要遭受二次手术,失血更多,存在伤口感染的风险[2],而异体骨也具有疾病传播、免疫排斥和植入后再吸收的潜在风险[3],两者都面临来源有限的难题。因此,人工骨替代物已成为治疗骨缺损的重要策略,具有来源广泛、操作条件可控、无免疫原性等优点,临床对其需求量日益攀升。故对新型人工合成骨修复材料的研发和探究具有极其重大的意义。
人工骨替代物需满足以下两个条件:一是具有促成骨活性,以便骨组织新生和修复;二是具有足够的机械强度,以保持其植入后的结构稳定。硅基生物活性颗粒(Silicon-based bioactive particles,SBPs)是生物活性陶瓷和玻璃在实际应用中最重要的形式之一,因为它们便于压入骨缺损部位,同时易于与聚合物共混制备具有生物活性和一定机械强度的骨修复材料。以SiO2为基础的人工骨移植材料具有显著的生物活性,有研究表明该类材料能与骨良好结合并刺激新骨生长。SiO2成骨修复需要提升SiO2体外矿化能力,笔者将Ca (OH)2作为钙前体,将钙离子引入到二氧化硅的硅酸盐网络中,通过合成纳米尺寸的硅基生物活性颗粒来促进矿化。间充质干细胞(mesenchymal stem cells,MSCs)向成骨区域迁移和诱导分化成骨是骨修复过程的两个重要环节,为了检测新合成的纳米颗粒对成骨可能的影响,本研究通过与MSCs共培养来检测颗粒的成骨诱导作用和募集细胞迁移能力。
1 材料与方法
1.1 主要试剂与仪器
氨水、四乙氧基硅烷和Ca (OH)2(Aladdin 公司,中国);间充质干细胞培养基,成骨诱导培养基和小鼠骨髓来源的间充质干细胞(Cyagen 公司,中国);CCK-8 检测试剂盒(同仁,日本);氯仿(Sigma 公司,美国);DAPI 试剂(上海碧云天生物技术有限公司,中国);Trizol(北京康为生物科技有限公司,中国);DMEM/F12 培养基(Hyclone公司,美国);Transwell 小室(Corning Life Sciences,美国)。RT-PCR 合成及检测试剂(大连宝生物工程有限公司),引物由生工生物工程上海股份有限公司合成。扫描电镜(MultiSEM 505,ZEISS,德国);ZATA 电位分析仪(ZetaPALS,Brookhaven,美国);多功能酶标仪(MK3,Thermo 公司,美国):荧光显微镜(Ti-E,Nikon 公司,日本);荧光定量RT-PCR(CFX96,Bio-Rad 公司,美国)。
1.2 样品准备
二氧化硅颗粒制备:取215.7 mL 乙醇和20 mL 超纯水,搅拌均匀。然后加入3.7 mL 氨水和10.4 mL 四乙氧基硅烷(TEOS),于室温下搅拌反应10 h,1 000 rpm,15 min 离心,分别用乙醇和超纯水离心洗涤2 次后分散在超纯水中,制备成浓度为2.5 mg/mL 二氧化硅颗粒悬浮液备用。
SBPs 制备:在1mmol/L 的1.5mLCa (OH)2中加入2 mL上述二氧化硅颗粒悬浮液,室温下搅拌反应36 h,1 000 rpm,15 min 离心收集,超纯水洗涤3 次,然后分散在超纯水中,制备成浓度为30wt%活性硅颗粒溶液,密封保存备用。
条件培养配置:小鼠间充质干细胞培养基中SBPs 的浓度为0、0.5、1、2、4、8µg/mL,小鼠间充质干细胞成骨诱导培养基中SBPs 的浓度范围1、4、8、16、32、64µg/mL。
1.3 SBPs 的物理表征
SBPs 在扫描电镜下(SEM)的形态:取20 L 的30wt%SBPs 溶液滴在载玻片,置于50℃烘箱中烘干,得到干燥颗粒,环境扫描电镜于×10K 倍数下观察颗粒的形态。
SBPs 的粒径分布:30wt%SBPs 溶液稀释100 倍,超声处理5 min后,使用ZATA电位分析仪,测得颗粒的粒径分布。
1.4 SBPs 体外生物相容性
1.4.1 系列浓度SBPs 对MSCs 增殖的影响
取P6 的小鼠骨髓MSCs,调整细胞悬液浓度,96 孔细胞培养板每孔所含的细胞为3 000,37℃、5%CO2细胞培养箱过夜,待细胞贴壁后,除去原培养基,加入200 L 上述浓度的BP 小鼠间充质干细胞培养基;分别于1、3、5 d 后利用CCK-8 检测细胞浓度;多功能酶标仪450 nm 的波长检测每孔吸光度,OD值反映了细胞的增殖情况,每组重复3 次。
1.4.2 系列浓度SBPs 对MSCs 成骨分化的影响
按照上述步骤接种细胞至24 孔板中,分别在3、7 d 按照提取各组RNA,除去培养板中的培养基,每孔加入500 L的Trizol,多次吹打,转移到EP 管。加100 L 氯仿,充分震荡,室温静置5 min。4℃、12 000 rpm、离心15 min。吸取上层透明水相至无酶EP 管,加入同体积的异丙醇,混匀后室温静置20 min,4℃、14 000 rpm、15min。弃上清,加入1 mL 的75%乙醇重悬,12 000 rpm,离心5 min。弃上清,晾干除去乙醇,后加入30 微升Rnase-free dd H2O 重悬,-4℃保存。逆转录PCR(Reverse Transcription-Polymerase Chain Reaction RT-PCR)实时荧光定量PCR(Quantitative Real-time PCR Q-PCR)检测检测各组ALP、COLⅠ、OCN、OPN、OSX、RUNX2 相对表达量,引物设计如表1 所示。

表1 引物序列
1.4.3 系列浓度SBPs 对MSCs 迁移的影响
条件培养基的制备:取P6 的MSCs 接种至25 cm2培养瓶,细胞贴壁后,使用SBPs 浓度为0、1、4、8 µg/mL 成骨诱导培养基培养,3 d 后收集板内培养基;细胞的接种:取P6 的MSCs 用1%FBS 的DMEM/F12 培养基制备成浓度为3×105个/mL 的细胞悬液,取200 L 接种在Transwell 上室;下室加入条件培养基。染色:细胞培养箱中静置8 h 后,4%多聚甲醛固定40 min;PBS 清洗两次;棉签擦拭去除小室上层细胞;使用1 g/mL DAPI 室温下避光染色10 min;避光清洗两次;将小室放置在载玻片上,在荧光显微镜(×200)下,观察细胞的迁移情况。
按照实验1.4.2 细胞的接种以及RNA 的提取、Q-PCR和RT-PCR,检测MSCs 在4 g/mL SBPs 刺激下第7 d 基因SDF-1 和TGF-1 相对表达量。
1.5 统计学方法
采用Prism 8.0 软件处理数据,数据以平均值±标准差表示,统计学分析采用t 检验分析两组之间的差异,检验水平=0.05。
2 结果
2.1 SBPs 的物理表征
SBPs 的平均直径为134.3 nm,并且呈均匀分散球形颗粒,不会成团聚集,见图1、图2。

图1 SBPs 的溶液状态以及颗粒的微观形态:A.不同浓度SBPs 溶液的光学图像;B.SBPs 微观形态
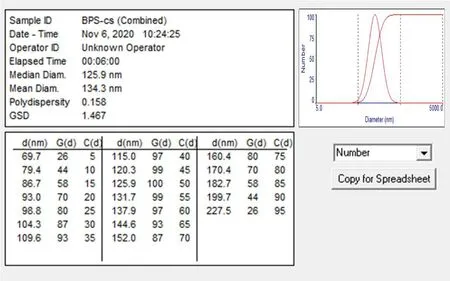
图2 SBPs 粒径分布
2.2 SBPs 体外生物相容性
2.2.1 不同浓度的SBPs 对MSCs 增殖的影响
不同浓度的SBPs 的增殖速度与对照组几乎无差别,说明SBPs 虽然对MSCs 的增殖无促进作用,但也无细胞毒性(见图3)。

图3 不同浓度的SBPs 对MSCs 增殖的影响
2.2.2 不同浓度的SBPs 对MSCs 成骨分化的影响
适宜浓度下SBPs 对MSCs 有明显的促成骨作用(见图4)。第3 d 时4µg/mL 的SBPs 对基因ALP有明显的促进作用,1µg/mL 和8µg/mL 对该基因无明显的促表达作用,在第7 d 后1、4、8µg/mL 均能显著促进ALP 的表达。不同浓度的SBPs 均能在第3 d 促进OPN 的表达,并且促进效果几乎相同,但在第7d,OPN 的表达量出现明显的差别,4µg/mL这组基因表达量为最大值,8µg/mL这组的基因表达量最低。第3 d 时,1µg/mL、4µg/mL均能促进OSX 的表达,8µg/mL与空白对照组之间无明显的统计学差异,说明8µg/mL 的SBPs 不能促进OSX 的表达;7 d 后,三组对OSX 的表达均有明显的促进作用,其中4µg/mL 和8µg/mL 这两组结果相似。诱导分化3 天,三种浓度的SBPs 刺激下,RUNX2 的表达量相似且高于空白组,7d 后,4µg/mL 的SBPs能显著促进该基因的表达,但在8µg/mL 的SBPs 刺激下,与3 d 的表达量无明显差别,且显著低于4µg/mL 的刺激组,成骨分化作用开始减弱。为了探究高浓度的SBPs 是否能诱导细胞成骨分化甚至出现抑制情况,笔者检测了MSCs 在浓度为16、32、64µg/mL 的SBPs 作用下,成骨相关基因的表达情况。从图5 可以看出在高浓度的SBPs 刺激下,MSCs 的成骨分化相关基因表达量都低于对照组,有明显的抑制作用,并且随着浓度的升高,抑制作用增强。

图4 低浓度SBPs 刺激MSCs 成骨相关基因的相对表达量:A.ALP;B.COLⅠ;C.OCN;D.OPN;E.RUNX2;F.OSX
2.2.3 不同浓度的SBPs 对MSCs 迁移的影响
MSCs 与4 g/mL 的SBPs 共培养产生的条件培养基诱导MSCs 迁移的数量最多(见图6)。进一步通过荧光显微镜对视野中荧光强度进行分析,其可定量反应迁移的细胞数量,与空白对照组比较,3 个浓度组均具有显著的统计学差异,其中4 g/mL 的SBPs 最显著(见图7,P<0.001)。因此笔者进一步检测了MSCs 在该浓度刺激下SDF-1 和TGF-1 的相对表达量,如图8 所示,经4 g/mL SBPs 刺激后的MSCs 表达的SDF-1 和TGF-1 显著多于对照组。
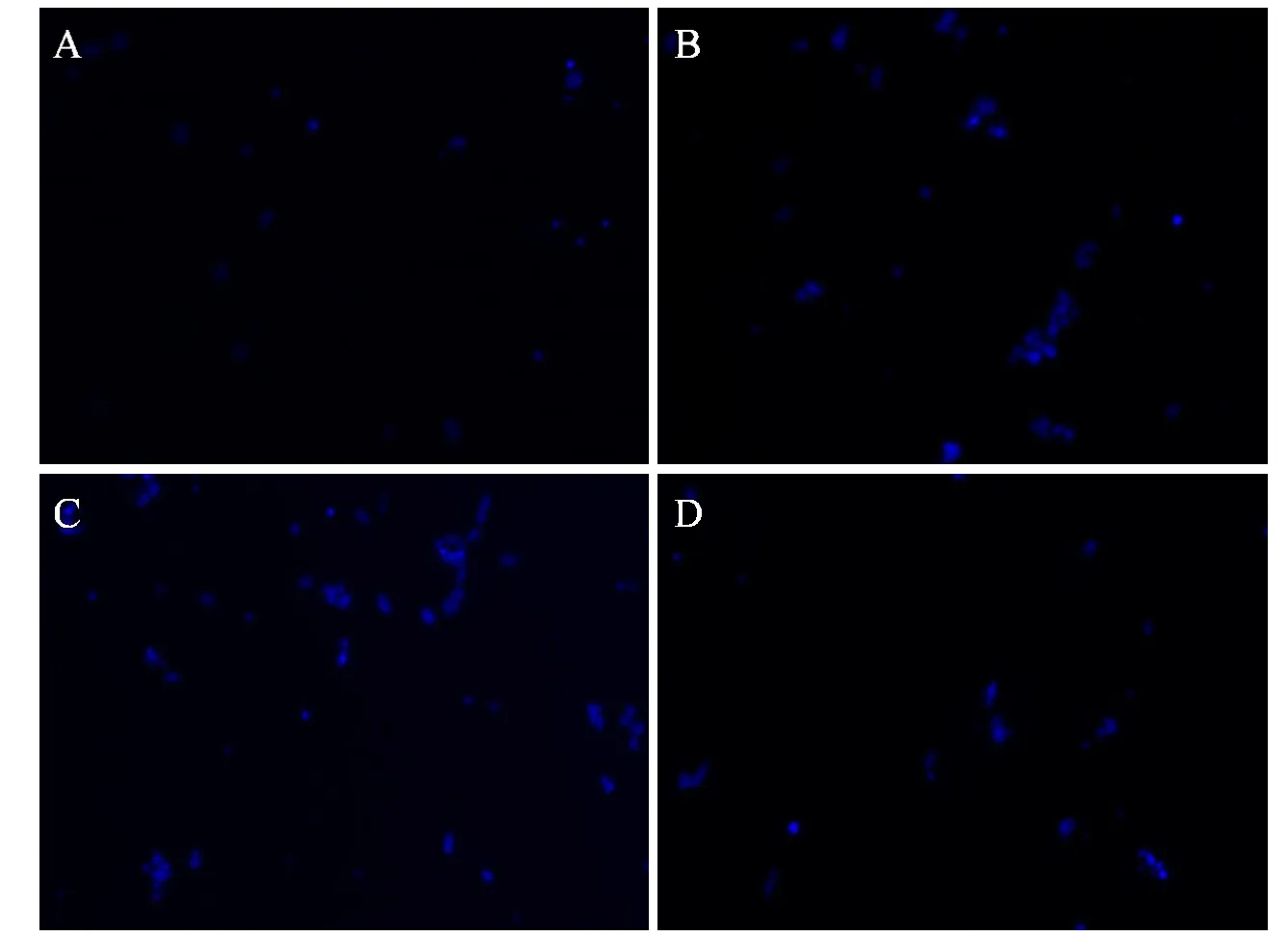
图6 不同浓度的SBPs 对MSCs 迁移的影响(×200):A.0 g/mL;B.1 g/mL;C.4 g/mL;D.8 g/mL

图7 不同浓度的SBPs 对MSCs 迁移的定量分析

图8 MSCs 在4 g/mL SBPs 刺激下第7 d 基因SDF-1 和TGF-1 相对表达量:A.SDF-1 相对表达量;B.TGF-1 表达量
3 讨论
人工骨替代物在制备时需要加入一定的化学试剂,可能会对接触的细胞和组织产生影响,因此,安全性是需要首先考虑的问题。合成材料对细胞的毒性体现在促进细胞死亡或是影响细胞增殖,笔者研究显示,不同浓度的SBPs 对共培养的MSCs 增殖速度的影响与空白对照组几乎无差别,提示SBPs 具有较好安全性。
二氧化硅材料在血管生成,药物输送[4]中得到一定应用。研究发现[5]硅酸盐生物陶瓷通过刺激内皮细胞与骨髓基质细胞的相互作用,能促进血管化和成骨。虽然二氧化硅具有内在的对抗核转录因子NF-B 激活的能力,对破骨细胞有明显的抑制作用,对成骨细胞有激活作用,能够改善骨的生化和力学性能[6],能够显著提高小鼠的骨密度。但是,单纯的二氧化硅纳米颗粒与模拟体液或类似物反应时,不会促进骨组织工程相关支架表面羟基磷灰石的形成。也就是说,单独使用二氧化硅作为骨组织工程支架材料时,不会促进种子细胞在支架内部形成羟基磷灰石,而羟基磷灰石作为骨组织重要的无机物成分,不能合成势必影响其成骨质量。研究表明,这可能是由于缺乏钙离子所致,因为羟基磷灰石是以钙离子为核心形成的微晶,微环境中钙离子的存在有利于细胞矿化[7]。而且研究还表明,随着硅离子的增加,骨髓间充质干细胞的总DNA 含量、磷-粘附斑激酶和总整合素水平均上升;硅离子通过激活MAPK/细胞外信号调节激酶(ERK)和p38 信号通路刺激细胞粘附,更有效地促进成骨[8]。此外,如果硅离子的生物活性纳米颗粒的尺寸越接近于天然骨的无机组分羟基磷灰石微晶尺寸(直径小于100 nm),成骨效果越显著[9]。因此,笔者将TEOS 作为硅前体,通过添加氢氧化钙,进而合成纳米尺径的生物活性颗粒——SBPs。这种颗粒既有硅离子存在,又存在骨组织矿化形成羟基磷灰石需要的钙离子,两种成分共同存在,同步降解,相互作用,更加稳定,可以避免许多传统复合材料的缺点,即复合材料在溶解过程中不同的吸收速率,这不可避免地导致体内物质的不稳定[10]。
体外的成骨诱导实验显示,SBPs具有优异的促成骨作用,并且发现对种子细胞的反应性存在临界值:4µg/mL 时,SBPs促成骨能力最强,随着浓度升高,成骨效果降低。MSCs 在浓度8µg/mL 的刺激下,成骨相关基因的表达量低于浓度1µg/mL。可能是因为Si 离子浓度过高,降低了细胞的活性[11],影响了细胞成骨分化能力;也可能是因为高浓度的硅离子会与成骨诱导培养基中的地塞米松结合,抑制了成骨补充剂在诱导培养基中的刺激作用从而影响了MSCs 成骨分化[12]。成骨诱导第三天,相较于其余两组浓度,在4 µg/mL 的浓度刺激下,成骨基因有明显的表达,这是因为硅以Si (OH)4的形式从材料中释放出来[13],在骨形成和钙化的早期阶段起着重要作用,已表明它可以刺激人成骨细胞产生I 型胶原[14]。有研究表明,硅酸可通过促进骨损伤部位SDF-1 和TGF-1 的释放[15],实验1.4.3 结果证明SBPs可以诱导MSCs产生SDF-1 和TGF-1,因此笔者推测当SBPs 植入体内时,可以在组织微环境中通过离子交换形成硅酸后募集宿主MSCs 至骨损伤部位,加速骨损伤的修复,其潜在的机制还有待进一步验证。
总之,本研究通过sol-gel 合成的纳米尺径的SBPs 无细胞毒性,在适宜浓度范围内(1~4 g/mL)具有促成骨和诱导MSCs 迁移作用。未来可以将其引入到天然高分子可降级材料中(如透明质酸壳聚糖、丝素蛋白、明胶和壳聚糖等)合成新型复合骨移植材料,一方面可以发挥促成骨作用,另一方面可以诱导细胞迁移,在高分子材料降解后的空间内重新形成骨组织,实现骨重建。
