Notch 信号通路调控骨肉瘤细胞增殖的机制研究*
2021-11-05李珂李京贺西京王爽郝丹丹朱峪
李珂 李京 贺西京 王爽 郝丹丹 朱峪
骨肉瘤是一种以增殖肿瘤细胞直接产生骨或骨样组织为特点的原发性恶性骨肿瘤,发病率为(4~5)/106。青少年时期是骨肉瘤的发病高峰期,约在15 岁左右,以原发性骨肉瘤为主[1]。骨肉瘤可以发生在任何骨中,最常见的部位为长骨干骺端,尤其是股骨远端和胫骨近端[2],手术治疗联合新辅助化疗是目前临床常用的治疗方法[3]。研究发现,Notch信号通路在多种肿瘤中均有异常表达,如胃癌、肝癌、乳腺癌等[4-6]。有研究表明,Notch 通路的过度活化在骨肉瘤中也存在,能够介导骨肉瘤的增殖和迁移侵袭能力[7-8]。DAPT是一种-分泌酶抑制剂,能够阻断Notch 信号通路的激活。本研究通过检测DAPT 对体外培养的人骨肉瘤143B 细胞和MG63 细胞以及体内异种移植瘤模型的影响,探究Notch 信号通路对143B 细胞和MG63 细胞增殖的调控作用,为骨肉瘤的治疗提供新的研究思路。
1 材料与方法
1.1 细胞株和主要试剂
人骨肉瘤细胞株143B 和MG63(中国科学院上海细胞研究所)。DMEM 培养基、胎牛血清(FBS)、青链霉素(P&S)(Gibco 公司,美国),PBS、胰蛋白酶购自Hyclone,-分泌酶抑制剂DAPT(Sigma 公司,美国),用二甲基亚砜(DMSO)溶解配制成50 mM 的储存液分装备用,使用时用DMEM 培养基稀释;Jagged1 活性肽(序列:CDYYYGFGCNKFCRPR,10 M,GenScript)以10 M 的最终浓度加入到培养液中;DMSO、4%多聚甲醛(PFA)、结晶紫溶液、Triton X-100、牛血清白蛋白(BSA)和BrdU(B5002,10 M)购自美国Sigma 公司;Cell Counting Kit-8(CCK-8)购自APExBIO。
1.2 方法
1.2.1 细胞培养
用含10%胎牛血清、1%青链霉素(P&S)的DMEM 培养液培养143B 细胞和MG63 细胞,置于37℃、5%CO2细胞培养箱中,每48 h 更换培养液1 次。用胰蛋白酶消化细胞,传代,取对数生长期的细胞用于后续试验。
1.2.2 CCK-8 法检测细胞增殖试验
取对数生长期的143B 细胞和MG63 细胞,制成1.5×104/mL的细胞悬液,每孔100 L 接种于96 孔板中,培养24 h 待其贴壁后,加入终浓度为0、5、10 和20 M 的DAPT,阳性对照组为含血清的细胞培养液,阴性对照组为不含血清的DMEM 培养基,每组设置6 个复孔,每2 天换液1 次。待任意一孔的细胞长满后弃去上清,加入100 L含10%CCK-8的培养液继续培养2~4 h,在酶标仪450 nm 波长下检测各孔的吸光度OD 值。
1.2.3 集落形成试验
取对数生长期的143B细胞和MG63 细胞制成细胞悬液,以每皿300 个细胞的浓度接种于6 cm 的培养皿中,阳性对照组为含血清的培养液,DAPT 组则加入终浓度为10 M 的DAPT。将细胞培养皿置于37℃、5%CO2细胞培养箱中培养1~2 周,当培养皿中出现肉眼可见的集落形成时,弃去上清液,用PBS 浸洗3 次,加入2mL 4%多聚甲醛固定15min,然后弃去固定液,加1 mL 结晶紫溶液染色15 min,最后用流水缓慢洗去染液,空气干燥。
1.2.4 BrdU 掺入法检测细胞增殖
将143B 细胞和MG63 细胞分别接种在含有细胞爬片的24 孔板里,阳性对照组仅加入细胞培养液,DAPT 组加入终浓度为10 M 的DAPT,Jagged1 组加入终浓度为10 M的Jagged1 活性肽。培养48 h 后,在各组中加入10 M BrdU,置于37℃孵育4 h,然后弃去上清,用4%PFA 固定,随后在2 mol/L 的HCl 与1 mol/L Na2B4O7中孵育。用PBS 洗涤后,将细胞与小鼠抗BrdU 抗体在室温下孵育4 h,然后与山羊抗小鼠的二抗和DAPI 在室温下孵育1 h,最后在荧光显微镜下观察细胞。
1.2.5 裸鼠成瘤试验
实验所采用的6 只4 周龄BABL/C 雄性裸鼠由西安交通大学医学部实验动物中心提供,操作均于SPF 实验动物房完成,且所有操作均遵守西安交通大学动物实验委员会章程。实验前将裸鼠随机分为两组:对照组和DAPT 组,每组3 只。将对数生长期的MG63 细胞以2.5×107/mL 的浓度重悬于PBS 中,每只裸鼠注射100 L 细胞悬液于右侧后肢外侧皮下,随后每隔一天对裸鼠腹腔注射1 次DAPT(DAPT组,10 mg/kg,用5%DMSO 稀释)或等体积的5%的DMSO(对照组,用PBS 稀释),每周检测异种移植肿瘤的大小。注射4 周后处死裸鼠,取出皮下肿瘤进行测量和拍照,并将肿瘤标本进行切片及染色。
1.2.6 肿瘤组织染色
将取下来的肿瘤组织石蜡包埋后连续切片,在60℃的恒温烤箱烤片30min 后进行染色。使用二甲苯脱蜡2 次10min,然后用无水乙醇洗去二甲苯2 次5 min。用95%和80%的乙醇各清洗10 min,自来水清洗1 min,蒸馏水洗1 min。然后进行苏木素染色4 min,随即用自来水清洗2 min。用1%盐酸酒精分化20 s,自来水洗2min,用1%稀氨水返蓝30s,自来水清洗2 min。然后进行伊红染色90 s,接着用80%和95%乙醇各脱水10s,无水乙醇脱水5min,二甲苯透明20min,封片。Ki67 染色则在切片脱蜡后加热20 min,过氧化物酶阻断,洗脱,然后孵育Ki67 一抗20 min,洗脱后用二抗孵育20 min,然后用DAB 显色,苏木素复染5 min,洗脱酒精处理后,用二甲苯透明,最后封片。
1.3 统计学方法
采用SPSS 22.0 软件进行统计学数据分析。计量资料采用均数±标准差表示,组间检验采用t 检验、2检验和单因素方差分析比较。P<0.05 为差异有统计学意义。
2 结果
2.1 DAPT 对143B 细胞和MG63 细胞增殖的影响
分别使用0、5、10 和20 M 的DAPT 作用于143B 细胞和MG63 细胞,48 h 后使用CCK-8 法检测这两种骨肉瘤细胞的增殖情况。CCK-8 结果显示DAPT能够明显抑制143B细胞和MG63 细胞的增殖,且呈浓度依赖性,浓度越大,抑制增殖能力越强,但10 M 的DAPT 与20 M 的DAPT 对143B 细胞的增殖抑制能力无明显差异。不同浓度对于143B细胞和MG63 细胞的增殖抑制情况见图1。根据CCK-8 结果,笔者选择10 M 的DAPT 进行集落形成试验,结果显示与阳性对照组相比,DAPT 能够明显抑制143B 细胞和MG63 细胞集落的形成。集落形成情况见图2。

图1 不同浓度DAPT 处理的CCK-8 结果:A.143B 细胞增殖情况;B.MG63 细胞增殖情况
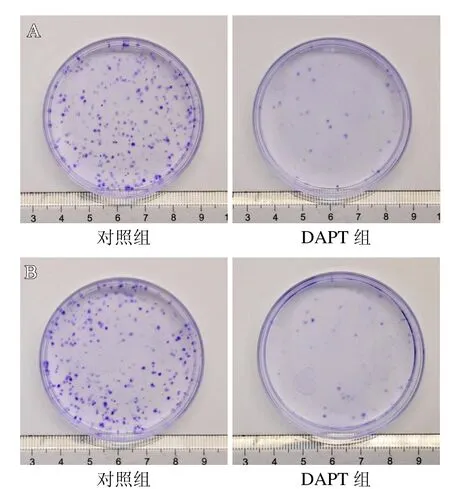
图2 对照组与DAPT 组集落形成对比:A.143B 细胞;B.MG63 细胞
2.2 调控Notch信号通路对143B细胞和MG63 细胞增殖的影响
Jagged1 是一种Notch 通路的激动剂,笔者分别在143B细胞和MG63 细胞培养液中加入10 M的Jagged1 活性肽观察其对这两种细胞增殖的影响。通过BrdU 染色法检测,结果显示各组中BrdU 阳性细胞数量:Jagged1 组>对照组>DAPT 组,差异具有统计学意义(P<0.05)。说明Jagged1 通过激活Notch信号通路促进143B细胞和MG63 细胞的增殖,而DAPT 则通过抑制Notch 信号通路而抑制143B 细胞和MG63 细胞的增殖。BrdU 染色情况如图3 所示。
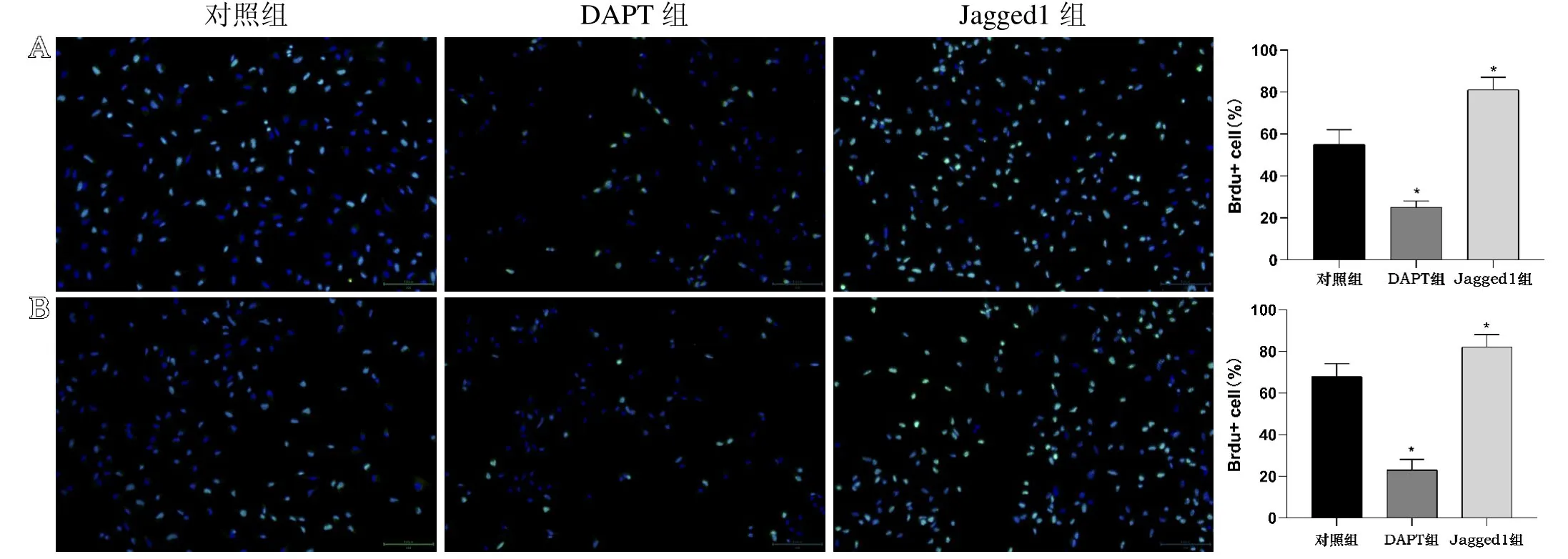
图3 不同组间BrdU 染色结果(×200):A.143B 细胞;B.MG63 细胞
2.3 DAPT 对裸鼠骨肉瘤体内生长的影响
为了探究DAPT 对体内骨肉瘤生长的影响,笔者使用MG63 细胞进行裸鼠成瘤试验,并通过腹腔注射DAPT 观察肿瘤的大小情况。如图4 所示,DAPT 组肿瘤大小明显小于对照组,而HE 染色结果显示对照组的细胞核数量明显多于DAPT 组,且肿瘤组织结构更加紧密,血管分布更加丰富。反观DAPT 组,细胞核数量少且肿瘤组织结构疏松,中间有腔隙形成。Ki67 染色结果中对照组的阳性率明显高于DAPT 组。从上述实验结果可以得出,DAPT 在体内能够明显抑制骨肉瘤的生长,破坏骨肉瘤的内部组织结构。
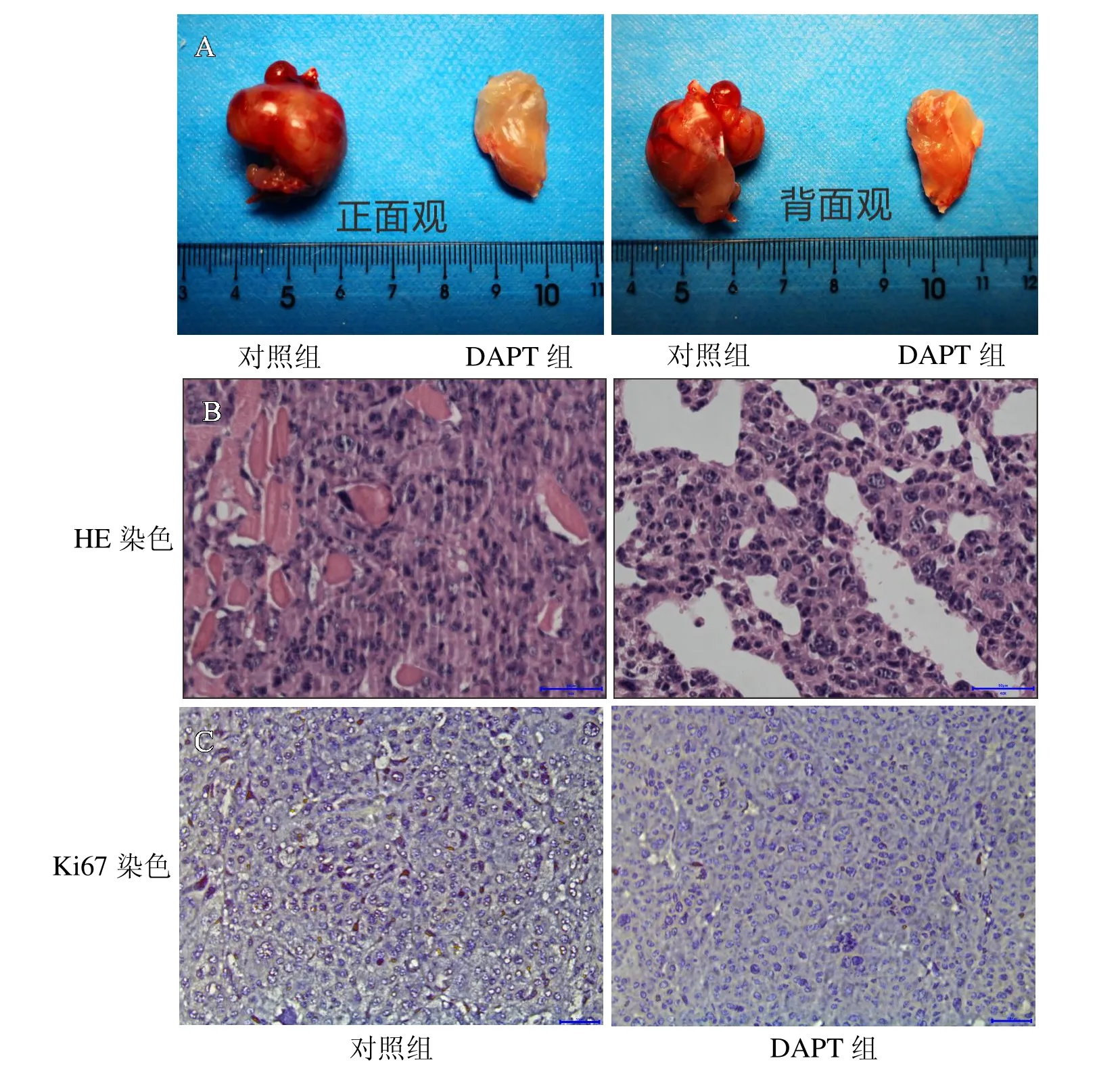
图4 A.裸鼠成瘤情况;B.肿瘤组织切片HE 染色结果(×400);C.肿瘤组织切片Ki67 染色结果(×400)
3 讨论
Notch受体是一种控制细胞间通信和组织形态发生的跨膜蛋白家族,其包含Notch1、Notch2、Notch3 和Notch4 等4 种受体,并且具有相似的结构,包括N 端的胞外结构域、跨膜结构域和C 端的Notch 胞内结构域。Notch 通路有5 种配体:Jagged1 和Jagged2,Delta1、Delta3 和Delta4,通过配体和跨膜受体的结合激活通路,导致跨膜Notch 受体的蛋白水解酶裂解,使得Notch 细胞内结构域(NICD)从膜上释放出来转移到细胞核中[9-10]。NICD 在细胞核中与转录因子RBP-JK 相互作用,从而诱导靶基因的表达。
正因为Notch信号通路在不同生理过程中保持稳态才能保证生物体内微环境的正常运转,一旦Notch 信号发生改变,可能会导致不同的病理状态或疾病发生[11-12]。人类癌症中Notch 通路的病理改变大多发生在Notch1 基因中,目前已有研究报道,在一些肿瘤(如肺癌、肝癌、骨肉瘤及结肠癌)中Notch1 的表达量均有显著升高,也有研究表示活化的Notch1 能够促进骨肉瘤的增殖和迁移侵袭能力[13-15]。
DAPT 是一种-分泌酶抑制剂,能够阻断Notch 信号通路的活化,而Jagged1 作为一种Notch 通路激动剂,能够激活Notch 信号通路。本实验通过添加不同浓度梯度的DAPT于体外培养的143B 细胞和MG63 细胞中,采用CCK-8 实验检测Notch通路抑制对这两种人骨肉瘤细胞的增殖能力的影响,结果表明DAPT 能够通过抑制Notch 信号通路显著抑制143B 和MG63 细胞的增殖,且和浓度呈正相关,但10 M 的DAPT 与20 M 的DAPT 对143B 细胞的增殖、抑制能力无明显差异。为了验证DAPT 抑制骨肉瘤细胞增殖的结果,笔者又采用肿瘤集落形成试验进行验证,通过在DAPT 组添加中等剂量10 M 的DAPT 来与对照组比较,结果显示DAPT 能够显著抑制肿瘤集落的形成。随后笔者通过BrdU染色法检测DAPT和Jagged1 对两种骨肉瘤细胞增殖能力的影响,BrdU 是胸腺嘧啶的衍生物,可以标记活细胞中新合成的DNA,代替胸腺嘧啶特异性的整合到复制细胞新合成的DNA 中。结果显示DAPT 组的BrdU 阳性细胞明显少于对照组和Jagged1 组,而Jagged1 组的阳性细胞数明显多于对照组,说明Notch 信号通路能够调控人骨肉瘤143B 和MG63 细胞的增殖,且与增殖呈正相关。
为了给临床研究提供更加可靠的治疗建议,笔者利用裸鼠建立人骨肉瘤的异种移植瘤模型,并通过腹腔注射DAPT来验证Notch 通路在体内对骨肉瘤的调控作用。通过观察骨肉瘤成瘤的结果,DAPT 组相比对照组能够显著抑制肿瘤大小,且对肿瘤组织的Ki67 染色结果表明对照组的阳性率明显高于DAPT 组,说明Notch 通路同样在体内能够调控骨肉瘤的增殖和生长,抑制Notch 通路能够明显抑制骨肉瘤的生长。另外,为了观察肿瘤内部的组织学变化,笔者又对肿瘤标本进行了HE 染色,结果显示对照组的肿瘤内部细胞核的数量明显多于DAPT 组,而且组织内部更加紧密,血管数量也明显多于DAPT 组,说明DAPT 在体内抑制了骨肉瘤的恶性行为。
综上所述,本文通过体内体外实验,使用-分泌酶抑制剂DAPT 和Notch 通路激动剂Jagged1 对143B 和MG63 两种骨肉瘤细胞系进行干预,探究Notch 通路对这两种骨肉瘤细胞增殖的调控作用。结果表明,Notch 通路参与143B 和MG63 细胞的增殖和成瘤行为,且通过抑制Notch 通路能够抑制人骨肉瘤的恶性行为,为骨肉瘤的临床治疗提供了重要参考。
