传染性单核细胞增多症患儿miRNA-146a 和IRF-3 的表达及临床意义
2021-11-04朱亮华庄丽丽
朱亮华,庄丽丽,金 蕊
(南京医科大学第一附属医院儿科,江苏南京 210029)
EB 病毒(Epstein-Barr virus,EBV)广泛感染,全世界约95%的人在某个阶段都会感染,感染后通常无明显症状,若累及单核巨噬细胞,可导致传染性单核细胞增多症(infectious mononucleosis,IM)。有文献指出,约有50%感染EB 病毒的儿童可发展为IM[1]。干扰素调节因子3(interferon regulatory factor 3,IRF-3)属于IRF 家族成员之一,是负责对Ⅰ型干扰素(interferon,IFN)信号传导的转录因子,可参与细胞的应激反应,包括抗病毒,DNA损伤和死亡受体信号等[2]。2020 年新型冠状病毒肺炎诊治指南推荐IFN-α 作为抗病毒药物之一。微小mRNA(miRNA)是一类长约22 个核苷酸的非编码RNA,通过调节mRNA 转录及转录后水平,在炎性反应、自身免疫病和肿瘤中发挥重要的作用[3]。IM患儿外周血单核细胞中IRF-3 及miRNA 的表达水平是否改变,miRNA 是否参与调控传单病人中IRF-3 及IFN-α/β 尚不清楚。因此,本研究通过RTPCR 实验检测IM 患儿外周血单核细胞中IRF-3 和miRNA-146a 的表达水平,过表达及干扰miRNA-146a 后检测IRF-3 RNA 和蛋白表达水平变化,为进一步探讨miRNA-146a 参与EB 病毒调控IM 患儿IRF-3基因表达的机制提供依据。
1 资料与方法
1.1 临床资料
选 取2017 年1 月~2018 年12 月 在 南 京 医 科 大学第一附属医院(江苏省人民医院)儿科住院的45例IM 患儿作为研究对象,患儿符合《诸福棠实用儿科学》第八版中IM 的诊断标准[4],年龄1~13 岁,平均(5.76±3.05)岁,男性25 例,女性20 例。选取同期门诊健康体检的34 例儿童作为对照组,年龄2~12 岁,平均(6.03±2.69)岁,男性18 例,女性16 例。两组儿童年龄(t=0.415,P=0.339)和性别比例(χ2=4.000,P=0.261)差异无统计学意义,有可比性。
所有资料来自于南京医科大学第一附属医院(江苏省人民医院),儿童监护人均签署书面知情同意书。本研究得到南京医科大学第一附属医院(江苏省人民医院)机构研究伦理委员会的批准。
1.2 材料
HeLa 细胞系由儿科实验室保存;Dulbecco’s Modified Eagle Medium(DMEM)(Gibco,苏州);胎牛血清(BI,以色列);青霉素-链霉素双抗(碧云天,上海);PBS 缓冲液(森贝佳,南京);Dimethyl Sulfoxide(DMSO)(Amresco,美国);胰蛋白酶(碧云天,上海)。TRIZOL(Invitrogen,美国);异丙醇(南试,南京);无水乙醇(南试,南京);DEPC 水(碧云天,上海);氯仿(南试,南京);逆转录试剂盒(Takara,上海);甲醇(南试,南京);BCA 蛋白浓度试剂盒(碧云天,上海);SDS-PAGE 凝胶试剂盒(碧云天,上海);蛋白Maker(Thermo,美国);LipofectamineTM3000(Invitrogen,美国);ECL 发光液(Thermo Sciemtific,美国);辣根过氧化物酶(HRP)标记的二抗、抗IRF-3 抗 体(Sant cruz 公 司,美 国),miRNA-146a mimic,miRNA-146a inhibitor 及 对 照(锐 博 公 司,广州)。
1.3 方法
1.3.1 细胞复苏 从液氮中将冻存的HeLa 细胞取出后,将其置入37 ℃水浴锅中摇晃至充分溶解,加入4 mL 完全培养基至10 mL 离心管中,将上步中的细胞混悬液轻轻打入离心管,1 000 r/min 离心3 min。取出离心管,弃去上清液,加入1 mL DMEM完全培养基,轻轻吹打10 下,置于含7 mL 完全培养基的10 cm 培养皿中,轻轻呈米字型摇晃培养皿,使细胞均匀生长,然后将培养皿置于37 ℃5% CO2培养箱中。
1.3.2 细胞传代 室温预热PBS、完全培养基和胰酶,取出待传代的细胞(细胞密度约为85%~90%),弃 上 清,用3 mL PBS 洗 涤 细 胞2 次,加入2 mL 胰酶,放置培养箱中消化3 min 后,轻轻拍打培养皿侧壁。随后,在显微镜下对细胞进行观察其是否消化完全,若完全消化则加入4 mL 完全培养基进行终止胰酶消化,将液体转移至另一根离心管中,1 000 r/min 离心3 min 后,弃上清后加入3 mL完全培养基,轻轻吹打10 下充分混均匀,然后按比例转移至培养皿中,放入培养箱中培养。
1.3.3 细胞转染 根据LipofectamineTM3000 使用说明书进行转染。将Hela 细胞接种到12 孔板中(1.5×105/孔),待细胞增长至60%~70%时进行转染。每次转染3 个复孔。
1.3.4 制备模板cDNA 分别收集两组儿童外周血2 mL,加入2 mL Ficoll,室温下500×g离心20 min,小心吸取第二层环状乳白色环状淋巴细胞层,依次按步骤加入氯仿、异丙醇、乙醇、DEPC 水,用分光光度计(onedrop)检测RNA OD 260/280 值并记录,按照Takara 公司说明书,逆转录成cDNA,-20 ℃保存待用。
1.3.5 引物设计与合成 根据GenBank中IRF-3和miRNA-146a基因序列设计RT-PCR引物。GAPDH和U6为内参,由上海英骏生物有限公司合成;IRF-3上游引物:GTCGATCAAAAAGAAAGCCCCAGCG,下游引物:CATCCTGCCGTAGGCCGTGCTTCC。GAPDH上游引物:AGGTCGGAGTCAACGGAT ,下游引物:TCCTGGAAGATGGTGATG。miRNA-146a 上游引物:ACACTCCAGCTGGGCCTCTGAAATTCAGTT,下游引物:TGGTGTCGTGGAGTCG。U6上游引物:CTCGCTTCGGCAGCACA,下游引物:AACGCTTCACGAATTTGCGT。
1.3.6 RT-PCR 反应 根据Biomake 制造商说明书,配置反应体系如下:试剂名称:2x SYBR green qPCR master mix,使 用 量:5 μ L;上 游 引 物(10 μ mol/L),使用量0.4 μL;下游引物(10 μmol/L),使用量:0.4 μL;ddH2O,使用量:3.2 μ L;cDNA,使用量:1 μL。
用LightCycler480Π 仪器将上述体系进行扩增,扩 增 程 序 为:95 ℃5 min;95 ℃15 s,55 ℃30 s,72 ℃30 s,共40 个循环;95 ℃15 s,60 ℃60 s,95 ℃15 s;将GAPDH或U6基因用作标准化标准,确认溶解曲线和扩增曲线,并通过比较CT 法计算相对表达水平。
1.3.7 蛋白免疫印迹 将6 孔板的HeLa 细胞用PBS 洗涤一次,取500 μL 胰酶消化,加入1.5 mL 完全培养基终止消化,离心弃上清液,并加入250 μL蛋白裂解液;将细胞裂解混合物置于涡旋仪上涡旋10 s 后冰浴10 min,重复3 次,以12 000 r/min 离心10 min,上清液即细胞总蛋白。蛋白样品浓度检测根据BCA 试剂盒说明书操作。配制10%分离胶,5%浓缩胶,依次进行上样、电泳、转膜、封闭、一抗4 °C 过夜孵育、洗膜、二抗室温孵育1 h、洗膜、显影。
1.4 统计学处理
实验数据使用统计学软件GraphPad Prism 7 和SPSS 22.0 进行统计分析处理。数据表示为平均值±标准误差(±SEM),并且至少重复3 个独立的实验。两组性别比较采用卡方检验,组间比较采用LSD-t检验进行处理,相关性分析采用Pearson 相关分析。P<0.05 视为差异有统计学意义。
2 结果
2.1 两组儿童外周血中IRF-3 和miRNA-146a 表达水平的比较
Real-time PCR 检测IM 患儿中IRF-3 mRNA的表达较健康对照组表达下降了61%(t=30.340,P<0.001),见表1。 IM 患儿外周血miRNA-146a的表达较健康对照组增加了1.63 倍(t=34.659,P<0.001),见表1。
表1 两组IRF-3 及miRNA-146a 表达水平(±SEM)Tab 1 Expression levels of IRF-3 and miRNA-146a in two groups (±SEM)

表1 两组IRF-3 及miRNA-146a 表达水平(±SEM)Tab 1 Expression levels of IRF-3 and miRNA-146a in two groups (±SEM)
组别例数IRF-3 表达水平miRNA-146a 表达水平健康对照组IM 患儿组34 45 t P 1.07±0.11 0.42±0.08 30.340<0.001 1.05±0.11 2.76±0.27 34.659<0.001
2.2 IRF-3 和miRNA-146a 表达水平的相关性分析
IM 患儿外周血中IRF-3 和miRNA-146a 的表达水平呈负相关(r=-0.960,P<0.05),见图1。
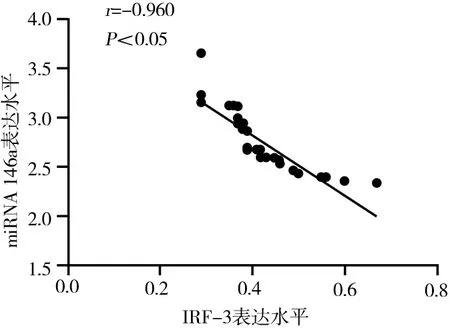
图1 IRF-3 和miRNA-146a 表达水平的相关性Fig 1 Correlation between the expression levels of IRF-3 and miRNA-146a
2.3 过表达miRNA-146a 及其抑制剂对IRF-3 mRNA 水平的影响
分别转染miRNA-146a mimic(75 nmol/L)及其 抑 制 剂miRNA-146a inhibitor(150 nmol/L)在HeLa 细胞中,使用Real-time PCR 检测IRF-3 mRNA。与对照组(mimic control)相比,miRNA-146a mimic 组IRF-3 mRNA 的表达明显降低(t=8.270,P<0.001),见表2。 而miRNA-146a 抑制剂组IRF-3 mRNA 的表达较对照组(inhibitor control)明显升高(t=8.582,P<0.001),见表3。
表2 miRNA-146a 过表达对IRF-3 mRNA 表达的影响(±SEM )Tab 2 Effect of overexpression of miRNA-146a on IRF-3 mRNA expression(±SEM)
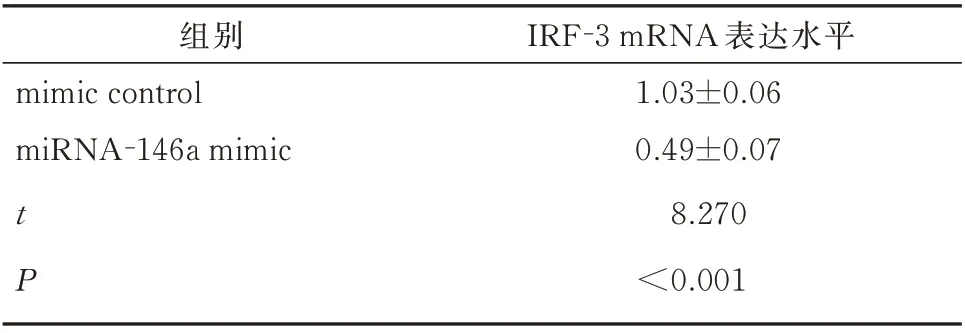
表2 miRNA-146a 过表达对IRF-3 mRNA 表达的影响(±SEM )Tab 2 Effect of overexpression of miRNA-146a on IRF-3 mRNA expression(±SEM)
组别mimic control miRNA-146a mimic t P IRF-3 mRNA 表达水平1.03±0.06 0.49±0.07 8.270<0.001
表3 miRNA-146a 抑制剂对IRF-3 mRNA 表达的影响(±SEM)Tab 3 Effect of miRNA-146a inhibitor on IRF-3 mRNA expression (±SEM)

表3 miRNA-146a 抑制剂对IRF-3 mRNA 表达的影响(±SEM)Tab 3 Effect of miRNA-146a inhibitor on IRF-3 mRNA expression (±SEM)
组别inhibitor control miRNA-146a inhibitor t P IRF-3 mRNA 表达水平1.01±0.05 1.52±0.07 8.582<0.001
2.4 过表达miRNA-146a 及其抑制剂对IRF-3 蛋白水平的影响
分别转染miRNA-146a mimic(75 nmol/L)及其 抑 制 剂miRNA-146a inhibitor(150 nmol/L)在HeLa 细胞内,通过Western blot 法对IRF-3 蛋白表达水平进行检测,结果表明miRNA-146a mimic 组(0.72±0.01)较对照组(1.22±0.02)IRF-3 的表达明 显 下 调(t=46.170,P<0.001),见 图2A。而miRNA-146a inhibitor 组(1.48±0.02)较 对 照 组(0.89±0.01)IRF-3 蛋 白 的 表 达 明 显 上 调(t=25.891,P<0.001),见图2B。
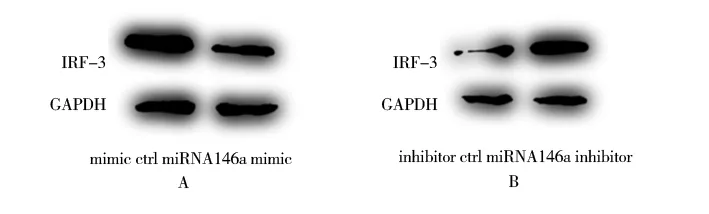
图2 miRNA-146a 过表达(A)及抑制剂(B)对IRF-3 蛋白表达的影响Fig 2 Effect of miRNA-146a overexpression(A)and inhibitor(B)on IRF-3 protein expression
3 讨论
传染性单核细胞增多症(infectious mononucleosis,IM)是一种自限性疾病,以喉咙痛、颈淋巴结肿大、疲劳和发热为临床特征,但可合并肺炎、心肌炎、血小板减少、中性粒细胞减少等并发症,部分患者可能表现为慢性活动性EBV(CAEBV)。CAEBV 的患者通常表现出在IM 期间出现的体征,如发热、淋巴结病、脾肿大和肝炎,并且血液中EBV DNA 的水平显著升高。较不常见的是,患者也可能出现EBV 相关的噬血细胞综合征或EBV 相关的噬血细胞淋巴组织细胞增生症(HLH),该病3 年生存率仅为60%[5]。固有免疫反应对于维持免疫稳态和消灭入侵病原体至关重要,这涉及多种信号通路调节和翻译后修饰。IRF3 可诱导IFN-I 产生,对于先天性抗病毒反应至关重要。2019 年末开始肆虐全球的新型冠状病毒(2019-nCoV)肺炎,重症患者可快速进展为急性呼吸窘迫综合征(ARDS)、脓毒性休克、顽固性代谢性酸中毒和难以控制的出凝血功能障碍,多版本国家临床诊治指南均将IFN-α 作为新冠肺炎抗病毒治疗药物之一。有文献报道[6],重组人干扰素α1b 辅助阿昔洛韦治疗可以有效改善IM 患儿免疫功能,降低机体炎症反应,减轻心肌损伤。微小RNAs(miRNAs)是一种约22 bp 的非编码RNA,它具有内源性的单链进化保守序列,通常作为一种内源性的基因表达抑制剂,通过抑制mRNA 的降解和翻译,在许多生物学过程中发挥多种功能,包括自身免疫反应、信号传导、炎症等。EB病毒感染致IM 患儿体内IRF-3 及miRNA 的表达水平及其相关性如何,miRNA 是否参与调控EB 病毒感染病人中IRF-3 及IFN-α/β 尚不清楚。
本研究通过检测IM 患儿和健康对照儿童外周血中miRNA-146a 的表达水平,结果表明两组存在明 显 差 异,这 与Ning[7],Hatton 等[8],Boosani 和Agrawal[9]的 研 究 结 果 相 同,EB 病 毒 诱 导 成 人 机 体产生miRNA21、23、24、27、34、146a、155。实验组患儿外周血中检测的IRF-3 表达水平低于健康儿童。相关性分析显示,miRNA-146a 与IRF-3 表达呈显著负相关关系,这表明EB 病毒越高,IRF-3 水平则越低,反之则越高,两者相互影响,参与疾病的进展。通过体外实验证明,在HeLa 细胞中,过表达miRNA-146a 及其抑制剂对IRF-3 mRNA 水平有影响,检测到IRF-3mRNA 及蛋白水平均有显著降低和升高。证实在EB 病毒下调IM 患儿IRF-3基因的表达过程中,miRNA-146a 可能发挥重要作用并参与IM 的发病。EB 病毒潜伏膜蛋白1(latent membrane protein 1,Lmp1),可 通 过NF-κB 途 径 导 致miRNA-155 表达提高,同时还能与其靶向结合,导致免疫信号通路中IKKε、SHIP1、MyD88 等因子出现异常表达,这表明EB 病毒具有调控人体miRNA表达,进而破坏人体免疫功能的作用[10-13]。miRNA-146 家 族 包 括miRNA-146a 和miRNA-146b,上 述2个成员靶基因基本相同,主要定位于人体5 号染色体与10 号染色体中,但两者在3,末端核苷酸存在一定区别[14]。大量研究表明,miRNA-146a 与人体免疫应答存在明显关系,其不仅能通过作用于TLRs,如TLR2、TLR4、TLR5/MyD88/NF- κB 通 路 和RIG-I 通 路 中 的 主 要 因 子 的TRAF6、IRAK-1 和IRAK-2,对人体免疫起到负向调控的作用[15-17],还具有通过miRNA-146a 抑制转录因子活化蛋白1 活性,从而降低人体白细胞介素2 的表达,起到抑制T淋巴细胞的增生的作用;此外还可通过抑制Fas 表达,起到阻止结构域蛋白的合成,让T 淋巴细胞发生活化,最终诱导细胞死亡[18]。miRNA-146a 在人体免疫功能中起到了举足轻重的作用,其在人体发生免疫性疾病或是肿瘤疾病中作用也被证实。有研究表明,系统性红斑狼疮(SLE)患者外周血单核细胞中miRNA-146a 表达下调,引起外周血单核细胞中Ⅰ型干扰素(IFN)表达下降,同时miRNA-146a表达水平与SLE 疾病活动指数评分及IFN 评分呈负相关,这表明miRNA-146a 能靶向作用于IRF-5,从而起到让TRAF6 和IRAK1 直接抑制Ⅰ型IFN 调控通路,达到相应的靶向作用。所以,我们推测miRNA-146a 有 望 成 为SLE 患 者 治 疗 的 新 靶 点[19]。其它研究指出,甲状腺癌患者中miRNA-146a 表达上调,乳腺癌中高表达的miRNA-146a 可负向调控TRAF6、IRAK1、NF-κB 等,这进一步证实miRNA-146a 可作为治疗部分肿瘤疾病的新靶点[20]。还有,在丙型肝炎中当miRNA-122 表达上调时,可起到防止HCV-RNA 降解的作用;服用miRNA-122 抑制药物的患者,其miravirsen 在治疗后能有效地降低HCV-RNA 的表达水平,同时患者耐药性较低,表明miRNA 靶向治疗EB 病毒相关疾病有显著成效[21,22]。EB 病毒不仅在儿童IM 疾病中起到重要作用,同时在鼻咽癌[23]、淋巴瘤[24,25]等肿瘤疾病的发病中扮演重要角色,而IRF 具有抑制EB 病毒于肿瘤的作用,且两者呈现负相关关系,这为后续临床研究病毒相关疾病的治疗提供帮助。
综上所述,鉴于miRNA-146a 与IRF-3 表达呈负相关性,后续重点研究miRNA 能否成为EB 病毒相关肿瘤疗效评价指标,以及进一步探讨EB 病毒相关肿瘤病人中miRNA-146a 对IRF-3 基因的调控及其机制,为将来miRNA 靶向治疗EB 病毒相关疾病提供帮助。
作者贡献度说明:
朱亮华:负责临床标本收集,细胞实验,撰写文稿;庄丽丽:负责统计学分析;金蕊:负责总体实验设计,数据分析。
