活血化瘀利水方对急性踝关节损伤炎症大鼠P65、TAK1 的影响
2021-11-04刘绪银廖怀章
王 康,蒋 勇,刘绪银,廖怀章,卢 敏,曾 凡
(1. 湖南中医药大学,湖南 长沙 410208;2. 邵阳正大骨伤科医院,湖南 邵阳 422900;3. 湖南中医药大学第一附属医院,湖南长沙 410007)
踝关节损伤是最常见的肌肉骨骼疾病[1],踝关节韧带的牵拉或撕裂是急性踝关节损伤的特征,踝关节外侧韧带扭伤是最常见的踝关节损伤类型[2-4]。一项荟萃分析[5]显示外侧韧带的损伤发生率为0.93/1 000。大约50%的患急性踝关节损伤者无视该病,在短时间恢复活动,导致其复发率高,最终发展成为慢性踝关节不稳[6]。活血化瘀利水方是邵阳正大骨伤科医院临床经验名方,在活血化瘀止痛的基础上予以利水消肿,临床治疗急性踝关节损伤具有良好的疗效,能减轻局部的炎症[7-9]。为探讨活血化瘀利水方治疗急性踝关节损伤的作用机制,本文研究了活血化瘀利水方对急性软组织损伤大鼠模型血清NF-κB P65、TAK1 的影响,现报道如下。
1 材料与方法
1.1 材料
1.1.1 实验动物 实验动物采用SD 雄性大鼠48只,体质量180~220 g,SPF 级,均由湖南中医药大学实验动物中心统一代购,动物供应商编码GYS-202009070001。实验中对动物处置符合科技部《关于善待实验动物的指导性意见》的规定,实验伦理审核批号:LLBH-201909260001。
1.1.2 实验用药 实验组药物为活血化瘀利水方煎液,药物组成包括当归尾15 g、白茅根15 g、川芎12 g、丹皮12 g、赤芍12 g、红花10 g、茯苓12 g、三七3 g、泽兰12 g、水蛭7 g、地龙9 g、生地黄12 g 、木通6 g、土鳖虫10 g、甘草6 g。由湖南中医药大学第一附属医院中药房代煎。采用旋转蒸发仪将药液浓缩至1.03、2.06、4.12 g/mL 3 个浓度。
阳性对照组药物为舒筋活血胶囊,购自湖南安邦制药有限公司,国药准字号:Z20090575。加无菌蒸馏水配置成浓度0.2 g/mL 混合液,4℃保存。
1.1.3 实验仪器及试剂 自制软组织打击器;10%的水合氯醛;旋转蒸发仪;摇床(中国江苏其林贝TS-1);台式冷冻离心机(中国湖南湘仪H1650R);电泳仪(中国北京六一DYY-6C);电泳槽(中国北京六一DYCZ-24DN);转膜仪(中国北京六一DYCZ-40D);旋涡混合器(中国江苏其林贝尔GL-88B);磁力搅拌器(中国雷磁JB-13)普通冰箱(中国奥克斯BCD-196A);电磁炉(荷兰飞利浦HD4925)精密PH计(中国雷磁PHS-3C);电子天平(美国双杰JJ224BC);生物样品均质仪(中国杭州奥盛Bio-Prep-24);荧光定量RCP 仪(美国Thermo PIKOREAL96)荧光PCR 板(美国Thermo SPL0960);电泳仪(中国北京六一DYY-2C);水平琼脂糖电泳槽(中国北京六一DYCP-31DN);-80℃冰箱(中国美菱DW-HW438)。
1.2 方法
1.2.1 分组及药物干预 48 只SD 雄性大鼠经适应性喂养1 周后,随机分为空白对照组(A 组),模型对照组(B 组)、舒筋活血胶囊水溶液(C 组)、活血化瘀利水方低剂量组(D 组)、活血化瘀利水方中剂量组(E 组)、活血化瘀利水方高剂量组(F 组)。造模成功后,各组大鼠第2 天开始按1.5 mL/100 g 灌胃给药,活血化瘀利水方低、中、高剂量组分别按15.5、31.0、62.0 g/kg 给予活血化瘀利水方低、中、高剂量煎液(分别为标准剂量的1、2、4 倍),其中空白对照组、模型组灌胃蒸馏水3 mL,1 d 1 次,连续1 周。
1.2.2 动物造模 参考孙燕等[10]造模方法,采用重锤坠落法造模,将大鼠的右踝用脱毛膏脱毛后固定在木板上,将0.2 kg 重砝码从45 cm 高处通过塑料管砸在大鼠右踝同一部位,连续打击3 次,打击面积为π×1.5 cm²,造出打击局部出现散在出血点,打击处肿胀,皮下瘀斑但无皮肤破损;用手触摸右下肢无骨折及脱位征;无其它异常情况发生者确定为造模成功。
1.2.3 实验取材 连续给药干预7 d 后取标本,10%的水合氯醛腹腔注射麻醉(0.3 mL/100 g)。取踝关节外侧软组织,剥离,切除,生理盐水冲洗,取部分组织块泡于10%多聚甲醛中用于HE 染色,部分组织转移至-80℃冰箱暂存。
1.2.4 HE 染色 60℃恒温2 h 烤片。切片多次浸入二甲苯及不同浓度系列乙醇后脱蜡,蒸馏水冲洗。苏木素染液及伊红染液中染色。切片经无水乙醇系列脱水,二甲苯透明后,树胶封片。光镜镜检,采集分析图像。
1.2.5 蛋白免疫印迹法测定大鼠踝关节软组织P65、TAK1 表达水平 取0.025 g 已保存的组织标本,使用冰预冷PBS 清洗,在生物样品均质仪中加入300 μL RIPA 裂解液,两者混合后充分研磨组织直至无法肉眼看见较大组织块。冰上裂解10 min。温度4℃,转速12 000 r/min 的离心机中离心15 min。使用1.5 mL 的离心管保存离心后的上清液。
加入TEMED 后立即摇匀,灌入配置好的10%分离胶。灌胶后,使用异丙醇对其进行封胶。当微微倾斜制胶器分界线不再变化时说明条件已经达到。再等待3~5 min 后,倒去胶上层的异丙醇,并使用滤纸将其尽可能吸干。再次加入TEMED 后摇匀,灌入4.8%的浓缩胶。将梳子插入玻璃板中,浓缩胶将剩余空间灌满,等待胶凝固即可。
取240 μL 蛋白上清,加入60 μL 5×loading buffer 混匀,沸水煮5 min,放入冰盒中速冷备用。
第一孔点入marker 2 μL,其它每孔上样10 μL已变性蛋白。开始电泳,电泳恒定电压76 V,时间为2.5 h。待溴酚蓝电泳至胶底部时终止电泳。
分别切胶TAK1(75 kD),P65(64 kD),β-actin(42 kD)。准备6 张与胶相同面积大小的滤纸和1张NC 膜,NC 膜与滤纸同时完全浸透到转膜缓冲液中。按照最上层3 张滤纸,NC 膜,胶,另3 张滤纸在下的顺序依次放好,严格要求每一层间隔之间没有气泡。盖上仪器,接通电源,转膜300 mA 恒定电流,P65 约85 min,TAK1 约95 min,β-actin 约60 min。转膜完成后,将其放入1×PBST 中洗1 次。
将膜浸入1×PBST 配制5%的脱脂奶粉中,在室温环境中存放90 min 后,再换入4℃的环境过夜,次日再放于室温30 min。
用1×PBST 稀释HRP 标记的二抗,将稀释后的二抗与膜共同室温孵育90 min;孵育结束,1×PBST 洗3 次,每 次10 min。使 用ECL 化 学 发 光 液显色曝光。用1×PBST(注:CST 的抗体需要用5%BSA 的1×PBST 稀释)将一抗按照一定比例稀释,将膜与一抗一起孵育,室温放置90 min 。孵育结束,1×PBST 洗3 次,每次15 min。
1.2.6 实时荧光定量PCR 法检测大鼠踝关节软组织P65、TAK1表达水平 在121℃温度下湿热灭菌20 min 的三蒸水中1 L 加入1 mL 的DEPC,立即摇匀,过夜后成为0.1%DEPC 水。准备器械。剪取0.02 g 组织,用遇冷的PBS 洗一次,加1 mL Trizol于1.5 mL 离心管中,生物匀质仪匀浆,室裂解5 min;加入200 μL 三氯甲烷,剧烈振荡15 s 使之充分混合后,在室温的环境中静置3 min;设置离心机速度为12 000 r/min,在4℃的温度下,离心15 min。使用RNase-Free 离心管将其上层液保存;在装有上层液的离心管内加入与之相同体积的异丙醇,充分混合均匀,室温环境下静置10 min;设置离心机速度12 000 r/min,在4℃环境下,离心10 min,去除上清液后,加入1 mL 75%乙醇(无菌DEPC 处理水配制)洗涤离心管内沉淀;再次设置12 000 r/min,4℃温度,离心3 min,再次去除上清液;将离心管在空气干燥5~10 min 后。在管内加入20~30 μL 无菌无酶水,使管内沉淀溶解;紫外分光光度计测定浓度,RNA 浓度(ng/μL)=A260×稀释倍数×40,结果在100~200 ng/μL,RNA 纯度=OD260/OD280,结果在1.8~2.0 之间表明RNA 纯度良好。
使 用0.30 g 琼 脂 糖 以 及30 mL 的1×TAE 加热至琼脂糖溶解,室温冷却至60℃,在容器内加入0.5 μL 核酸染料,充分混合后倒胶,使其配制成为1%琼脂糖凝胶;取5 μL 已经提取完成的RNA,使用6×loading buffer 与其5∶1 的比列混匀,在140 V恒压下进行电泳,溴酚蓝前沿迁移至凝胶总长2/5处停止电泳;凝胶成像系统下观察。条带由上至下依次为28、18、5 s。以组织总mRNA 为模板,逆转录cDNA。引物信息见表1。
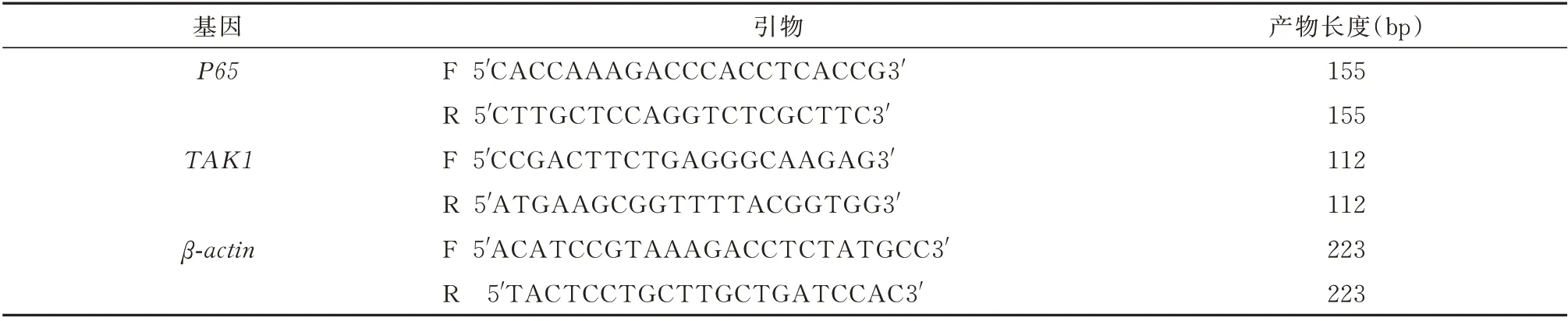
表1 引物序列Tab 1 Primer sequence
1.3 统计学处理
2 结果
2.1 组织病理变化情况
大鼠局部踝关节软组织标本HE 染色结果如图1 所示,空白组(图1A)大鼠软组织结构清晰,肌细胞分解明显,未见充血、炎症细胞浸润。服药7 d 后模型组(图1B)大鼠软组织肌细胞萎缩、点状坏死,炎细胞浸润,纤维组织增生较前增多。阳性组(图1C)肌细胞萎缩、点状坏死,炎细胞灶性浸润,纤维组织增生,伴出血。活血化瘀利水方低剂量组(图1D)肌细胞萎缩,炎细胞灶性浸润,纤维组织增生。活血化瘀利水方中剂量组(图1E)肌细胞萎缩,纤维组织增生。活血化瘀利水方高剂量组(图1F)炎细胞灶性浸润,纤维组织增生。活血化瘀利水方中剂量组肌细胞萎缩,纤维组织增生。
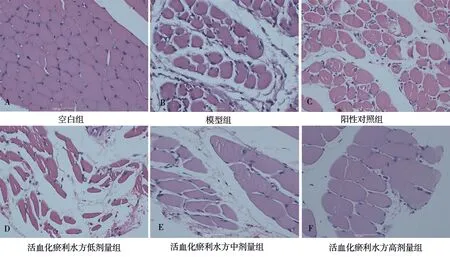
图1 大鼠的踝关节周围软组织HE 染色(400×)Fig 1 HE staining of soft tissue around the ankle joint in rats(400×)
2.2 Western blotting 对大鼠踝关节软组织P65、TAK1 蛋白表达的影响。
造模后1 天,模型组、阳性药物组及低、中、高剂量活血化瘀利水方的P65、TAK1 蛋白与空白对照组的差异有统计学意义(P<0.05)。用药7 d 后,与模型组相比,舒筋活络胶囊组及低、中、高剂量活血化瘀利水方组服药后P65、TAK1 蛋白均降低,差异有统计学意义(P<0.05)。活血化瘀利水方中、高剂量组与舒筋活血胶囊组差异有统计学差异(P<0.05)(表2,图2、3)。

图2 造模后1 d 大鼠踝关节软组织P65、TAK1 蛋白表达Fig 2 Expression of P65 and TAK1 protein in the soft tissues of the ankle joint of rats one day after modeling
表2 各组大鼠踝关节造模后1 天踝关节软组织中P65、TAK1 蛋白的比较(n=8,±s)Tab 2 Comparison of P65 and TAK1 proteins in the soft tissues of the ankle joint(n=8,±s)
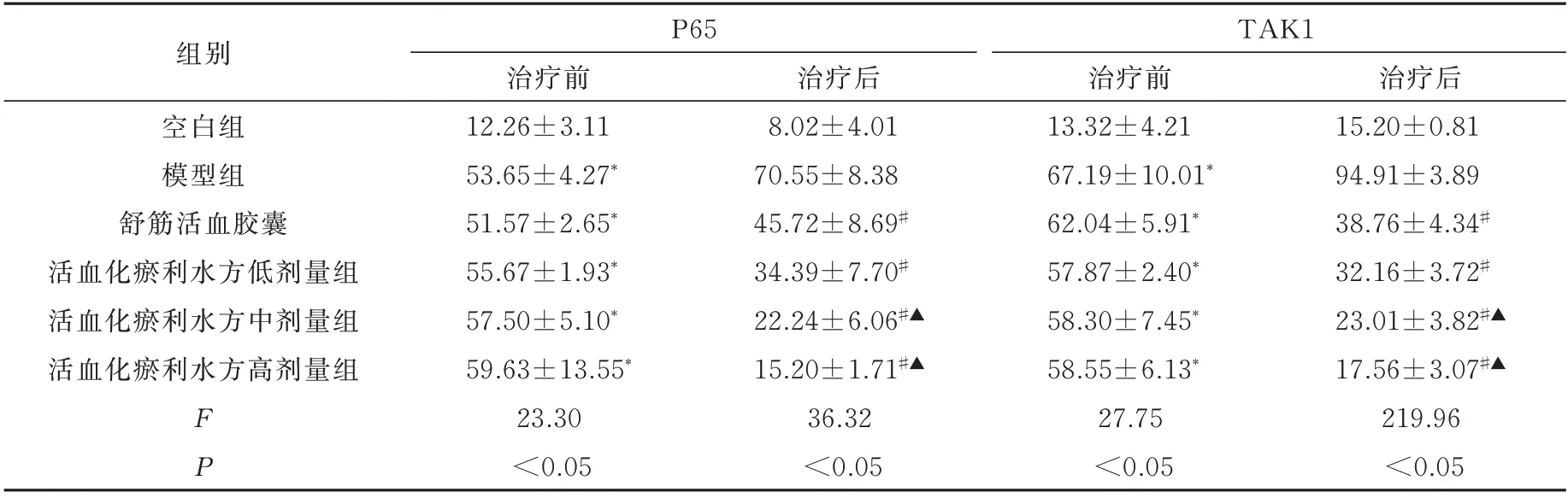
表2 各组大鼠踝关节造模后1 天踝关节软组织中P65、TAK1 蛋白的比较(n=8,±s)Tab 2 Comparison of P65 and TAK1 proteins in the soft tissues of the ankle joint(n=8,±s)
注:与空白组对比,*P<0.05;与模型组对比,#P<0.05;与舒筋活血胶囊组比较,▲P<0.05。
组别空白组模型组舒筋活血胶囊活血化瘀利水方低剂量组活血化瘀利水方中剂量组活血化瘀利水方高剂量组P65 TAK1治疗后15.20±0.81 94.91±3.89 38.76±4.34#32.16±3.72#23.01±3.82#▲17.56±3.07#▲219.96<0.05 FP治疗前12.26±3.11 53.65±4.27*51.57±2.65*55.67±1.93*57.50±5.10*59.63±13.55*23.30<0.05治疗后8.02±4.01 70.55±8.38 45.72±8.69#34.39±7.70#22.24±6.06#▲15.20±1.71#▲36.32<0.05治疗前13.32±4.21 67.19±10.01*62.04±5.91*57.87±2.40*58.30±7.45*58.55±6.13*27.75<0.05
2.3 荧光定量PCR 对大鼠踝关节软组织P65、TAK1 mRNA 表达的影响
造模后1 d,模型组、阳性药物组及低、中、高剂量活血化瘀利水方的P65、TAK1mRNA 与空白对照组的差异有统计学意义(P<0.05)。用药7 d 后,与模型组相比,舒筋活络胶囊组及低、中、高剂量活血化瘀利水方组服药后P65、TAK1mRNA 的表达均降低,差异有统计学意义(P<0.05)。活血化瘀利水方中、高剂量组与舒筋活血胶囊组有统计学差异(P<0.05),结 果 与Western blotting 蛋 白 表 达 一致(表3)。
表3 各组大鼠踝关节踝关节软组织中P65、TAK1 mRNA 的比较(n=8,±s)Tab 3 Comparison of P65 and TAK1 mRNA in the soft tissues of the ankle joint of rats in each group(n=8,±s)
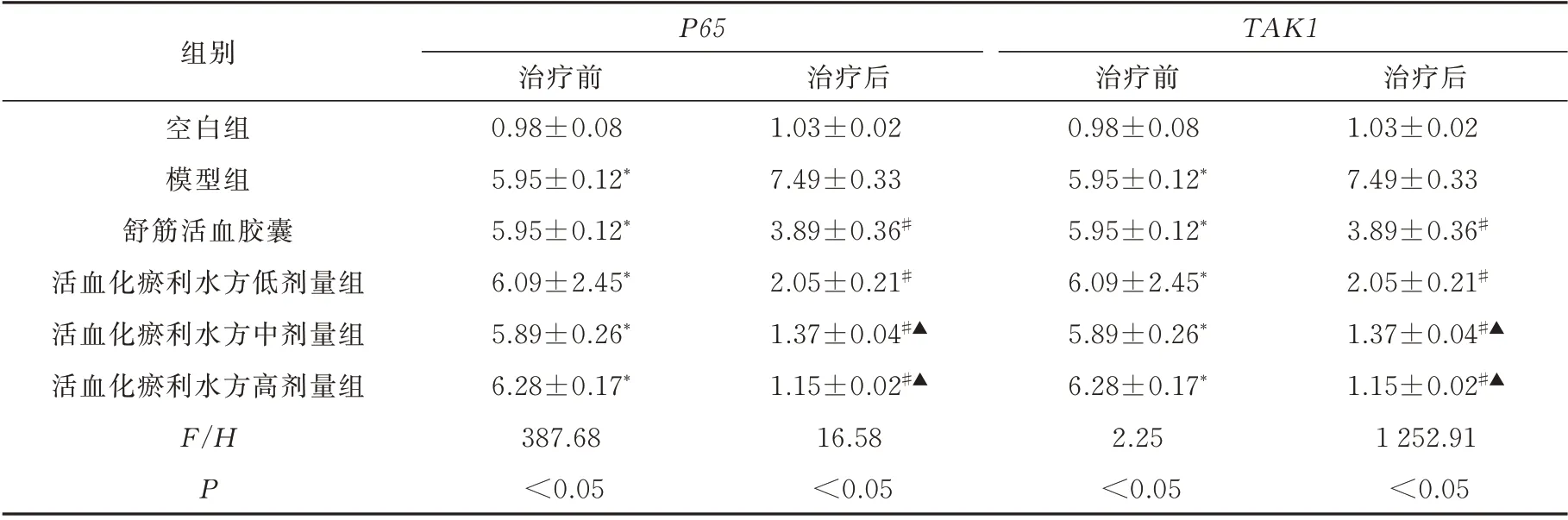
表3 各组大鼠踝关节踝关节软组织中P65、TAK1 mRNA 的比较(n=8,±s)Tab 3 Comparison of P65 and TAK1 mRNA in the soft tissues of the ankle joint of rats in each group(n=8,±s)
注:与空白组对比,*P<0.05;与模型组对比,#P<0.05;与舒筋活血胶囊组比较,▲P<0.05。
组别P65 TAK1空白组模型组舒筋活血胶囊活血化瘀利水方低剂量组活血化瘀利水方中剂量组活血化瘀利水方高剂量组F/H P治疗后1.03±0.02 7.49±0.33 3.89±0.36#2.05±0.21#1.37±0.04#▲1.15±0.02#▲1 252.91<0.05治疗前0.98±0.08 5.95±0.12*5.95±0.12*6.09±2.45*5.89±0.26*6.28±0.17*387.68<0.05治疗后1.03±0.02 7.49±0.33 3.89±0.36#2.05±0.21#1.37±0.04#▲1.15±0.02#▲16.58<0.05治疗前0.98±0.08 5.95±0.12*5.95±0.12*6.09±2.45*5.89±0.26*6.28±0.17*2.25<0.05
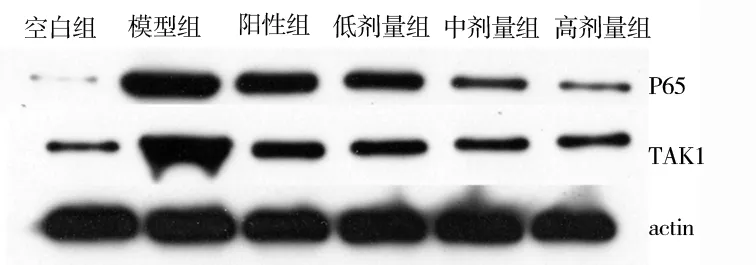
图3 服药7 d 后大鼠踝关节软组织P65、TAK1 蛋白表达Fig 3 P65 and TAK1 protein expression in soft tissue of rat ankle joint 7 days after administration
3 讨论
活血化瘀利水方在临床有显著的疗效[11-13],中医认为,急性踝关节损伤早期的局部肿胀的病理机制主要是瘀水互结,既有瘀血,又有水肿,故在临床治疗中以活血化瘀为基础,加以利水、利尿药物,疗效十分显著,临床常用药物包括当归尾、白茅根、川芎、丹皮、赤芍、红花、茯苓、三七、泽兰、水蛭、地龙、生地黄、木通、土鳖虫[14,15]。在当归尾、川芎、丹皮、赤芍、红花、三七、水蛭、地龙、土鳖虫活血化瘀的基础上,予以白茅根、泽兰、木通、茯苓利水消肿,同时予以生地养阴,刚柔相济,动静有序。
中医临床将急性踝关节损伤诊断为“筋伤”,临床辩证论治认为其多为“气滞血瘀证”,病因主要由于猝然跌扑、碰撞、扭伤所致,中医病机理论为气滞血瘀,淤血阻络,不通则痛,故而局部疼痛[16]。《血证论》云“凡跌打未破皮者,其血坏损,伤其肌肉则肿痛…,凡是疼痛皆瘀血凝滞之故也”。骨骼损伤能影响周围筋肉肌肤,肌肉肌肤损伤亦能影响骨关节结构,治疗中可以遵循“筋骨肉并重”这一重要的骨伤治疗原则[17]。许多学者对此也开展了广泛的研究,如研究该证型与微循环障碍的相关性,与血液流变学改变的异同性,与炎症反应是否存在类似的病理改变等,此外同样在凝血-纤溶系统、血管内皮功能等方面也有相关研究[18]。
现代医学认为炎症反应是一种复杂的保护性生物反应[19]。当有害物质刺激机体组织时,炎症反应就会应激性表达,这是一个重要的病理过程。在炎症反应时,利用现代医学检测技术对血液或者相关组织进行检测,能够观察炎性指标的异常。研究发现炎症反应与中医的气滞血瘀证型也密切相关[20],如气滞血瘀证出现的局部红肿、疼痛、偶有发热等症状与局部炎症出现的症状基本一致;病理过程中炎症反应可能会诱导血栓形成、血管损伤、淤血、流变学改变等多种病理反应,与气滞血瘀证的病理表现十分相似;发病原因也有相同之处。有研究在临床中通过对血瘀证患者的生化指标检测发现,与炎症相关的一些因子均在疾病前、后表现出差异[21,22]。
急性踝关节损伤后,局部毛细血管通透性增高甚至导致出血、细胞内液渗出,致使局部肿胀、疼痛,或有青紫瘀斑等症状。数小时后IL-1β、TNF-α等炎性介质释放,随即刺激神经末稍,从而产生疼痛。炎症是宿主对感染和组织损伤的一种保护性反应,其特征是一系列反应,包括免疫细胞和血浆蛋白在感染或组织损伤部位的血管扩张和补充[23]。NF-κB 信号通路作为调节炎症反应的关键通路,在细胞的生长、凋亡等病理、生理过程中的作用是巨大的[24]。NF-κB 二聚体通过与NF-κB 抑制剂结合在一起而处于失活状态,在静息状态下,NF-κB 蛋白在细胞胞质中保持稳定,在局部炎症及其他应激反应下,NF-κB 抑制剂被磷酸化[25]。解除了抑制剂对NF-κB 信号通路的抑制,进而导致NF-κB 蛋白的释 放 以 及 活 化[26]。TAK1 作 为NF-κB 信 号 通 路 关键的上游因子,能够被转化生长因子-β、Toll 样受体等多种因素激活[27]。TAK1 可以激活IKK 复合物,促进IκB 的磷酸化和降解,使NF-κB 蛋白游离、活化入核,诱导IL-1 等炎性细胞因子的表达[28,29]。愈渊等[30]通过动物实验,证明中药复方大黄仙灵方可以治疗胆管结石,改善其慢性炎症状态,通过检测,该方可以降低NF-κB 通路中某些蛋白表达,其中包括TAK1 蛋白。吉加釵等[31]通过小鼠动物实验,发现环指蛋白4 可以减轻心肌梗死后局部的炎症发应,通过检测,环指蛋白4 也同时降低了TAK1 蛋白的表达。赖莉等[32]通过细胞实验研究黄芪多糖对视网膜神经节细胞的炎症反应中发现,黄芪多糖在改善视网膜神经节细胞炎症的同时也降低了TAK1蛋白的水平。本次研究发现局部软组织中的TAK1的水平降低,提示TAK1 可能作为上游因子激活某一信号通路来控制炎症反应,以达到改善局部炎症,最终治疗踝关节损伤。NF-κB 家族在静息的情况下通常是以二聚体的形式存在,在其多种多样的二聚体当中,以P50/P65 这种二聚体形式最常见,相对于其它形式的二聚体,总量也是最多[33]。当一定特殊的病理条件及因子激活通路导致IκB 磷酸化后,则会引起这些二聚体的继发反应。由于P50 亚基 本 身 拥 有 核 定 位 信 号,IκB 在 降 解 后,P50 连 同P65 移入细胞核内。P65 在进入细胞核内后发挥着它的作用,识别并结合特定的DNA,对靶基因转录有调控作用[34,35]。李建设等[36]通过对大鼠胶质细胞的研究,发现姜黄素能够降低一氧化氮合酶、白介素-1β、TNF-α 等 炎 症 因 子 表 达 的 同 时,对NF-κB P65 的表达也有影响。且这些因子在同一阶段的表达趋势相同。本次研究发现局部软组织中的P65 蛋白的水平降低,提示P65 可能作为下游因子参与反应从而达到控制炎症反应,以达到改善局部炎症,最终治疗踝关节损伤。
综上所述,本研究发现在急性踝关节损伤大鼠中,TAK1/NF-κB P65 信 号 通 路 激 活 提 示TAK1/NF-κB P65 信号通路参与了踝关节损伤病程的发展,同时,活血化瘀利水方对于TAK1、NF-κB P65蛋白有一定的干预作用,提示活血化瘀利水方可能通过干预NF-κB 信号通路来治疗踝关节损伤。这为中医药治疗急性踝关节损伤在分子机制上提供了思路。
本次研究存在一定的局限性:(1)研究中各组的样本量少,样本量少会对实验结果产生偏倚[37];(2)本文中所研究的蛋白是NF-κB 通路中具有代表性的蛋白,但是由于所研究的蛋白数量少,不能完整的体现活血化瘀利水方治疗急性踝关节损伤的作用机制与NF-κB 通路的关系;(3)本次研究以实验室指标为主,缺少对局部症状以及中医证候的研究。在未来的研究中,课题组继续以活血化瘀利水方为基础,充分研究其在分子水平上的作用机制,并且扩大样本量,减少因样本数所带来的结果偏倚,在实验室指标的基础上,增加对于体征症候的观察,增加结果的稳定性。
作者贡献度说明:
王康、曾凡、蒋勇:参与动物实验,指标检测,撰写论文;廖怀章:实验指导,实验负责人;刘绪银、卢敏:论文指导。
