NPFFR1基因对鹅卵泡颗粒细胞激素分泌和细胞凋亡的影响研究
2021-11-04张克山高广亮赵献芝王启贵
张克山,高广亮,李 琴,赵献芝,李 静,王启贵*
(1.重庆市畜牧科学院,重庆 402460; 2. 重庆市肉鹅遗传改良工程技术研究中心,重庆 402460)
鹅的低繁殖力是养鹅业产业化发展的关键制约因素,如何提高鹅的产蛋数是当前鹅遗传育种的主要任务,鹅的产蛋数直接受成熟卵泡数量影响。鹅卵泡发育是一个逐级发育过程,在这个过程中绝大多数会因细胞凋亡而闭锁,仅少数被选择优势化而成熟排卵,其中激素是最重要的维持因子之一[1-3]。促性腺激素抑制激素(gonadotropin-inhibitory hormone,GnIH)是下丘脑神经肽的一种,也是目前发现的唯一一种对卵巢发育起抑制作用的神经肽[4-5],通过结合G蛋白偶联受体NPFFR1在下丘脑-垂体-卵巢轴或卵巢水平直接参与调控性行为、发情周期、雌激素循环和卵泡发育等繁殖相关进程[6-10]。家禽的卵泡成熟存在着周期节律程序,周期节律调控分子又与激素分泌、细胞增殖凋亡存在分子偶联[11-13]。Kim等[14]研究发现,促性腺激素抑制激素抑制颗粒细胞Fas/FasL表达水平,促进P53表示,抑制细胞凋亡。Sen和Hoffmann[15]研究了核心周期调控基因Clock、Bmal1和Per等在激素释放和生殖轴靶组织激素敏感性中的作用,证实下丘脑(视交叉上核、kisspeptin和GnRH神经元)、垂体(促性腺激素)、卵巢(卵泡膜和颗粒细胞)、睾丸(leydig细胞)以及子宫(子宫内膜和子宫肌层)的激素释放与靶组织的激素敏感性受到周期节律基因调控。Kelleher等[16]研究发现,核心昼夜节律基因调控细胞周期基因(c-Myc、Wee1、cyclinD和p21)的表达。Angelopoulou等[17]研究发现,小鼠下丘脑中的GnIH同源类似物NPFF通过NPFFR1受体及其典型信号通路(Gi/o蛋白和G蛋白偶联的内向整流钾通道)抑制GnRH神经元的兴奋性,参与昼夜节律、季节性繁殖和社会行为调控。
总之,卵泡的发育是一个由激素及其受体、细胞增殖分化及凋亡、周期节律等互作调控的过程,本试验研究NPFFR1在等级前卵泡颗粒细胞过表达对卵泡颗粒细胞激素分泌和细胞凋亡的影响,并通过转录组测序筛选与卵泡发育相关的重要差异表达基因,揭示其内在的基因互作网络。
1 材料与方法
1.1 试验材料
取9只健康产蛋期42周龄四川白鹅进行屠宰,按直径大小采集等级前小白卵泡(2~4 mm, small white follicle, SWF)、大白卵泡(4~6 mm, large white follicle, LWF)、小黄卵泡(6~8 mm, small yellow follicle, SYF)、大黄卵泡(8~10 mm, large yellow follicle, LYF)和F5~F1等级卵泡,划破卵泡释放卵泡液或卵黄,PBS缓冲液轻轻漂洗卵泡,直至分离颗粒细胞层,立即置于液氮中速冻后转放入-80 ℃冰箱保存、备用,以进行组织总RNA抽提。
1.2 主要试剂
RNA提取试剂盒购自Qiagen公司(73404,德国);Q5热启动超保真DNA聚合酶(M0494S,美国))和平末端/TA 连接酶预混液(M0367S,美国) 购自NEB公司;限制性内切酶EcoR I、Hind Ⅲ、pMD19-T Simple 和DNA Marker DL2000均购自宝生物(大连)工程有限公司;DNA片段凝胶回收试剂盒和质粒快速抽提纯化试剂盒购购自Omega(美国)公司;GnIH激素购自 phoenix pharmaceuticals公司;反转录试剂Promega GoScriptTM Reverse Transcription System (A5001,美国)和荧光定量试剂GoTaq®qPCR Master Mix(A6001,美国)均购自Promega公司;DMEM/F12培养基、LipofectamineTM3000 Transfection Reagent、胎牛血清、胶原酶均购自ThermoFisher Scientific公司;一步法TUNEL检测试剂盒购自广州锐博生物科技有限公司。TOP10感受态细胞和pcDNA3.1(+)质粒由重庆市畜牧科学院家禽研究所分子实验室保存。
1.3 NPFFR1在四川白鹅各级卵泡颗粒细胞中 RT-qPCR分析
根据NCBI上发表的鹅NPFFR1基因序列(登录号:XM_013172544.1),用Primer primer5.0设计引物,引物序列见表1;按“1.1”的方法分离颗粒层,将分离的颗粒层用Qiagen试剂盒提取细胞的总RNA,利用GoScriptTM Reverse Transcription System试剂盒进行反转录,获得各样品的cDNA。利用设计的NPFFR1定量引物对cDNA模板进行qPCR检测。反应体系:2× GoTaq®qPCR Master Mix 5 μL,上、下游引物各0.2 μL,模板cDNA 1 μL, CXR Reference Dye 0.2 μL,ddH2O 3.4 μL。扩增条件:95 ℃ 10 min;95 ℃ 15 s,60 ℃ 1 min, 40个循环。以GAPDH为内参基因,ABI7900H进行荧光定量检测,2-ΔΔCt法计算NPFFR1 mRNA基因在各阶段卵泡细胞中的相对表达量。

表1 引物序列
1.4 NPFFR1基因CDS区克隆及真核表达载体构建
以卵巢组织cDNA为模板,设计合适的扩增引物克隆NPFFR1基因的CDS区,反应体系:Q5 Hot Start High-Fidelity 2× Master Mix 25 μL,上、下游引物各1 μL,模板cDNA 1 μL, ddH2O 22 μL。扩增条件:98 ℃ 30 s;98 ℃ 10 s,58.5 ℃ 30 s,72 ℃ 30 s,35个循环;72 ℃ 2 min;16 ℃ 5 min。1%的琼脂糖凝胶电泳对PCR产物进行检测后,用胶回收试剂盒回收产物,连接T载体进行克隆测序,将测序结果正确的序列用Hind Ⅲ和EcoR I双酶切后,克隆到pcDNA3.1(+)质粒中,构建pcDNA-NPFFR1质粒,送样测序,将测序结构正确的质粒扩大培养,去内毒素抽提质粒,保存于-20 ℃,以备转染用。
1.5 NPFRR1基因过表达对颗粒细胞激素分泌的影响
取健康同批次产蛋四川白鹅(42周龄)的卵巢,同“1.3”中方法分离等级前和等级卵泡颗粒层,VI胶原酶充分消化分散细胞,将分散的细胞分别接种到含10%完全培养基的12孔细胞培养板中,每孔接种量5×105个,待细胞融合度达到70%后,LipofectamineTM3000 Transfection Reagent进行质粒转染,每孔质粒量1 μg,重复9个孔,设立空载对照。将转染72 h的细胞收集上清液和细胞沉淀,上清液送上海恒远公司,ELASA法检测细胞上清液中雌二醇(estradiol, E2)、孕酮(progesterone, P4)和抗缪勒管激素(anti-Mullerian hormone, AMH)的含量;一部分细胞沉淀经裂解,提取总RNA,一部分细胞收集,-80 ℃保存备用。
1.6 颗粒细胞过表达NPFFR1基因的转录组测序与分析
分离自大黄卵泡(8~10 mm)的颗粒细胞同“1.5”中的方法转染构建pcDNA3.1-NPFFR1质粒,设立空载对照,每个处理重复3个孔,72 h后收集细胞送百迈克生物测序公司进行转录组测序,测序方法和数据处理方法见课题组前期研究[18-19],Illumina Hiseq2000测序,注释参考鹅基因组来自于本课题组测序拼装[20],筛选差异表达基因(fold change≥2,FDR<0.05),获得的差异表达基因列表上传MetaScape网站(http://metascape.org),选择小鼠进行基因功能聚类分析。
1.7 NPFFR1基因过表达对颗粒细胞凋亡的影响
按照“1.5”的方法获得等级前卵泡(8~10 mm)颗粒细胞,接种到96孔细胞培养板中,每孔接种5× 104个,待细胞融合度达到70%后,LipofectamineTM3000 Transfection Reagent进行质粒转染,每孔质粒量100 ng,重复4个孔,设立空载对照。细胞转染72 h后采用广州锐博生物科技公司生产的一步法TUNEL检测试剂盒按使用说明检测细胞凋亡情况,随机取3个点,用ImageJ软件处理荧光信号强度。
1.8 数据分析
利用SPSS17.0软件GLM模块对试验数据进行方差分析,试验结果以“平均值±标准差”的形式表示,采用单因素方差分析,用LSD法和Duncan法进行多重比较和差异性子集分类,以P<0.05作为差异显著性判断标准。
2 结 果
2.1 NPFFR1 mRNA在四川白鹅各级卵泡颗粒细胞中的相对表达量
NPFFR1 mRNA在四川白鹅各级卵泡颗粒细胞中的相对表达量结果如图1所示,NPFFR1在各阶段卵泡颗粒细胞中均有表达,在等级前各阶段均处于低水平表达,但卵泡进入等级阶段发育后,NPFFR1表达量极显著上升(P<0.01),在F5阶段达到高峰,随后逐渐下降,直到进入排卵前卵泡F1阶段,出现极显著下调表达(P<0.01)。
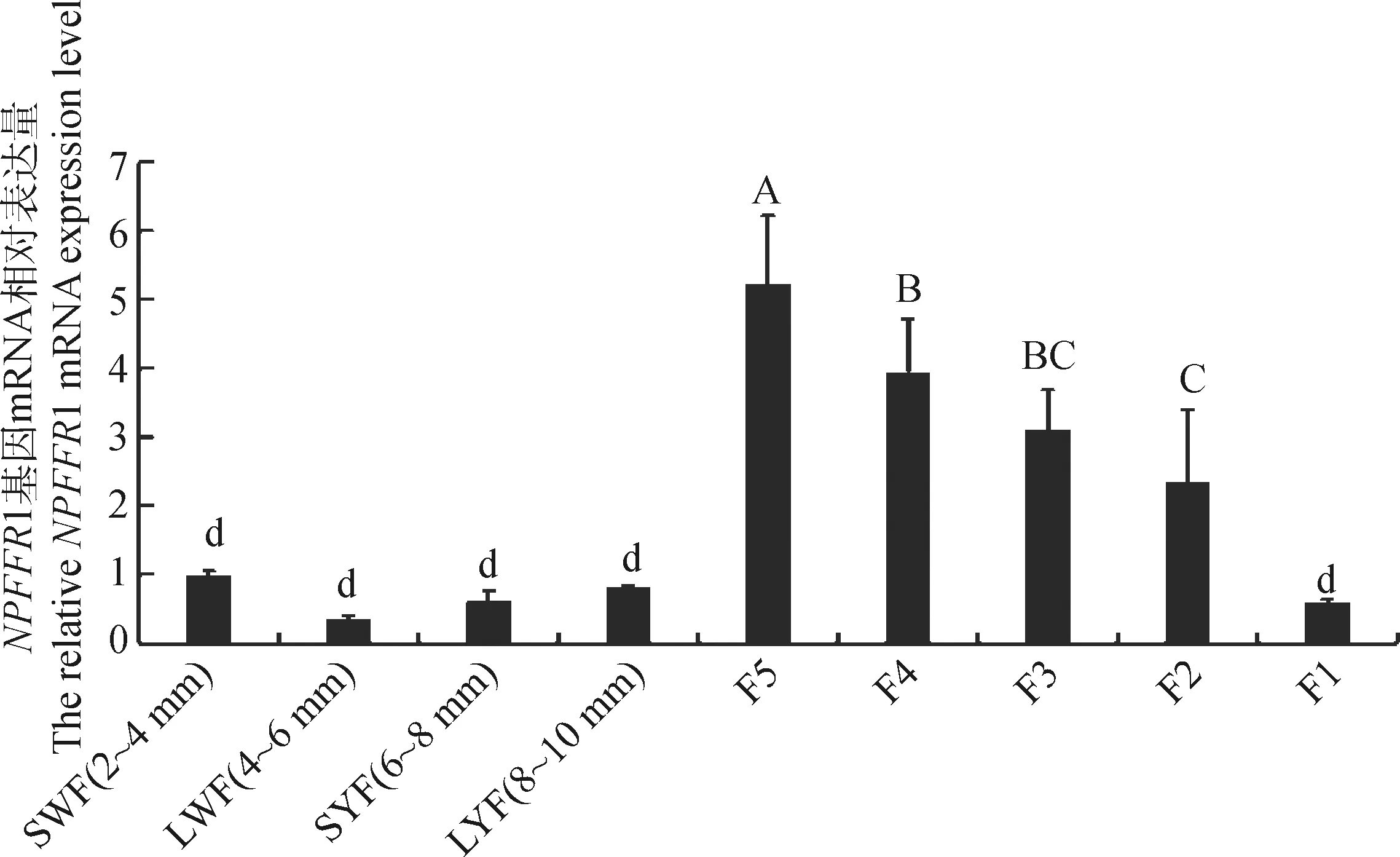
相同字母代表差异不显著(P>0.05),不同字母代表差异显著(P<0.05),大小写字母间代表差异在P<0.01水平显著The same letter means not significant difference(P>0.05), the different letters mean significant difference (P<0.05), the difference between upper and lower case letters means that the difference is extremely significant at the level of P<0.01图1 四川白鹅NPFFR1 mRNA在各等级前和等级卵泡颗粒细胞中的相对表达量Fig.1 The mRNA expression level of NPFFR1 in follicular granulosa cells of Sichuan white geese
2.2 鹅NPFFR1基因CDS区克隆及pcDNA3.1(+)-NPFFR1真核表达质粒载体构建
NPFFR1特异性引物PCR扩增后产物经琼脂糖凝胶检测获得了单一的特异性条带,大小与预期目的条带1 200 bp相符(图2A),将测序结果正确的片段经双酶切后插入pcDNA3.1(+)空载体中,质粒酶切结果如图2B所示,成功构建了pcDNA3.1(+)-NPFFR1真核表达质粒载体;将构建成功的质粒转染卵泡颗粒细胞,RT-PCR检测过表达效率,结果如图2C所示,颗粒细胞转染pcDNA3.1(+)-NPFFR1质粒后,NPFFR1极显著上调表达(P<0.001)。
2.3 NPFFR1过表达对鹅卵泡颗粒细胞分泌激素的影响
ELISA检测鹅卵泡颗粒细胞过表达NPFFR1基因后,细胞培养上清液中E2、P4和AMH 的含量,结果如表2所示,过表达NPFFR1后,对等级前卵泡颗粒细胞分泌E2无显著影响(P>0.05),但显著下调等级卵泡颗粒细胞E2浓度(P<0.05);过表达NPFFR不论是对等级前还是等级后颗粒细胞P4分泌都没有显著影响(P>0.05),但不论是否过表达NPFFR1,等级前颗粒细胞上清液的P4含量显著高于等级阶段颗粒细胞(P<0.05);过表达NPFFR1显著减少了等级前颗粒细胞分泌AMH(P<0.05),而对等级颗粒细胞影响不显著(P>0.05)。
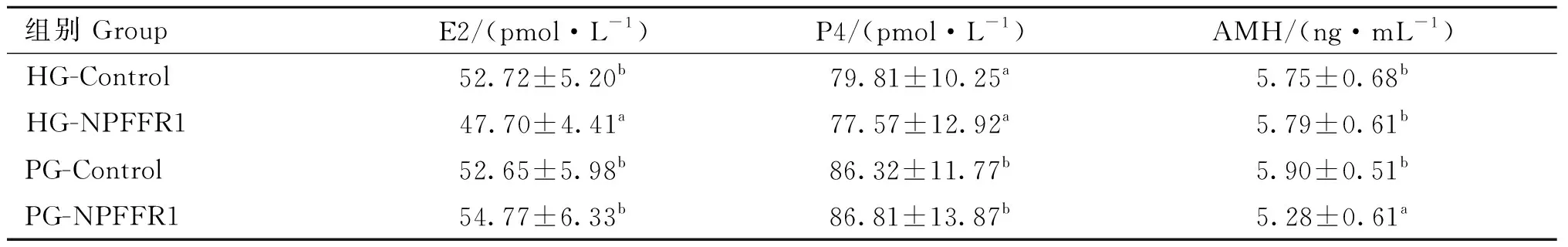
表2 颗粒细胞上清液中E2、P4和AMH的含量

A. NPFFR1基因完整CDS区扩增结果;B. 构建的pcDNA3.1-NPFFR1质粒双酶切鉴定;C. 颗粒细胞过表达NPFFR1效率检测。***. P<0.001A. The cloning result of the CDS region in NPFFR1; B. The pcDNA3.1-NPFFR1 plasmid confirmed by dual-enzyme digestion; C. The transfection efficiency of the pcDNA3.1-NPFFR1 plasmid in the granulosa cells.***. P<0.001图2 NPFFR1基因真核表达载体构建和过表达效率检测Fig.2 Construction of the pcDNA3.1(+)-NPFFR1 plasmid and its overexpression in the granulosa cells
2.4 NPFFR1基因对卵泡细胞凋亡的影响
颗粒细胞过表达NPFFR1后,相比于对照组,红色荧光信号增强,TUNEL染色阳性的细胞数明显多于对照组(图3)。过表达NPFFR1,促进了颗粒细胞的凋亡。

图3 过表达NPFFR1对颗粒细胞凋亡的影响(400×)Fig.3 Effect of NPFFR1 overexpression on apoptosis of granulosa cells(400×)
2.5 转录组数据分析结果与验证
颗粒细胞过表达NPFFR1前后,转录组测序数据与参考基因组比对结果如表3所示,匹配率介于87.90%~89.49%。共筛选到267个差异表达基因,其中148个显著上调,119个显著下调。对这些差异表达基因进行功能聚类分析后发现,其主要富集到胞内进程(GO:00009987)、繁殖进程(GO:0022414)、生物调节(GO:0065007)、细胞增殖(GO:0008283)、节律进程(GO:0048511)等,筛选与卵泡发育密切相关的基因AMH、FOS(proto-oncogene, AP-1 transcription factor subunit)、Clock(clock circadian regulator)、ANTXR2(cell adhesion molecule 2)和Per(period circadian regulator)等进行qPCR验证,结果显示(图4),AMH显著下调表达(P<0.05),FOS、Clock、ANTXR2和Per分别极显著(P<0.01)和显著(P<0.05)上调表达,与测序结果相一致。
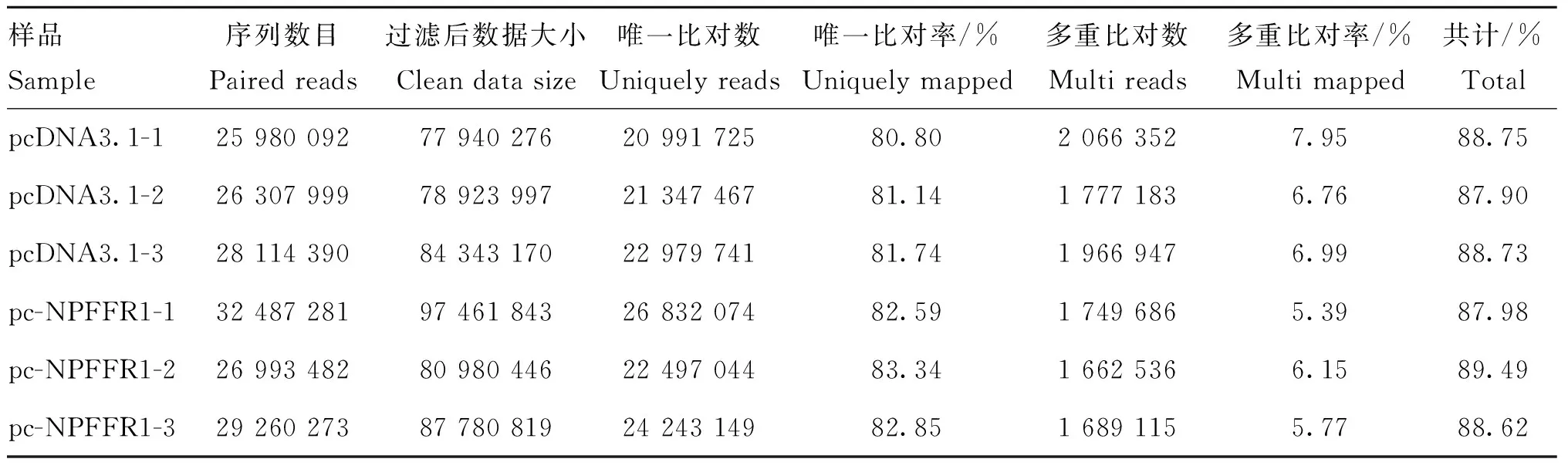
表3 颗粒细胞过表达NPFFR1基因转录组数据与参考鹅基因组的匹配率
3 讨 论
本研究发现,NPFFR1基因在各级卵泡颗粒细胞中均有表达,在卵泡由等级前向F5等级卵泡发育过程中,颗粒细胞中的NPFFR1极显著上调表达(P<0.01),在排卵的F1级阶段,又出现显著下调表达(P<0.05),提示NPFFR1可能直接参与了卵泡发育的这些重要过程。目前已有大量试验表明,禽类和哺乳动物中GnIH的同源类似物RFRP3,除了在下丘脑抑制GnRH神经元激活以释放促性腺激素[21-23],在卵巢组织也局部表达,可抑制许多脊椎动物的类固醇生成和卵泡发育[24-26]。
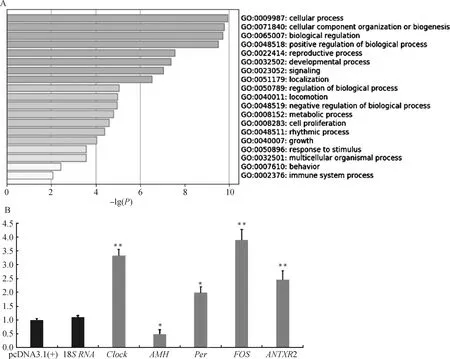
A.鹅卵泡颗粒细胞过表达NPFFR1基因后功能变化;B.Real-time PCR方法验证差异表达基因A.The gene function enrichment for the differentially expressed genes in the granulosa cells overexpressed NPFFR1; B.The validation of DEGs by real-time PCR图4 颗粒细胞过表达NPFFR1转录组数据分析与验证Fig.4 Analysis and validation of transcriptome data of NPFFR1 overexpression in granulosa cells
Henningsen等[27]研究发现,在叙利亚仓鼠中,RFRP3及其受体NPFFR1强烈受到光周期调控,通过kisspeptin节律性地调节促排卵黄体生成激素分泌;Biran等[28]证实,RFRP3及其受体(NPFFR1和NPFFR2)在猫卵巢中表达,低浓度RFRP3能降低体外培养的腔前卵泡存活率,促进孕酮分泌。家禽的卵泡发育是一个等级发育过程,大量的卵泡在等级前卵泡发育过程中会凋亡闭锁,只有极少数卵泡被选择优势化进入等级卵泡发育成熟并排卵,这个过程中颗粒细胞发挥着重要作用[29]。现有的研究表明,等级前颗粒细胞不论在形态还是功能上都与等级颗粒细胞有着明显差异[30-32]。本研究发现,在鹅等级卵泡颗粒细胞中过表达NPFFR1可显著下调雌二醇分泌(P<0.05),而对AMH分泌,在两个阶段的颗粒细胞则出现与E2相反的结果;尽管过表达NPFFR1对等级前后颗粒细胞分泌的P4影响均不显著,但由表2可知,等级前颗粒细胞和等级颗粒细胞分泌P4浓度存在着显著差异(P<0.05),这也进一步提示,NPFFR1对卵泡颗粒细胞激素分泌的影响存在阶段性差异。
为了进一步研究NPFFR1过表达对颗粒细胞的作用,本研究使用转录组测序的方法,筛选了一些与卵泡发育密切相关的繁殖进程(GO:0022414)相关的重要差异表达基因,其中包含AMH、FOS、Clock和Per等。AMH是由早期发育阶段卵泡颗粒细胞特异性产生的一种性激素,其血清含量是原始卵泡池大小的一个重要指标[33],在人类中直接影响着妇女的生殖时长[34-35],在本研究中,NPFFR1过表达抑制了颗粒细胞AMH的浓度,佐证了NPFFR1作为GnIH受体对繁殖的抑制作用。FOS是细胞增殖凋亡的重要调节基因,在卵泡发育中,FSH、LH等促性腺激素都可快速而短暂的促进卵泡颗粒细胞表达FOS,在排卵前起促进前列腺素释放的作用[36-37]。生物节律在大多数组织细胞中广泛存在,Fahrenkrug等[38]首先在大鼠的卵巢上发现一个昼夜节律钟,其核心钟基因Per1和Per2在24 h内有显著的震荡节律表达现象。Sellix[39]研究发现,卵巢的每一种细胞类型,包括卵泡膜细胞、颗粒细胞和卵母细胞,都有一个与卵泡生长、类固醇激素合成和排卵过程有关的分子钟,使得卵泡发育有着明显的时序性;Chen等[40]也证实,人卵巢的昼夜节律时钟与类固醇生成之间存在潜在的关系,睾酮影响颗粒细胞昼夜节律基因表达。本研究发现,过表达NPFFR1显著或极显著(P<0.05或(P<0.01))上调了Clock和Per的表达。进一步检测细胞凋亡情况,发现过表达NPFFR1使得凋亡荧光信号强度增强,细胞凋亡数量增加,而节律基因与细胞的增殖凋亡是密切相关的。Wang 等[41]给雄性大鼠睾丸内注射不同剂量的RFRP3引起了大鼠的剂量依赖性组织学改变:附睾管等精子数量减少,变性增多,附睾上皮细胞空泡化,诱导细胞凋亡和自噬相关基因caspase-3、Bcl-2、Beclin-1和Atg5的表达。Anjum等[42-43]研究表明,RFRP3结合其受体显著降低了睾丸细胞增殖和存活标志物(如PCNA和Bcl2)水平,增加了凋亡标志物如caspase3和PARP蛋白表达,抑制LHR和甾体生成酶、P450 scc和3β-HSD表达,抑制甾体的生成。NPFFR1上调了核心节律基因表达,并促进了颗粒细胞的凋亡,由此推测,颗粒细胞NPFFR1与核心节律基因可能存在着功能上的互作,这种互作影响卵泡颗粒细胞的凋亡。
4 结 论
在等级前和等级颗粒细胞中过表达NPFFR1基因,分别显著抑制了等级前和等级颗粒细胞内AMH和E2分泌,促进了颗粒细胞凋亡,调控了核心节律基因Clock和Per的转录水平,鉴于细胞凋亡、激素分泌与生物钟节律基因间的分子与功能耦合,推测NPFFR1可能从激素、细胞凋亡和生物节律等多个环节影响卵泡颗粒细胞,参与调控卵泡的时序等级发育。
