microRNA调控动物皮下脂肪组织和肌内脂肪沉积的研究进展
2021-11-04岳永起华永琳燕1林亚秋熊显荣1键1
岳永起,华永琳,熊 燕1,2,*,林亚秋,熊显荣1,2,,李 键1,2,*
(1. 青藏高原动物遗传资源保护与利用教育部重点实验室,成都 610041; 2. 青藏高原动物遗传资源保护与利用四川省重点实验室,成都 610041; 3. 西南民族大学畜牧兽医学院,成都 610041)
在动物生产中,不同部位脂肪组织沉积直接影响动物的产肉性能、肌肉品质和营养价值。目前,我国的产肉量基本满足国民生活需求,但是肉品质亟待提高,因此改善动物肉品质是动物遗传育种研究领域的重点。近年来,研究者在脂肪细胞的分化调控等方面取得了较大的研究进展,发现了多个脂肪沉积的蛋白编码基因,基本形成了脂肪细胞分化的蛋白调控分子网络。而脂肪沉积是一个复杂的生理生化过程,还受到非编码RNA在转录、转录后及翻译水平的调控作用。其中,miRNA由于具有高度的组织特异性,靶向脂肪沉积相关的关键调控因子调控脂肪沉积。miRNA对脂肪沉积的调控引起了研究者的广泛关注,并且在最新的研究中取得了较大的突破。因此,本文对最新研究成果进行综述,为miRNA在不同部位脂肪组织的差异沉积提供新的思路和方向。
1 脂肪组织的分类
1.1 不同类型的脂肪组织
当人们谈论脂肪时,通常是指脂肪的两个经典类型,即白色脂肪组织(white adipose tissue,WAT)和棕色脂肪组织(brown adipose tissue,BAT)。白色脂肪组织主要位于皮下及内脏器官周围,为动物机体提供隔热和保护的作用。主要功能是以甘油三酯的形式储存过剩的能量[1]。在机体需要时,这些能量将会释放出来。棕色脂肪组织内含许多散在的小脂滴和线粒体,将储存的能量以产热的形式消耗[2],这一过程主要通过位于棕色脂肪细胞线粒体内膜上的解偶联蛋白-1(uncoupling protein 1, UCP-1)发挥作用[3]。最近人们的研究发现,还存在其他的脂肪组织,如米色脂肪(beige fat)、粉红色脂肪(pink fat)和黄色脂肪(yellow fat)。米色脂肪是一种特殊的脂肪类型,在冷刺激下,白色脂肪组织会向米色脂肪组织转化[4]。研究发现尽管米色脂肪组织存在于白色脂肪中,但功能与棕色脂肪相似[5]。棕色和米色脂肪细胞通过上调UCP-1促进产热,维持动物机体温度的恒定[4]。粉色脂肪组织在雌性动物妊娠和哺乳期内由白色脂肪组织转化而来,由乳腺上皮细胞组成,主要参与乳汁的分泌[6]。黄色脂肪组织主要是骨髓脂肪细胞,形态与白色脂肪组织类似,但具有自己的特性。研究表明,黄色脂肪的成脂特异基因低表达,而与炎症应答相关的基因高表达[7],其在骨平衡及骨代谢方面起重要作用(图1)。

图1 脂肪组织的分类[6]Fig.1 Classification of adipose tissues[6]
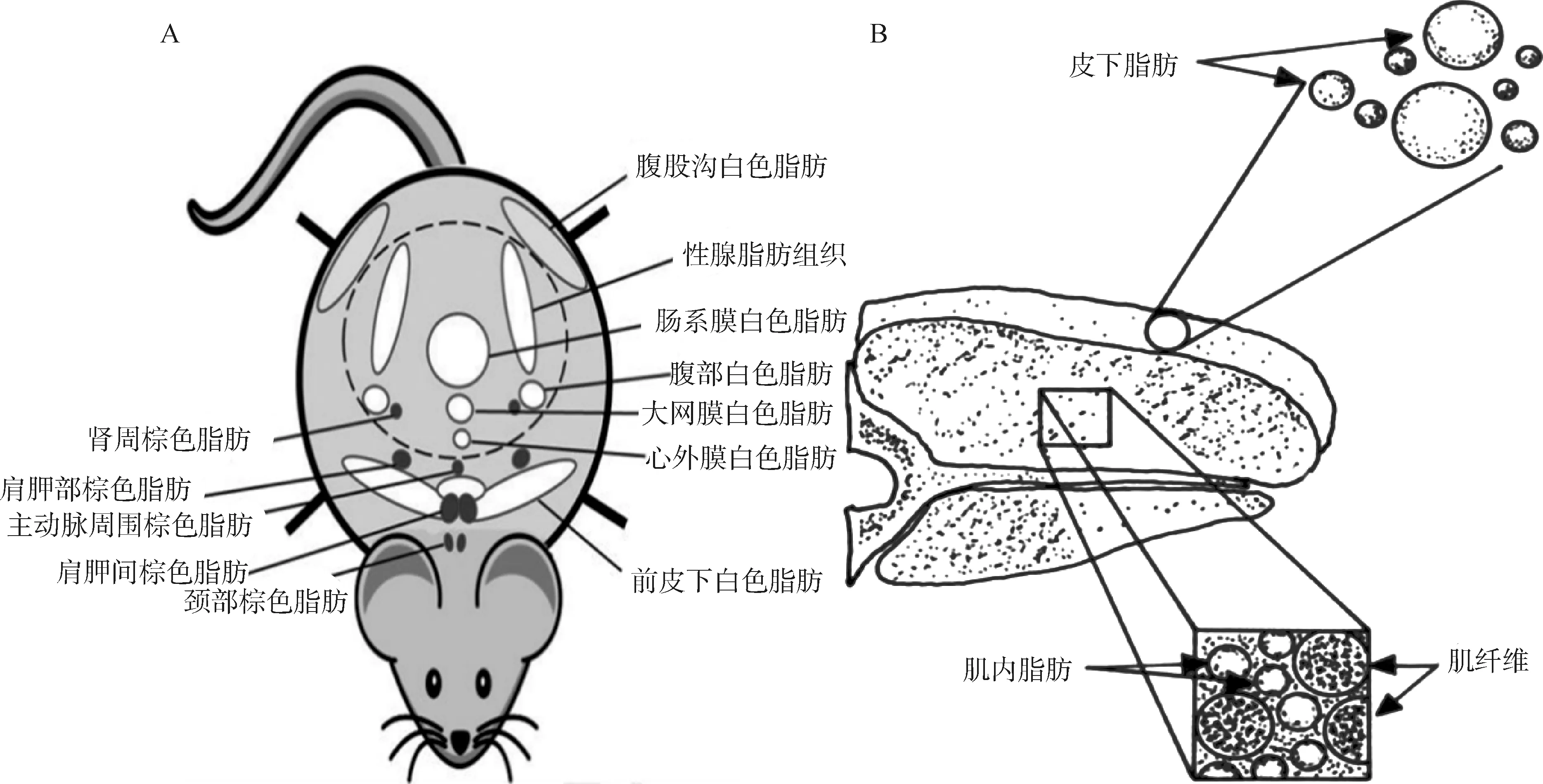
A. 皮下脂肪的分布;B. 肌内脂肪A.Distribution of subcutaneous fat; B. Intramuscular fat图2 小鼠脂肪组织解剖学位置[12-13]Fig.2 Anatomical locations of adipose tissues in mice[12-13]
1.2 不同部位的脂肪组织
根据脂肪组织解剖学部位的不同也可以将脂肪组织分为皮下脂肪、肌内脂肪和包裹腹腔脏器的内脏脂肪。皮下脂肪约占动物总脂肪含量的70%左右,主要贮存于皮下,如腹股沟白色脂肪、腹部白色脂肪等,主要执行隔热、保护[8]和储存的功能(图2A)。肌内脂肪组织位于肌肉纤维束内,均匀分布于肌肉组织中,与肌肉中的膜蛋白结合紧密。主要由肌内脂肪细胞组成,来源于间充质干细胞[9]。其含量与动物肉产品的品质密切相关,直接影响肉的多汁性、嫩度和风味(图2B)[10]。研究表明,皮下脂肪含量与肌内脂肪含量为中度相关,之前的研究发现,不同部位脂肪分化的分子调控和代谢存在差异,如miR-130a可以靶向PPARγ,但miR-130a在肌内脂肪的表达量显著高于皮下脂肪[11]。这种差异为探寻提高肌内脂肪的同时不影响皮下脂肪的沉积提供可能性。因此,筛选得到在皮下脂肪和肌内脂肪之间具有差异的miRNAs对研究不同部位脂肪沉积具有重要意义。
2 不同脂肪细胞的来源及分化
不同类型脂肪细胞来源不同,最初的研究表明,白色脂肪细胞和棕色脂肪细胞主要是由脂肪组织中的间充质祖细胞分化而来。其中Myf5+细胞在不同的转录因子作用下可分化为棕色脂肪细胞和肌细胞,白色脂肪细胞主要是由Myf5—细胞分化而来[14]。也有研究表明,白色脂肪细胞也可由Myf5+细胞分化而来[15]。近年来,有研究报道,通过同源转录因子En1标记中胚层的祖细胞及分化产物,发现棕色脂肪细胞和骨骼肌都起源于中胚层细胞[16]。这些细胞表达成肌标志基因生肌因子5(myofactor-5,Myf5)和配对框7(paired box 7,Pax7)[17],这与棕色脂肪细胞和肌细胞具有相同来源的观点一致。而通过建立WTI为启动子的小鼠,发现小鼠的内脏脂肪组织中的脂肪细胞大部分起源于胚胎期侧中胚层间皮细胞[18]。运用谱系追踪法,发现具有间充质特性的前脂肪细胞因子1(Pref-1)阳性细胞是分化早期的脂肪祖细胞,为皮下脂肪细胞的起源之一[14]。以上表明,脂肪细胞都起源于中胚层,但脂肪细胞的祖先并不单一,说明脂肪细胞有多种起源,在发育过程中各自发挥作用(图3)。

图3 脂肪细胞的来源及分化Fig.3 The source and differentiation of adipocytes
目前有关米色脂肪细胞的起源及遗传特性研究较少,米色脂肪存在于白色脂肪中,但功能与棕色脂肪细胞相似。目前研究报道表明,在冷刺激、激动剂等作用下,成熟的白色脂肪细胞可转化为米色脂肪细胞。也有报道认为,在iWAT中大部分的米色脂肪细胞具有特有的祖细胞,不是由WAT转化而来。研究发现,血清白细胞分化抗原137(Cd137)与跨膜蛋白26(TMEM26)是白色脂肪组织中米色脂肪祖细胞的标志基因[19]。表明米色脂肪细胞主要有两种来源:1)由成熟的白色脂肪细胞转化而来;2)由米色脂肪细胞祖细胞分化而来(图3)。
目前为止,有关于肌内脂肪细胞的起源尚不完全清楚。有研究报道,肌内脂肪细胞可以由体外肌卫星细胞分化而来[20]。Uezumi等[21]通过流式细胞分选技术,发现从骨骼肌分离出的PDGFRα+间质祖细胞也是肌内脂肪细胞的主要来源。以MyoD-Cre[22]、Myf5-Cre[23]和Pax3-Cre[24]介导的追踪小鼠模型发现,非肌源性祖细胞也可分化为肌内脂肪细胞。以上研究表明,肌内脂肪细胞可由间质干细胞或者其他类型干细胞分化而来。
3 miRNA对动物皮下脂肪沉积的影响
3.1 与皮下脂肪沉积相关miRNA的筛选
随着组学技术的快速发展,研究者发现并鉴定了与动物皮下脂肪沉积相关的miRNAs表达谱。在猪中,筛选了蓝塘猪和长白猪皮下脂肪组织差异表达的miRNA。在蓝塘猪中显著上调的miRNA有25个,包括 miR-183、miR-125b等;下调的有23个, 包括miR-221、miR-107等[25]。Xu等[26]通过RNA-seq获得了嘉兴黑猪皮下和肌内脂肪细胞的miRNA表达谱,鉴定出741个miRNAs,包括155个显著差异表达(SDE)miRNAs。其中miR-206过表达抑制细胞增殖和甘油三酯的积累。随着分子技术的发展,研究者通过下一代测序(NGS)方法,比较了3种(大白猪、皮特兰猪和汉普夏猪)不同脂肪特征猪种之间的miRNAome图谱,鉴定了差异表达的miRNA:大白猪46个,皮特兰猪61个,汉普夏猪41个, 共同存在于3个品种的有14个miRNAs[27]。
在反刍动物中,研究者通过基因芯片研究了成年肉牛肌内脂肪和皮下脂肪中差异表达的miRNA。发现miR-26a、miR-2373-5p、miR-2325c、miR-3613和miR-2361在皮下脂肪丰度最高[28]。基于EST(表达序列标签)和GSS(基因组概览序列)分析,Liang 等[29]在脂肪组织检测到20个保守miRNAs,其中miR-143、miR-145、miR-2325c和miR-2361可能调节脂肪沉积。此外,研究者鉴定出脂肪尾和细尾绵羊脂肪组织中共同表达的miRNA有539个,脂肪特异性表达miRNA分别有179和97个,发现了35个新的miRNAs,通路富集分析发现其主要通过脂质代谢影响脂肪的沉积[30]。
在家禽中,研究人员构建了鸡腹部脂肪组织的小RNA文库,鉴定出507个已知的miRNAs和53个新的miRNAs。发现miR-30、miR-34、miR-199、miR-8和miR-146等可能在脂质代谢、脂肪细胞增殖和分化等方面发挥关键作用[31]。以上研究通过组学技术探究miRNA在不同动物脂肪组织模型中的差异表达模式,同时发现miRNA在物种和组织中存在特异性,并且挖掘了很多新的miRNAs。近年来,研究人员重点研究了特定miRNA对不同部位或不同类型脂肪细胞分化及脂肪沉积的功能作用的分子机制,为完善脂肪组织的miRNA调控网络提供了理论数据,同时对改善肉产品质量和肥胖相关疾病的治疗提供了分子靶点。
3.2 miRNA负向调控动物皮下脂肪沉积
降低动物皮下脂肪的沉积对动物的产肉性能具有重要意义。有报道称,皮下脂肪组织的减少由以下两个因素决定:一是抑制脂肪细胞增殖和分化;二是抑制脂质积累和促进脂解。研究人员通过测序发掘了许多调控脂肪沉积的miRNAs,并对这些差异miRNAs在皮下脂肪沉积中的功能进行研究。其中,miR-378[32-33]、miR-155[34-35]、miR-204-5p[36]、bta-miR-130a/b和miR-27[37-38]家族等主要是通过抑制脂肪合成相关基因和促进脂解相关基因的表达来调控脂肪的沉积。miR-27通过PPARγ和脂肪酸结合蛋白4(fatty acid binding protein 4,FABP4)作用,抑制脂肪沉积[39]。过表达bta-miR-130a/b导致在脂肪生成过程中细胞甘油三酯(TG)水平显著下降,并通过靶向PPARγ减少脂滴形成[40]。而miR-27a[41]、miR-340-5p[42]、miR-145[43]miR-127[44]、bta-miR-150[45]、miR-99b-5p和miR-212[46]等主要是通过抑制脂肪细胞增殖和分化来调控脂肪沉积。如bta-miR-150过表达可以提高增殖相关基因周期蛋白依赖性激酶1(CDK1)、周期蛋白依赖性激酶2(CDK2)和增殖细胞核抗原(PCNA)的mRNA和蛋白质水平,进而促进脂肪细胞增殖,抑制脂肪细胞分化,减少脂滴的形成调控脂肪沉积[45]。过表达miR-99b-5p可以促进细胞周期,抑制脂肪细胞分化。结合蛋白质组学测序发现,miR-99b-5p可以直接与SCD1和Lpin1蛋白作用进而发挥功能[47]。上述研究表明,miRNA通过靶向细胞周期相关调控因子、成脂及脂质代谢相关基因,进而调控脂肪细胞的增殖、分化和能量消耗,最终影响动物脂肪沉积(图4)。

图4 调控脂肪沉积的miRNAFig.4 miRNA regulating fat deposition
3.3 miRNA正向调控动物皮下脂肪的沉积
研究发现,miR-143、miR-103和miR-15a/b等正向调控皮下脂肪的沉积。miR-143是发现最早的正向调控脂肪细胞分化的miRNA,Esau等[48-49]研究表明,miR-143通过靶向促分裂原活化蛋白激酶5(mitogen-activated protein kinase 5,MAPK5)、促分裂原活化蛋白激酶7(mitogen-activated protein kinase 7,MAPK7)和抑制多效生长因子(Pleiotrophin,PTN)促进脂肪细胞的分化。另一方面,miR-143通过靶向Smad家族成员3(Smad family member 3,Smad3)促进脂质合成相关基因的表达[50]。上述研究说明,miR-143是脂肪沉积重要的正向调节因子。在猪中研究报道,过表达miR-103通过上调成脂标志基因PPARγ和泛素关联蛋白2(ubiquitin associated protein 2,UBAP2),促进猪原代脂肪细胞的成脂分化[51]。miR-106a通过细胞周期负调控因子p21、成骨蛋白和促激蛋白膜结合抑制因子(BMP and activin membrane-bound inhibitor,BAMBI)促进猪前脂肪细胞的增殖和分化。miR-15a/b、miR-183和miR-125b-5p通过靶向Smad家族成员4(Smad family member 4,Smad4)和叉头框O1(forkhead box O1A,FoxO1)促进前体脂肪细胞分化[52-53]。在牛中有报道表明,miR-142-5P和miR-1271等在调节牛脂肪沉积中具有重要作用。Sui等[54]研究表明,miR-142-5P促进脂肪脂质代谢,主要是通过连环蛋白(钙粘着蛋白关联蛋白)β1(CTNNB1)来发挥作用。miR-1271激活转录因子3(ATF3)促进甘油三酯的积累,与调控转录因子PPARγ和C/EBPα结合促进黄牛前体脂肪细胞的分化[55]。此外,miR-220a通过抑制非经典的Wnt信号来增加脂肪细胞特异性基因的表达,促进牛脂肪细胞的分化[56]。除了上述促进脂肪沉积的miRNAs外,还有miR-22[57]、miR-425-5p[58]、miR-429[59]、miR-125a[60]、miR-324-5p[61]等也参与脂肪沉积的正向调控。上述结果说明,miRNA主要通过靶向促进脂肪细胞分化和脂质合成的相关基因来正向调控动物体脂肪沉积。
4 miRNA对肌内脂肪组织脂肪沉积的影响
4.1 与肌内脂肪差异沉积有关的miRNA筛选
动物脂肪沉积实质上是脂肪细胞数量的增多和体积的增大。而肌内脂肪的沉积相较于其他部位是较为困难的,肌内脂肪沉积是影响动物肉产品品质的关键因素。因此,从分子水平研究肌内脂肪沉积调控机制具有重要意义。研究者通过构建玫瑰冠鸡和科宝鸡两种鸡腿肌的小RNA文库,分析获得了表达差异显著的miRNA,其中公鸡腿肌对比库中差异表达显著的miRNA 有306个(上调154个,下调152个),母鸡腿肌对比库中差异表达显著的miRNA 有335个(上调171个,下调164个)[62]。Huang等[63]通过小RNA测序鉴定出了108个在水牛中差异表达的miRNAs,其中有98个已知的miRNAs和10个新的miRNAs,q-PCR验证结果显示,bta-miR-148a、bta-miR-143、bta-miR-10b、bta-let-7i、bta-let-7f、bta-let-7b、bta-miR-30a-5p和bta-miR-100在肌内脂肪组织中高表达。Li等[64]通过RNA测序对两头背最长肌肌内脂肪含量差异较大的新疆棕牛进行miRNA-mRNA相互作用网络构建,发现362个miRNAs表达差异显著,其中252个显著上调,110个显著下调。Sun等[65]对猪背最长肌肌内脂肪进行miRNA深度测序,结果表明,鉴定出268个miRNAs,其中已知miRNA 70个,在猪中保守的miRNA 162个,特异性miRNA 36个。检测金华猪和长白猪肌内脂肪miRNA的表达谱,发现了287个已知miRNAs和271个新miRNAs,其中220个 miRNAs在猪中差异表达,功能预测显示,这些miRNAs主要通过参与脂肪代谢来调控肌内脂肪组织的沉积[66]。鉴于肌肉组织中的主要细胞类型为多核肌管及骨骼肌卫星细胞,肌内脂肪细胞数量较少,因此以肌内脂肪沉积具有差异的肌肉组织筛选参与肌内脂肪沉积的miRNA存在一定的局限性。
4.2 以体外肌内脂肪细胞模型筛选调控肌内脂肪沉积的miRNA
随着试验技术的发展,近年来,研究者基于体外肌内脂肪细胞模型筛选差异表达的miRNA,发掘对肌内脂肪沉积具有重要作用的miRNA。研究者从脂肪组织中分离牛肌内前体脂肪细胞,诱导分化为成熟的脂肪细胞,对其进行RNA测序,发现差异表达的miRNA有119个;qPCR结果表明,miR-149-5p、miR-24-3p、miR-199a-5p、miR-33a等表达模式与测序结果一致;通路富集结果显示,差异表达的miRNAs主要参与脂质代谢[67]。通过Solexa深度测序方法对分化过程中的原代肌内和皮下脂肪细胞进行测序,发现了224个已知的miRNAs和280个潜在的miRNAs,其中特异性表达的miRNA 有30个(肌内脂肪细胞中24个,皮下脂肪细胞中6个), 同时发现,这些miRNA主要通过靶向脂肪生成基因来发挥功能[68]。
4.3 miRNA调控动物肌内脂肪的沉积
肌内脂肪含量与动物肉产品的感官品质和食用品质密切相关,直接影响着肉的风味、多汁性、嫩度、色泽。当下改善动物肉产品品质的主要难点集中于如何在保证瘦肉率的前提下,降低皮下脂肪的含量。通过对前人的研究结果进行总结,发现了一系列调控肌内脂肪沉积的miRNAs。例如,在鸡中,有研究发现gga-miR-140-5p[69]、miR-223[70]、miR-451[71]、miR-15a[72]和miR-155-5p[73]等在鸡肌内脂肪沉积过程中发挥重要作用。其中,幼鸡和具有肌内脂肪含量较高的成年鸡相比,差异表达的miRNA更多。gga-miR-140-5p可通过靶向类维生素a X受体γ(RARγ)促进肌内前体脂肪细胞分化。而乙酰辅酶A羧化酶α(ACACA)作为脂肪酸合成调控的关键因子,受到miR-451和miR-15a的调控,进而影响脂肪沉积。
在反刍动物中,miR-381和miR-17-3p是调控延边黄牛肌内脂肪沉积的重要miRNA,miR-381和miR-17-3p通过靶向抑制含钾离子通道四聚化结构域15(KCTD15)的表达,促进脂肪细胞的分化[74-75]。有研究表明,PPARγ是脂肪组织形成过程中重要的转录因子,miR-210[76]、miR-130a/b[40]、miR-540、miR-548 d-5p和miR-301a[77-78](表1)均可直接或间接靶向PPARγ来调控肌内脂肪细胞的分化。如miR-210通过靶向Wnt1可诱导信号通路蛋白2(WISP2)正向调控胎牛肌内脂肪细胞脂肪的形成[79]。WISP2与PPARγ转录激活因子锌指蛋白423(Zfp423)形成胞质复合物,而骨形态发生蛋白4(BMP4)以SMAD依赖的方式解离该复合物,最终导致PPARγ的激活[76]。miR-26b-5p、miR-106b-5p[80]和 miR-25-3p[81]等(表1)对羊肌内脂肪细胞分化具有重要作用,其中 miR-26b-5p通过靶向成纤维样因子21(FGF21)促进脂肪生成标志基因和脂质合成相关基因的表达,调控山羊肌内脂肪细胞的分化[82]。

表1 参与动物肌内脂肪沉积的miRNAs
在体外分离的肌内脂肪细胞中,差异表达的gga-miR-18b-3p通过靶向重组人酰基辅酶A硫酯酶13(Acyl-coenzyme A thioesterase 13,ACOT13)的3′UTR进而抑制肌内脂肪细胞的分化[83]。miR-17-5p的靶基因是核受体辅激活蛋白3(nuclear receptor coactivator 3,NCOA3),过表达miR-17-5p可抑制NCOA3的表达进而抑制前脂肪细胞分化,FABP4和PPARγ表达也明显降低,甘油三酯含量也降低。同时,敲低miR-17-5p可以显著增加NCOA3的表达,促进肌内脂肪细胞的分化[84]。此外,miR-125a-5p[85]、miR-124-3p[86-87]和miR-548d-5p[88]等也参与肌内脂肪沉积的调控(表1)。
5 展 望
随着人们生活水平提高, 消费者对肉品质提出了更高的要求,因此改善畜禽肉品质是动物遗传育种的热点关注问题。但是重点和难点在于降低皮下脂肪的含量的同时,适当提高肌内脂肪的沉积。近年来,科研人员发现miRNA对畜禽脂肪沉积调控具有重要作用, 而miRNA对于脂肪沉积的作用机制与网络还不完善。通过鉴定筛选与脂肪沉积调控相关的关键miRNA, 进一步完善miRNA调控脂肪沉积的作用网络和分子机制, 将为畜禽肉品质的遗传改良和肥胖相关疾病的治疗提供新的靶点和策略。
